结核性毁损肺46例外科治疗体会
高毅哲 林伟鹏 钟宏源 高木火 吴艺根 李占清
毁损肺是指肺组织单发或者多发的纤维化、干酪样病变,局部胸膜增厚、粘连,部分伴有支气管扩张、空洞形成。这部分肺组织已经基本丧失了正常的气体交换功能,并常常导致各种感染甚至是致命性的大咯血。毁损肺的病因较多,其中最常见的是因为不及时、不规范的抗结核治疗导致的结核性毁损肺。毁损肺一旦形成,药物治疗基本无效,手术治疗被一致认为是有效的治疗手段[1]。为了进一步研究结核性毁损肺手术治疗的可行性及意义,本研究回顾性分析了2015年6月~2020年9月在我院手术治疗的46例患者,疗效满意,现总结、分析如下。
1 材料与方法
1.1 一般资料本组患者共46例。入选标准:①术前评估心肺功能可以耐受手术;②符合结核性毁损肺的诊断标准(F12 1-3);③术前均行气管镜检查排除支气管内膜结核;④患者及家属同意手术;⑤术前均抗结核治疗2周以上(治疗方案由抗结核专家制定)。其中男31例,女15例,年龄28~67岁,平均(42.1±4.6) 岁;病程6个月~14年,平均(6.2±3.1)年;病灶部位:右上肺18例,右全肺4例,左上肺16例,左全肺8例;肺功能检测:FEV1(1.69±0.6)L,占预计值(63± 11.2)%,MVV(51.2±14.6)L,占预计值(58.6± 10.1)%;血气分析:PO2(63.5±13.2)mmHg,PCO2(42.5±11.3)mmHg,SO2(93.1±3.2)%。
1.2 方法本组患者均在完善术前准备后行手术治疗。根据患者的身体状况及病灶部位的不同,具体的手术方式为:右肺上叶切除14例,右肺上叶切除+背段切除3例,右肺上叶切除+中叶切除1例,右全肺切除4例;左肺上叶切除14例,左肺上叶+背段切除2例,左全肺切除8例。其中完全胸腔镜下手术(包括辅助小切口)29例,开放手术17例。
1.3 观察指标①观察分析术前、术后3个月的肺功能FEV1及占预计值比例,MVV及占预计值比例;血气分析(PO2、PCO2、SO2);②收集术后患者的引流量、胸管留置时间、术后住院天数、肺部感染发生率、疼痛评分等指标。
1.4 统计学方法应用SPSS 20.0软件对数据进行统计处理,计数资料采用χ2检验,计量资料采用t检验,P<0.05为差异有统计学意义。
2 结果
46例患者均完成手术并康复出院。术后病理均符合结核性毁损肺的诊断。13例出现并发症,包括术中大出血2例,术后当天出血量多1例,肺部感染5例,支气管胸膜瘘3例,肺复张不全2例。其中2例行二次开胸手术治疗并发症(大出血1例,支气管胸膜瘘1例),另外2例支气管胸膜瘘及1例术后大出血均保守治疗成功。随访4个月~5年均无咯血或血痰、复发或死亡。术后3个月复查肺功能、血气分析均较术前有明显改善,差异具有统计学意义(P<0.05),见表1。腔镜组胸管留置时间及术后住院时间均短于开放组,差异具有统计学意义(P<0.05),见表2。腔镜组术后6h、第1天、第3天及第5天的疼痛评分均明显低于开放组,差异具有统计学意义(P<0.05),见表3。

表1 手术前后肺功能指标比较
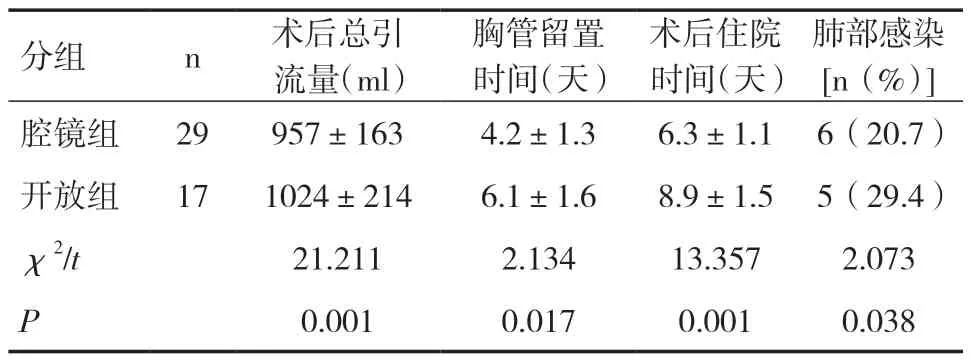
表2 两组术后的临床资料对比
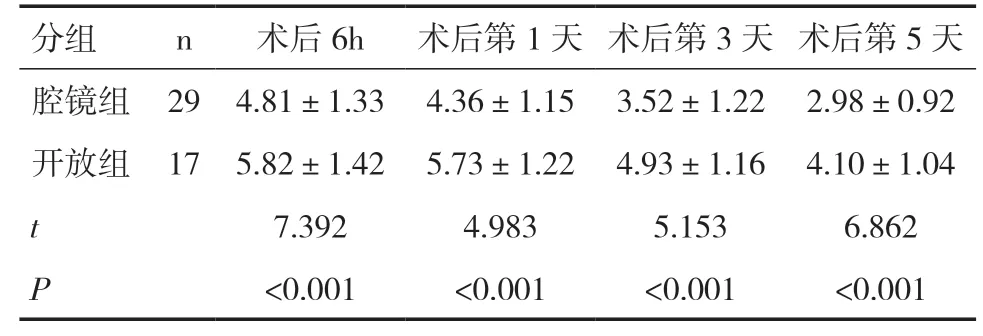
表3 两组术后不同时间点的疼痛评分对比
3 讨论
结核性毁损肺的治疗一直以来都是困扰临床医生的难题。由于结核的长期破坏,使肺部出现广泛的纤维化及干酪样坏死[2],并且这种变化往往是很难逆转的,抗结核药物难以渗透进入病变部位,同时由于药物应用的时间比较长,容易产生耐药菌,从而导致内科抗结核治疗效果不佳[3,4]。此外,毁损肺的患者大部分会向外界排菌,容易造成结核的播散,对社会危害较大。再加上毁损肺的形成容易使患者出现咳嗽、咯血、气促等症状,严重影响患者的生活质量甚至危及生命。因此,外科手术成为治疗结核性毁损肺的首要选择[5]。
临床一般根据病灶的部位及患者的身体情况来决定手术的部位及范围。若病灶局限于一个肺叶内,仅需切除患侧的肺叶,但临床上经常碰到上叶及下叶背段均有病变的患者,这时需要行上叶切除+下叶背段切除,本组共有5例患者行该手术。若病变累及的范围较广,正常肺组织较少,则需要行全肺切除,本组有12例患者行全肺切除(其中右全肺4例,左全肺8例)。切除下来的肺组织大体标本及病理检查多为纤维化伴实变,局部呈蜂窝状、胶原变性、钙化及肉芽肿等,这些病变组织丧失了进行气体交换所需要的形态与功能。手术不仅清除病灶,解决了咯血、排菌等问题,还能通过减小无效分流面积使肺部的通气/血流比例失调得到改善[6],同时还能使残余的正常肺组织复张,达到提高肺功能的目的。在本研究中,患者术后的FEV1、MVV、PO2、SO2等指标均有不同程度的提高,且术后患者活动后气促等症状均有不同程度的缓解。
尽管外科手术效果良好,但是由于结核性毁损肺的手术难度大,且术后并发症较多[7],相当一部分胸外科医生不愿意积极开展,客观上限制了该项手术的开展。回顾既往的46例手术病例,为提高手术效果,减少并发症,在围手术期的处理上作者有如下几个方面的体会:①术前充分准备。首先结核性毁损肺的患者病程都较长,可长达数年甚至更长时间,普遍存在不同程度的焦虑及心理负担,充分地做好术前宣教能够帮助患者树立对手术的信心,并积极配合治疗,提高疗效;其次长期服用抗结核药物副作用较大,患者食欲不佳,营养状况差,术前要充分评估其身体状况包括心、肺功能,生化等指标,并指导患者进行呼吸功能锻炼、高蛋白饮食等,必要时可行静脉高营养、输血、输白蛋白等;再者术前要根据世卫组织指南及呼吸内科抗结核专家意见规范抗结核治疗2周以上,同时行常规气管镜检查排除支气管内膜结核以减少胸膜瘘发生的风险。②术中精细操作。与其他的肺部疾病相比,结核性毁损肺的最大特点是显著的胸腔粘连[8],同时还伴有肺门处淋巴结的炎性增生、钙化。粘连往往广泛、致密,尤其是在胸膜顶、后胸壁等部位,手术风险及难度也随之增加。稍有不慎可能损伤胸腔内重要的血管及其他组织,甚至造成不可挽救的后果。这就要求术者在术中做到精细操作。大部分患者在前胸壁及心包处粘连较为疏松,术者可先从此部位入手,逐渐向粘连比较重的肺门及后胸壁分离,若碰到致密性的肺门粘连,可在心包内处理血管,避免盲目游离血管造成大出血。部分患者胸膜顶粘连较紧,此处容易损伤锁骨下的血管,若肺门结构较游离,可先处理肺门,再分离前、后胸壁的粘连,使胸膜顶处呈孤立状态,以便于操作。值得注意的是,由于手术创面较大,在准备关胸之前,一定要详细检查创面有无活动性出血,本组有2例患者关胸之前发现创面有活动性渗血,均及时处理,从而避免再次开胸止血。③术后细致管理。结核性毁损肺术后的并发症发生率较高且较严重,因此我们术后要做到细致的管理,主要体现在以下几个方面:手术时间较长,且术前多数伴有呼吸道炎症,术后要加强雾化,鼓励患者有效咳嗽、咳痰,避免痰液淤积导致或加剧肺部感染,必要时予鼻导管或纤支镜吸痰;手术创伤较大,术后患者的顺利恢复有赖于足够的营养,热卡要充分,部分患者术后胃肠功能恢复较慢,食欲差,单纯肠内营养不足时,可经静脉补充,必要时可输注血浆或白蛋白;对于行肺叶切除或肺叶联合部分肺组织切除的患者,残肺的及时复张有利于创面的止血,以及减少肺部感染及支气管胸膜瘘发生的几率,因此术后要及时敦促患者进行吹气球等呼吸功能锻炼,若复张不佳时积极行气管镜吸痰、经胸腔引流管持续负压吸引等措施;引流要充分,过早地拔除胸腔引流管容易造成残腔的形成甚至再次插管。
既往认为胸腔粘连是胸腔镜手术的禁忌[8]。随着胸腔镜技术的不断成熟与进步,越来越多的胸外科医生尝试使用电视辅助胸腔镜手术(VATS)治疗毁损肺[9]。手术的难点在于广泛的胸腔粘连阻碍摄像镜头的置入与手术视野的暴露。先在腋中线第7肋间做一长约2cm的切口,此时暂不急于置入摄像头,先将左手手指放入切口钝性剥离胸腔内的粘连创造第一间隙,然后在腋前线第4肋间做一长约3~5cm的切口,通过右手手指或卵圆钳在胸膜外钝性分离粘连并与第7肋间的第一间隙“会师”,建立隧道。此时可置入摄像头,在镜头的引导下经第4肋间切口分离胸腔的粘连并逐步完成手术。与传统的开放手术相比,胸腔镜手术不仅能大大缩小切口从而减轻术后疼痛,减少镇痛药的应用,同时对开放手术视野的盲区如胸膜顶等区域也能很好地显露,减少重要组织损伤的风险。此外胸腔镜对手术视野也有放大的作用,能及时发现创面的渗血,从而减少出血。本研究中共有29例患者行胸腔镜手术,与17例开放手术病例相比,疼痛评分、胸管留置时间及术后住院时间等指标均较低,差异具有统计学意义。这说明对于熟练掌握胸腔镜技术的胸外科医师来说,使用VATS治疗结核性毁损肺还是具有一定优势的。但是毁损肺患者常伴有肺门淋巴结的致密粘连,血管分离困难,容易损伤。遇到这种情况不应盲目地追求完全腔镜下手术,而应果断地辅助小切口(6~10cm)在直视下解剖肺门的血管及支气管[9,10]。
综上所述,结核性毁损肺内科药物治疗效果不佳,在充分做好术前评估及准备的前提下,手术是安全、可行的。随着胸腔镜技术的不断成熟与进步,围手术期处理的不断完善,可逐步降低手术的并发症发生率及死亡率并提高手术效果。

