免疫球蛋白A、MeCP2和炎症因子水平与特发性肺纤维化患者肺功能的相关性
钱建德,孙荣强,宦才娟
(杭州市余杭区第三人民医院 呼吸内科,浙江 杭州 311115)
特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)是一种常见的进行性、慢性、纤维化性的间质性肺疾病,临床病理学表现为普通型间质性肺炎,主要特征为呼吸困难及肺功能恶化[1-2]。IPF起病较为隐匿,目前发病机制尚不明确,临床仍缺乏有效的治疗手段,多数患者诊断时已是中晚期,往往预后极差,中位数生存时间一般为3年,五年生存率甚至低于恶性肿瘤[3]。有研究[4]表明,IPF早期漏诊率较高,且该疾病的严重程度判断指标不丰富,患者易错过最佳治疗时期而导致预后不佳。免疫球蛋白A(IgA)是重要的黏膜抗体,与IPF的预后存在密切联系[5]。炎症因子在纤维化过程中发挥重要的作用。甲基化CpG结合蛋白(MeCP2)可通过增加脂多糖水平诱导炎症因子分泌[6]。本研究通过观察IPF患者中免疫球蛋白A、MeCP2和炎症因子水平的变化情况,分析上述指标与IPF患者肺功能的相关性,以期为临床防治提供参考。
1 资料与方法
1.1 一般资料 选取2018年10月—2019年10月杭州市余杭区第三人民医院收治的IPF[7]患者40例为观察组,其中男26例、女14例,平均年龄(59.33±6.54)岁。排除合并严重高血压、糖尿病等基础疾病者,有精神疾病者,合并严重心、肝等系统性疾病者,合并严重感染、免疫类疾病者,合并其他恶性肿瘤者,近期服用激素类药物者。同期另选40例有胸闷、胸痛等直觉症状,但经影像学和纤维支气管镜检查为健康者的研究对象为健康对照组,其中男23例、女17例,平均年龄(60.27±7.21)岁。2组性别、年龄等临床资料比较差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准,所选研究对象均知情同意。
1.2 观察指标及检测 抽取2组研究对象空腹静脉血3 mL,离心后取上层血清置-20℃保存。采用免疫比浊法检测 IgA水平,试剂盒购于上海宝曼生物有限公司。采用酶联免疫吸附法(ELISA)测定血清MeCP2及炎症因子肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)水平,所用试剂盒购于R&D Systems公司。采用肺功能仪(MasterScreenTMPFT System)记录用力肺活量(FVC)、第一秒用力呼吸量(FEV1)及呼气流量峰值(PEF),参考美国胸科协会指南方案观察6 min步行距离。
1.3 统计学分析 采用SPSS21.0进行数据处理与分析,计数资料采用χ2检验; 计量资料组间比较采用t检验,相关性分析采用Pearson检验,采用ROC曲线评价各指标的诊断性能,P<0.05表示差异有统计学意义。
2 结果
2.1 一般资料比较 观察组与健康对照组体质量指数、饮酒时间、吸烟时间及高血压、2型糖尿病比例比较,差异均有统计学意义(P<0.05),见表1。
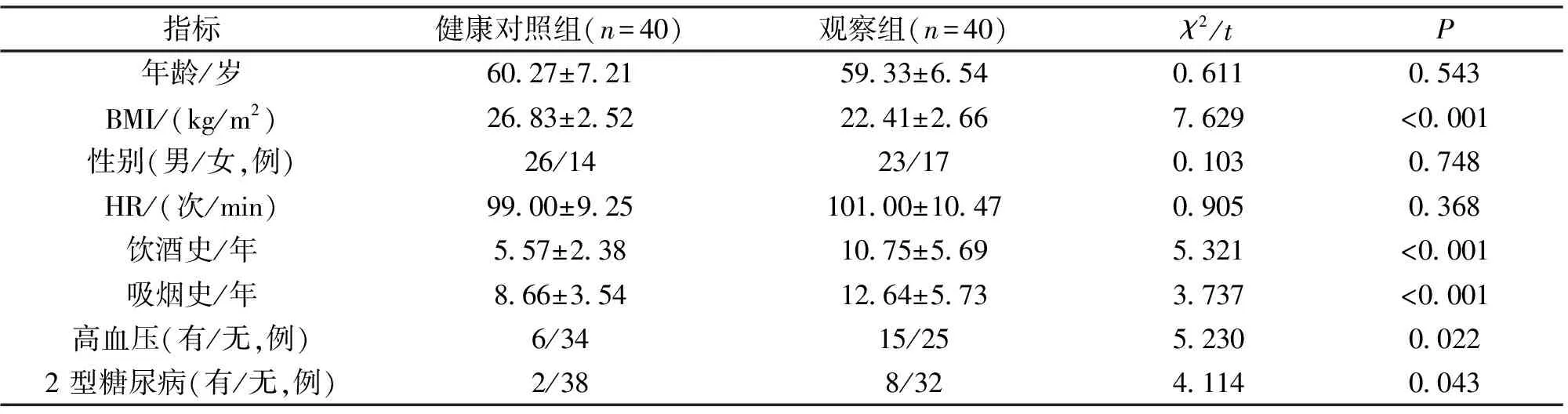
表1 一般资料比较Table 1 Comparison of general information
2.2 观察指标比较 观察组血清IgA、MeCP2、TNF-α和IL-6水平均高于健康对照组,FVC、FEV1、PEF及6 min步行距离均低于健康对照组,差异均有统计学意义(P<0.05),见表2。

表2 各观察指标比较Table 2 Comparison of observation indexes between the two
2.3 相关性分析 经Pearson相关性检验表明,观察组患者血清IgA、MeCP2、TNF-α和IL-6水平分别与FVC、FEV1、PEF及6 min步行距离呈负相关(P<0.05),见表3。
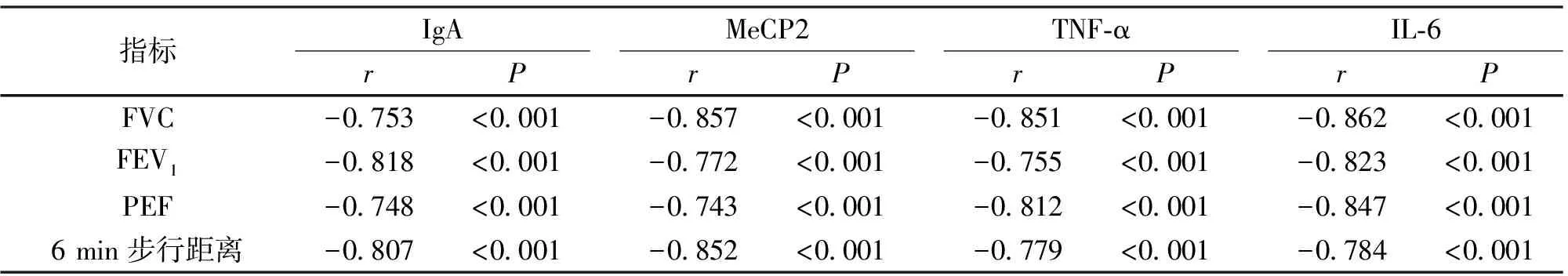
表3 特发性肺纤维化患者各观察指标间的相关性分析Table 3 Correlation analysis of observation indexes in patients with idiopathic pulmonary fibrosis
2.4 诊断价值分析 采用ROC曲线分析IgA、MeCP2、TNF-α和IL-6对IPF患者的诊断价值,IgA、MeCP2、TNF-α和IL-6的AUC值分别为0.754,0.629,0.715和0.604,该4个指标联合检测的AUC值为0.833(图1)。
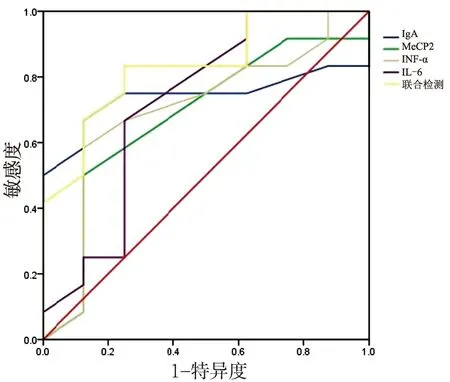
图1 特发性肺纤维化患者ROC曲线图Figure 1 ROC curve of patients with idiopathic pulmonary fibrosis
3 讨论
特发性肺纤维化发病机制较为复杂。有研究[8]指出,特发性肺纤维化存在一定的遗传易感性,吸烟、粉尘、矿物、木尘等外部因素均是诱导特发性肺纤维化发病的危险因素。本研究结果显示,特发性肺纤维化患者与健康对照组的体质量指数、饮酒时间、吸烟时间、高血压、2型糖尿病比例存在明显差异。
早期诊断和积极治疗对改善特发性肺纤维化患者预后具有重要意义。目前,影像学和病理学的诊断较为复杂,肺活检创伤大,肺功能指标干扰因素较多,上述检查对判断病情严重程度均具有一定的局限性。特发性肺纤维化源于肺泡上皮因微小损伤后发生反复的异常修复,上皮异常激活多种因子分泌,诱导纤维细胞增生,促进纤维细胞灶形成,导致肺部出现纤维瘢痕、蜂窝囊,进而破坏肺部结构[9]。IgA是由黏膜淋巴样组织分泌的重要抗体[10],转化生长因子β是一种可直接导致组织纤维化的细胞因子。有研究[11]指出,转化生长因子β在IgA的合成中起着至关重要的作用,其水平的增加可直接导致IgA水平的上升。Ten等[12]研究表明,特发性肺纤维化患者血液中IgA水平升高与患者死亡具有密切的关系。另有研究[13]指出,多种炎性因子在肺纤维化发病过程中发挥关键的作用。IL-6是主要由巨噬细胞、单核细胞以及成纤维细胞分泌的一种常见的炎性因子,是目前已知的炎症因子家族中的核心成员之一[14]。通过对大鼠肺纤维化模型研究表明,模型组IL-6水平明显高于正常大鼠,IL-6的动态表达与大鼠肺纤维化肺泡炎症变化趋势相一致[15]。TNF-α是一种促炎因子,可促进局部成纤维细胞的增殖、迁移,可加快胶原沉积,促进纤维化形成[16]。有研究[17]指出,采用二氧化硅诱导小鼠肺纤维化的过程中,巨噬细胞可产生TNF-α,可明显增加胶原沉积。MeCP2是一种表观调控因子,是参与多种疾病的表观遗传关键参与者,可通过激活多种信号通路增加IL-6和TNF-α的表达[18]。
本研究结果显示,特发性肺纤维化患者血清IgA、MeCP2、TNF-α和IL-6水平均明显高于健康对照组,FVC、FEV1、PEF及6 min步行距离明显低于健康对照组,观察组患者血清IgA、MeCP2、TNF-α和IL-6水平与FVC、FEV1、PEF及6 min步行距离呈显著负相关。高耐芬等[19]研究同样表明,特发性肺纤维化患者血清IgA、TGF-β1及炎症因子与肺功能具有显著相关性。
综上所述,血清IgA、MeCP2、TNF-α和IL-6水平与特发性肺纤维化患者的肺功能相关,4个指标联合对于特发性肺纤维化具有一定的诊断价值。

