不同基因型鹅星状病毒鉴别诊断RT-PCR方法的建立
王宏宇, 朱寅初, 云涛, 华炯钢, 叶伟成, 倪征, 陈柳, 张存
(1.浙江省农业科学院 畜牧兽医研究所,浙江 杭州 310021; 2.南京农业大学 动物医学院,江苏 南京 210095)
2014年在我国湖南首次报道发现鹅星状病毒(Goose astrovirus,GAstV),随后在辽宁、山东、江苏、安徽乃至广东等主要养鹅省份均陆续出现以内脏痛风为典型临床症状的传染病,经分离鉴定,病原为星状病毒,且基因组序列有别于湖南发现毒株[1-3]。当前证据显示,该病主要可导致5~20 d龄雏鹅发病,患病雏鹅表现为精神沉郁,卧地不动,采食下降甚至死亡,剖检可见心脏和肝脏表面明显的粉末状白色尿酸盐沉积,肾脏肿大坏死[4]。流行病学调查显示,近年来该病造成的死亡率由最初的5%逐渐上升,最高可达50%,给我国养鹅业带来严重危害,造成巨大经济损失[5]。
鹅星状病毒基因组分析显示,其为单股正链无囊膜RNA病毒,基因组全长约7~8 kb,两侧为5′UTR和3′UTR(具PolyA尾),包含ORF1a、ORF1b和ORF2 3个开放阅读框(ORF)[6-8]。ORF1a编码多种非机构蛋白;ORF1b序列与ORF1a存在重叠,编码保守的RNA依赖性RNA聚合酶(RbRp);ORF2为病毒结构蛋白,包裹病毒外表面,形成衣壳和纤突结构。随着越来越多病毒基因组的测序显示,已报道的鹅星状病毒存在两种基因型,核酸序列差异大,临床调查显示单一和混合病毒感染等多种情况均有出现;鉴于当前鹅星状病毒的致病机制尚不清楚,感染情况复杂,因而对该病毒的及时检测发现对后期防控尤为重要。在实际病原鉴定中针对一种基因型的鹅星状病毒的PCR检测不仅目标样本单一,而且操作工序复杂,成本高,费时费力,因而本试验根据GenBank公布的GAstV 编码RbRp的基因序列设计特异性引物,尝试建立双重一步法RT-PCR检测体系,可直接以RNA为模板,并达到同一体系检测不同基因型鹅星状病毒的目的,为临床混合感染和流行病学调查提供快速有效的技术支撑。
1 材料与方法
1.1 材料
2017—2020年,共采集来自浙江和江苏共73份雏鹅及鹅胚样本,全部样品记录品种、日龄、组织、地点等信息,并于-80 ℃冰箱保存。鸭瘟[9](Duck plague virus,DPV)、鹅细小病毒(Goose parvovirus,GPV)、坦布苏病毒[10](Goose-origin tembusu virus,GTMUV)、鹅呼肠孤病毒[11](Goose-origin reovirus muscovy duck reovirus,GRV)、H9N2亚型禽流感病毒(Avain influenza virus,AIV)均由本实验室保存。磁珠法病毒RNA抽提试剂盒购自济帆科技生物有限公司。TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0、TaKaRa MiniBEST DNA Fragment Purification Kit Ver.4.0和DNA Marker 5000为TaKaRa公司产品;HiScript II One Step RT-PCR Kit(Dye Plus)为Vazyme公司产品;Plasmid Mini Kit为OMEGA公司产品。
1.2 引物设计与合成
根据GenBank上发布的两种不同序列的GAstV病毒基因序列,选取RdRp保守序列区域利用Oligo 7.0软件分别设计两对特异性引物,用于扩增对应GAstV病毒,引物由铂尚生物技术公司合成(表1)。

表1 试验引物的基本情况
1.3 PCR扩增
单一RT-PCR分别以对应的鹅星状病毒作模板扩增,建立20 μL体系:2×One Step Mix 10 μL,One Step Enzyme Mix 1 μL,ddH2O 6 μL,上下游引物各1 μL,RNA模板1 μL。反应条件:50 ℃ 30 min;94 ℃ 3 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 min,35个循环,72 ℃ 7 min,4 ℃保存扩增产物;经2%琼脂糖凝胶电泳检测分析,测序鉴定。
对双重RT-PCR反应的引物、模板等用量,退火温度等参数设置梯度,通过优化和多次重复实验后,确定最佳反应体系,同时设置阴性对照。PCR扩增产物进行凝胶电泳分析鉴定。
1.4 双重RT-PCR特异性试验
根据建立并优化的多重PCR方法对水禽常见病毒包括GTMUV、GPV、MDRV、DPV和AIV进行检测,以鉴定其特异性。
1.5 敏感性试验
使用目的片段所在基因的克隆载体作为阳性质粒,用NanoDrop测定核酸浓度,计算阳性质粒拷贝数。其后将质粒模板进行10倍梯度稀释,并以优化条件进行多重PCR敏感性测试。
1.6 稳定性试验
用建立的双重RT-PCR方法间隔一周对样本重复检测,每次不同浓度设置3个重复,连续检测3次后,以验证此PCR方法的可靠性和稳定性。
1.7 临床样本应用试验
将实验室在周围地区养殖场采集和送检的病死鹅及鹅胚等样本73份进行核酸提取,应用建立的双重RT-PCR方法对其进行检测,并用单一的PCR方法进行复检比较,以检验此方法在实际应用中的效果。
2 结果与分析
2.1 单片段扩增
根据已经公布的新型鹅星状病毒全基因组序列,进化分析显示其可分为两个基因型,Group Ⅰ和GroupⅡ,且两者序列差异较大(图1)。单一引物PCR结果显示,各引物可有效扩增出目的基因,条带单一清晰,条带大小与预期相符,彼此间序列不产生交叉,测序结果比对证实为鹅星状病毒编码RdRp基因序列,大小分别为Ⅰ型441 bp,Ⅱ型为277 bp(图2),适合鹅星状病毒的检测及分型鉴定。
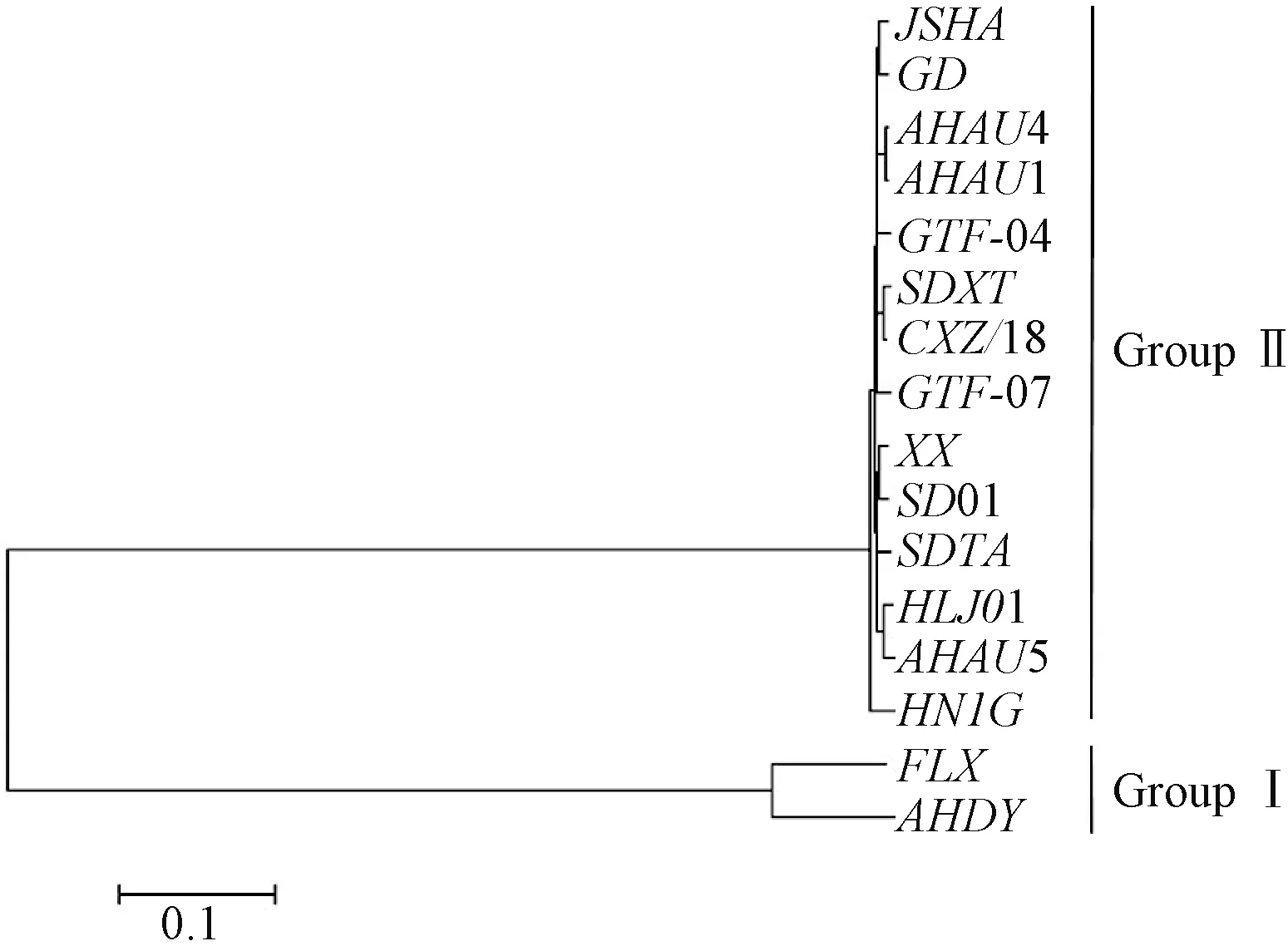
图1 鹅星状病毒RbRp核酸序列进化树
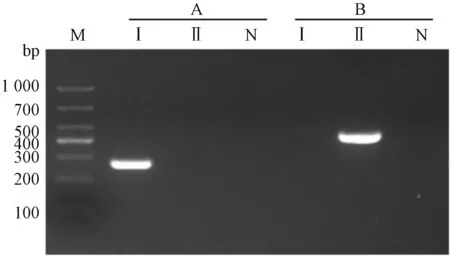
M—DL1000;Ⅰ—基因Ⅰ型;Ⅱ—基因Ⅱ型;N—阴性对照;A—Ⅰ型核酸样本;B—Ⅱ型核酸样本。
2.2 双重RT-PCR检测方法的优化
通过设置不同退火温度及引物混合浓度等参数的比较试验,根据扩增产物在2%琼脂糖凝胶成像结果条带明暗度、清晰度,分析得出退火温度在50~54 ℃皆可,适宜引物浓度GastV Ⅰ和Ⅱ各为1 μmol·L-1(图3~4)。最终扩增程序为50 ℃ 30 min;94 ℃ 3 min,94 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 min,35个循环;72 ℃ 7 min,4 ℃保存。
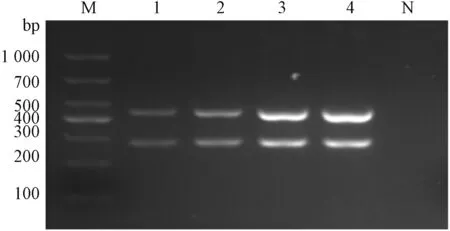
M—DL1000;1—0.25 μmol·L-1;2—0.5 μmol·L-1;3—1 μmol·L-1;4—2 μmol·L-1;N—阴性对照。
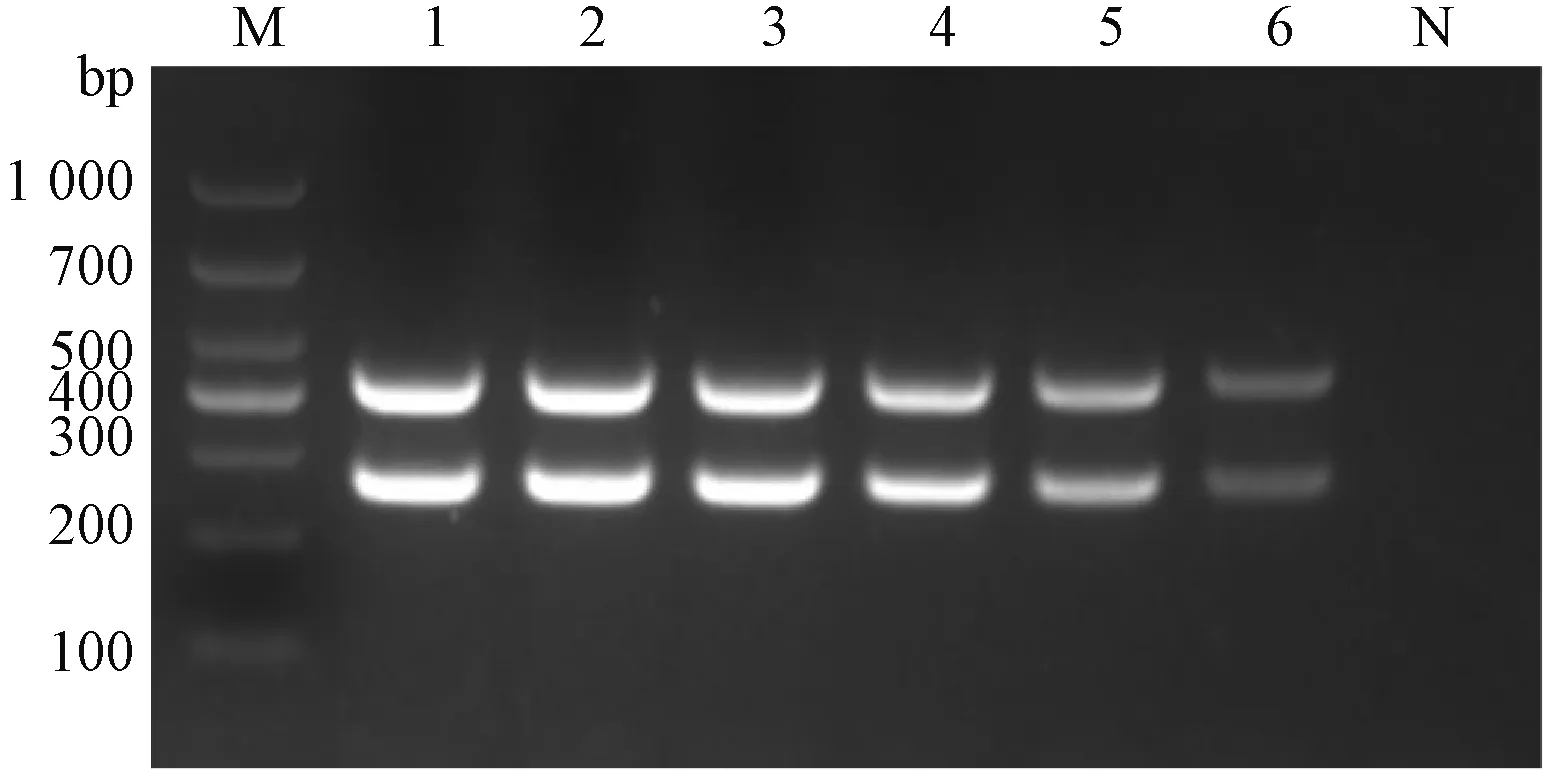
M—DL1000;1—50 ℃;2—52 ℃;3—54 ℃;4—56 ℃;5—58 ℃;6—60 ℃;N—阴性对照。
2.3 PCR方法特异性
采用优化后的双重RT-PCR反应条件,对不同鹅星状病毒、鹅细小病毒、禽流感病毒、坦布苏病毒、鸭瘟病毒、鸭呼肠孤病毒进行检测,结果显示,该引物只能扩增出星状病毒相应的目的条带,条带清晰,其他对鹅常见病毒种类和阴性对照未见扩增产物(图5)。上述结果表明,该双重RT-PCR方法有良好的特异性。

M—DL1000;1—GastV;2—TMUV;3—GPV;4—MDRV;5—DPV;6—AIV;N—阴性对照。
2.4 敏感性
对10倍稀释的阳性核酸样本进行PCR检测,再根据前期公式计算的拷贝数换算,最终结果显示,所建立的双重RT-PCR方法对GAstV Ⅰ型和Ⅱ型的的最低检测模板量分别为103和102拷贝(图6)。

M—DL1000;A—Ⅰ型单一PCR敏感性;B—Ⅱ型单一PCR敏感性;C—双重PCR敏感性;1~9—109~101拷贝·mL-1。
2.5 重复性检测
应用此双重RT-PCR检测方法,间隔一周对同一模板进行反复检测,共重复3次,每次3个重复,并设置阴性对照。结果显示,多次试验结果一致,表明所建立的PCR方法具有较高的稳定性和可重复性。
2.6 临床样本的检测应用
利用上述建立的双重RT-PCR方法对江浙数个养殖场采集到的病样进行检测,结果表明,73份病样中有68份为鹅星状病毒阳性,阳性率93.2%(图7);其中GAstV Ⅰ型和Ⅱ型均阳性的有5份,而GAstV Ⅱ型单独存在的有63份,GastV Ⅰ单独存在的阳性样本则只有一个。该结果与单一PCR检测结果完全相同。
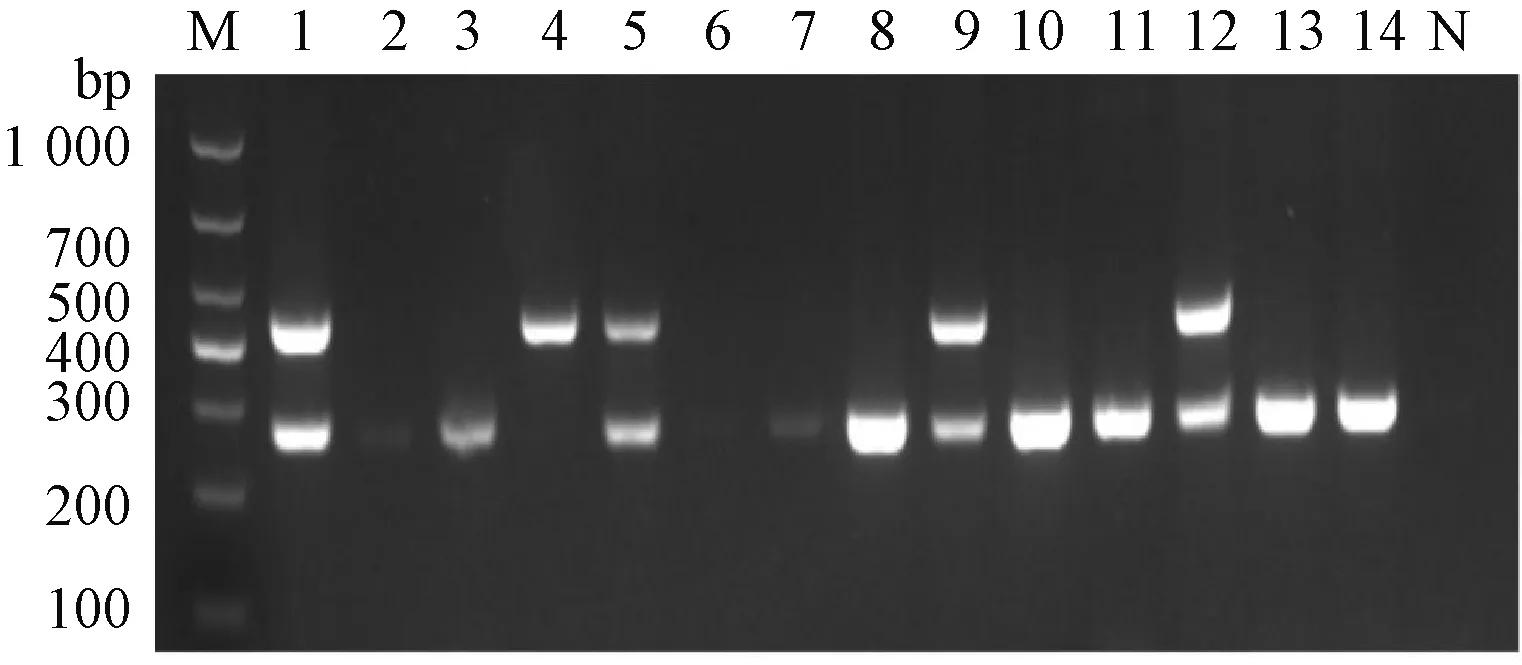
M—DL1000;1~14—临床样品;N—阴性对照。
3 讨论
鹅星状病毒作为新发疫病病原,近年已给各地养鹅业带来巨大经济损失。当前在我国多地区雏鹅群中出现流行,临床暴发痛风;在排除饲料和环境等问题后,明确了雏鹅痛风的主要病因是由鹅星状病毒感染引起[12]。病毒基因组序列同源性分析显示,临床鹅星状病毒主要存在两种不同基因型分离株,且两种病毒核酸序列差异较大,但都属于星状病毒成员,感染宿主主要为20 d龄雏鹅;分别为以FLX株为代表的Group Ⅰ型和以GD株为代表的Group Ⅱ型,而这两种毒株也呈现混合感染现象,至今尚不清楚两种基因型病毒的各自致病机理。传统的病毒分离、电镜观察鉴定、血清学试验等病毒检测方法费时费力,操作难度高,特异性差;准确快速的诊断技术在病原体鉴别诊断上应用价值较大,尤其是对于混合感染。虽然已有研究人员建立了GAstV的PCR检测方法[13],但都是针对单一基因型病毒的检测,存在操作烦琐、不能同时检测到两种基因型病毒的不足。而鹅星状病毒作为新发病原,对其研究甚少,不同毒株及其致病机制尚不清楚,因此,建立快速检测该病毒感染并且可区分基因型的方法,将有利于防控该病。
两种基因型鹅星状病毒基因组均由3个开放阅读框组成,ORF1a、ORF1b和ORF2,分别主要编码丝氨酸蛋白酶、RNA依赖性RNA聚合酶和衣壳蛋白。本研究选取其RNA依赖性聚合酶区域基因序列作为检测靶基因,设计特异性引物,建立的一步法RT-PCR方法,操作简单,可实现以RNA为检测模板,在反应体系中完成RNA反转录并扩增。经对反应体系和条件的摸索优化后,敏感性高,最低可检测出103拷贝的星状病毒;特异性好,条带单一,不会因其他RNA病毒而受到干扰,产物可回收测序。应用所建立的一步法RT-PCR检测方法对临床收集到的73份样本进行测试,发现本次样品中仍以Ⅱ型病毒更为普遍,是优势毒株;Ⅱ型病毒与Ⅰ型共同感染的情况也存在,发现5例,占检测总数6.8%;仅发现一例Ⅰ型病毒单一感染情况,这与已有研究报道的情况相符合[14-17]。结合其他学者的流行病学调查显示,不同地区病毒感染情况存在差异,部分地区主要以混合感染为主,其样品中混合感染可达94.03%[18],值得引起重视。此外,报道显示两种基因型GAstV分离株都有致病能力,可致鹅胚死亡,并有明显病变,因而对GAstV应加以重视。本研究建立的方法快速、灵敏、特异且稳定,操作简单,设备要求低,将为GAstV临床诊断和早期流行病毒调查提供快捷可靠的技术手段。

