二硫代氨基甲酸功能化聚合物吸附酸性废水中的铅离子
郭传恩,赵 珩,刘昌荣,孙君华,杨忠将,崔 玉
(1. 山东政法学院司法鉴定中心,山东济南 250014; 2. 济南大学化学化工学院,山东济南 250022)
随着现代工业的迅速发展,重金属废水排放引起的环境污染问题越来越严重。近年来,环境科学家从材料的选取、改性等方面致力于改进吸附剂的选择性、吸附能力以及吸附量[1],为重金属废水治理提供了详实的数据。从目前开发的材料看,吸附最佳的pH一般在5~6,甚至更高。在我国的重金属废水中,冶炼企业排出的酸性废水比例超过60%[2],pH一般在2~4,甚至酸性更强,因此,构造、设计对重金属离子具有更强配位能力和选择性的吸附剂,实现酸性废水中重金属的深度去除并回收,是环境化学领域亟须解决的科学问题。
汞、铅、镉、铜等重金属对环境的影响比较大,根据软硬酸碱理论,汞离子(Hg2+)、镉离子(Cd2+)、铜离子(Cu2+)、铅离子(Pb2+)均属于软酸,这些离子变形性大,易极化;硫(S)原子与氧(O)、氮(N)原子相比,易变形极化,属于软碱,软酸软碱配位时形成的配位键具有很大的共价成分,比基于O、N原子的配位基作用力强很多[3]。本文中采用热溶剂法制备二硫代氨基甲酸(DTC)功能化二乙烯基苯(DVB)-甲基丙烯酰胺(AMA)聚合物吸附剂,用于去除酸性环境中的Pb2+,研究其组分、含量、结构和溶液环境等因素对去除Pb2+性能的影响。
1 实验
1.1 聚合物的制备
1)二乙烯基苯(DVB)-甲基丙烯酸(MAA)聚合物的制备。称取0.5 g DVB和0.5 g MAA置于烧杯中,加入10 mL乙酸乙酯、0.03 g引发剂偶氮二异丁腈,室温条件下充分搅拌4 h,继而在反应釜中、120 ℃时反应24 h,即得DVB-MAA聚合物,置于60 ℃真空干燥。
2)二乙烯基苯-甲基丙烯酰氯聚合物(DVB-MAC)的制备。取0.5 g DVB-MAA聚合物置于烧瓶中,加入10 mL二氯甲烷,冰水浴条件下逐滴加入2 mL氯化亚砜(SOCl2),再加入1 mL 二甲基甲酰胺(DMF),80 ℃时反应24 h,抽滤,用二氯甲烷洗涤并干燥产物,即得DVB-MAC聚合物。
3)二乙烯基苯-甲基丙烯酰胺(DVB-AMA)的制备。将0.5 g DVB-MAC聚合物溶于10 mL二氯甲烷中,冰水浴条件下缓慢滴加2 mL乙二胺(EDA),反应24 h,得到DVB-AMA聚合物,用二氯甲烷和无水乙醇各洗涤3次。
4)DTC-DVB-AMA聚合物的制备。称取0.5 g DVB-AMA聚合物于20 mL质量分数为10%乙醇钠溶液中,冰水浴条件下逐滴加入2 mL二硫化碳(CS2),40 ℃时反应12 h,依次用无水乙醇、稀盐酸、稀氢氧化钠溶液、无水乙醇洗涤,然后70 ℃真空干燥,即得DTC-DVB-AMA聚合物。
DTC-DVB-AMA聚合物的制备流程如图1所示。
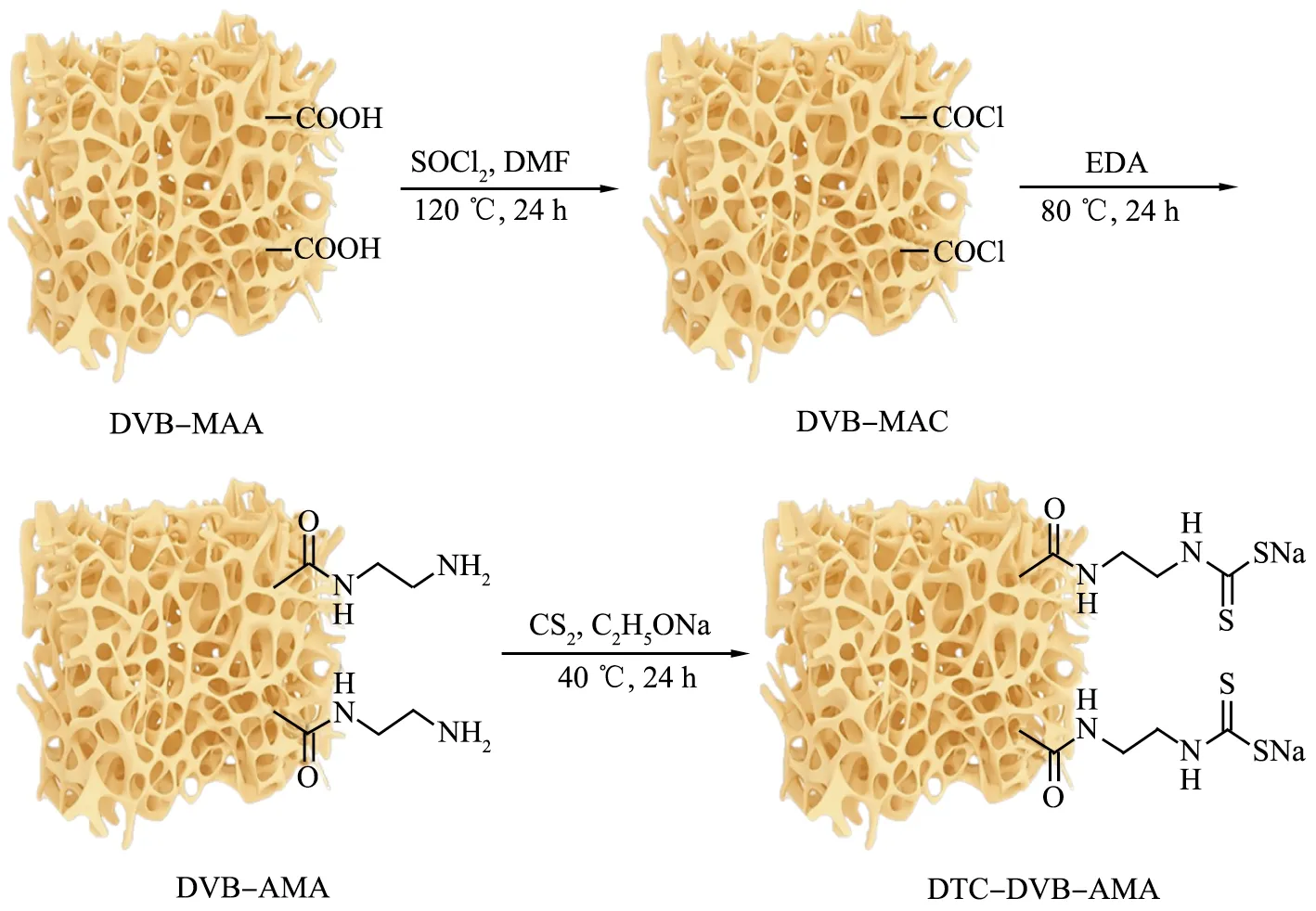
MAA—甲基丙烯酸; DMF—二甲基甲酰胺; MAC—甲基丙烯酰氯; EDA—乙二胺。图1 二硫代氨基甲酸(DTC)功能化二乙烯基苯(DVB)-甲基丙烯酰胺(AMA)聚合物的制备流程
1.2 DTC-DVB-AME聚合物的表征
采用傅里叶红外光谱仪(FTS-165型,美国Bio-Rad公司)、扫描电子显微镜(SEM,Fei Quanta Feg 250型,美国蔡司公司)、X射线光电子能谱仪(Escalab 250Xi型,美国Thermo Fisher Scientific公司)、原子力显微镜(AFM,Dimension Icon型,美国Bruker科技有限公司)对DTC-DVB-AMA聚合物结构进行表征。
1.3 性能测试
加入适量DTC-DVB-AMA聚合物吸附剂与5 mL Pb2+溶液于振荡管中,通过硝酸溶液调节金属离子溶液的pH,在恒温水浴振荡箱中振荡至吸附平衡,过滤吸附剂,用火焰原子吸收光谱仪(PinAAcle 900T型,美国珀金埃尔默公司)测定水相中剩余Pb2+的含量,吸附剂的吸附率和吸附量计算公式分别[4]为
(1)
(2)
式中:R为水中Pb2+的去除率,%;Qe为吸附剂的平衡吸附量,mg/g;ρ0为Pb2+的初始质量浓度,mg/L;ρe为Pb2+的平衡质量浓度,mg/L;V为Pb2+溶液体积,mL;m为吸附剂质量,g。
2 结果与讨论
2.1 DTC-DVB-AMA聚合物的结构表征
2.1.1 红外光谱

2.1.2 SEM图像与X射线能谱(EDS)
DVB-AMA聚合物和DTC-DVB-AMA聚合物的SEM图像、EDS图见图2。由图中可以看出,利用DTC改性前、后吸附剂均为团聚的聚合物微球,微球粒径为30~50 nm,微观结构比较疏松,说明改性对结构形态影响不大。通过N2吸附-脱附等温线实验计算DTC-DVB-AMA聚合物的比表面积为230.2 m2/g,较大的比表面积可以容纳更多的活性位点,增大吸附剂的吸附量,从而结合更多的Pb2+。对比吸附剂改性前、后EDS图,改性前只有C、N、O元素的峰,而改性后出现了S元素的峰,同样说明了二硫代氨基甲酸基团的存在。
2.1.3 AFM图像
DVB-AMA聚合物和DTC-DVB-AMA聚合物的AFM图像如图3所示。由图中可以看出,吸附剂在改性后表面起伏更大,改性前、后的吸附剂表面粗糙度从4.32 nm提高至5.34 nm,粗糙程度增加,因此提供了更多的活性位点(羧基、氨基和巯基等),提高了吸附剂对Pb2+的吸附效率。
2.2 Pb2+初始浓度对吸附性能的影响
Pb2+初始浓度对吸附量的影响如图4所示。由图可见,当Pb2+初始质量浓度小于1 036 mg/L时,DTC-DVB-AMA聚合物的吸附量随浓度的增加而呈线性增大,当Pb2+初始质量浓度大于1 036 mg/L后,吸附量随浓度的增加缓慢,在Pb2+初始质量浓度大于1 450.4 mg/L后达到饱和吸附。
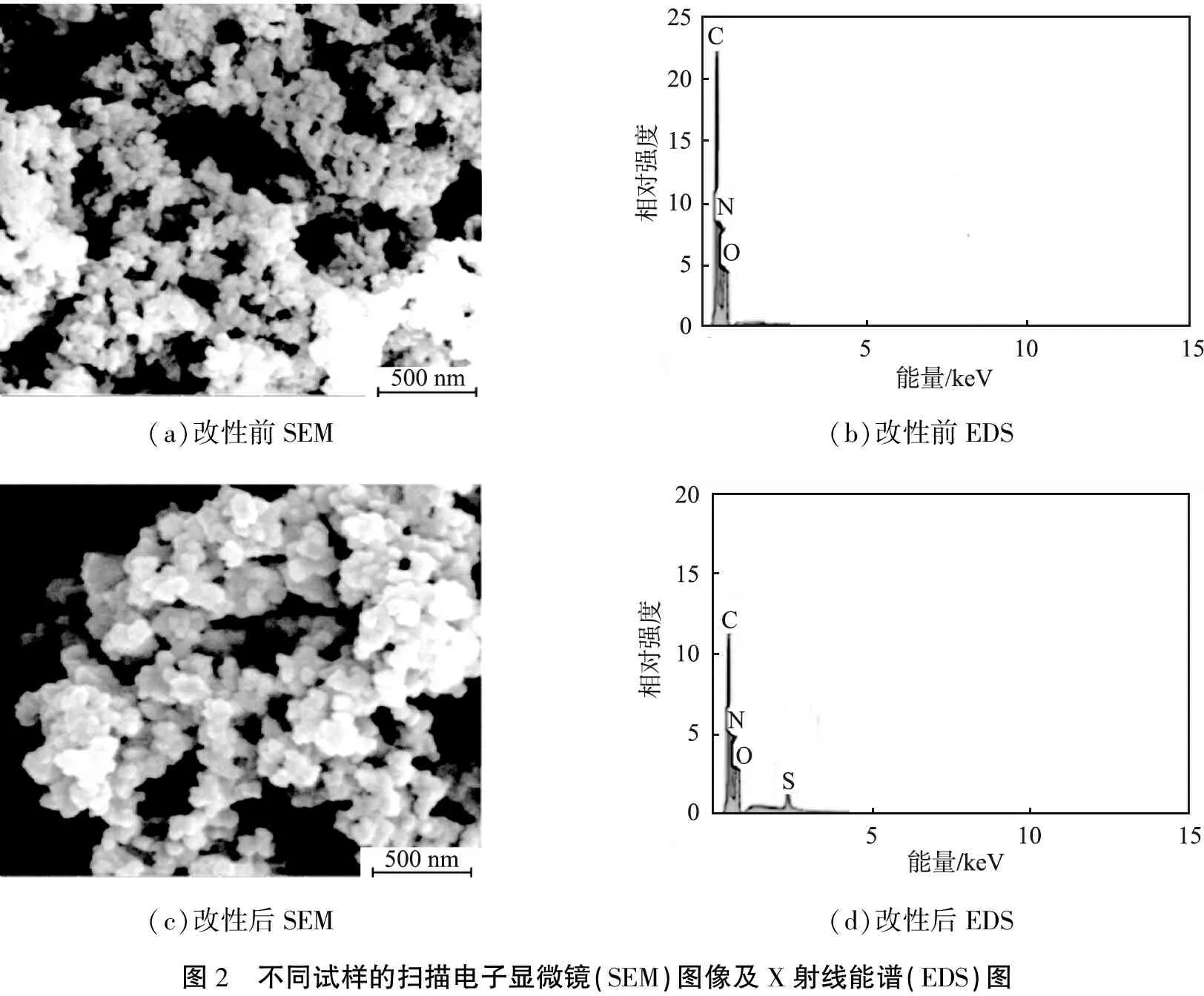
(a)改性前SEM(b)改性前EDS(c)改性后SEM(d)改性后EDS图2 不同试样的扫描电子显微镜(SEM)图像及X射线能谱(EDS)图
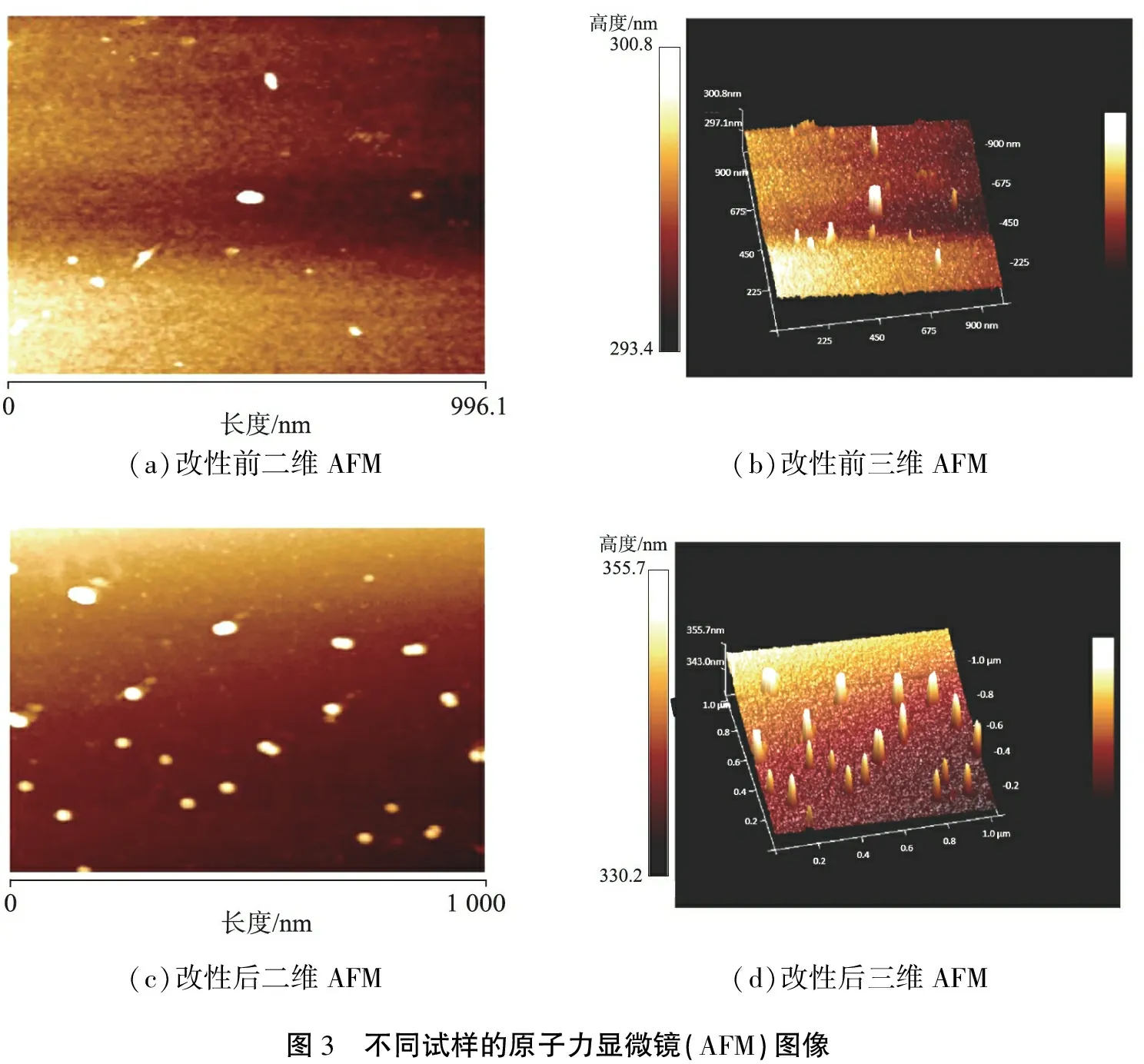
(a)改性前二维AFM(b)改性前三维AFM(c)改性后二维AFM(d)改性后三维AFM图3 不同试样的原子力显微镜(AFM)图像
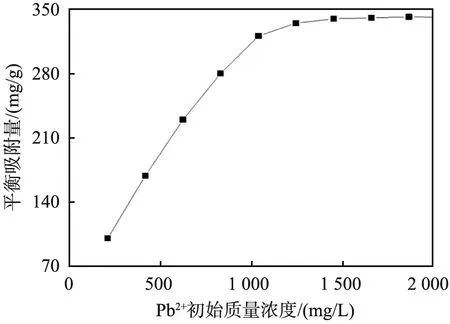
图4 铅离子(Pb2+)初始浓度对吸附量的影响
2.3 溶液pH对吸附性能的影响
溶液pH对Pb2+去除率的影响如图5所示。从图中可以看出,当溶液pH<3时,DTC-DVB-AMA吸附剂对Pb2+的去除率随pH的增大迅速增大,当pH=3时,去除率达到最大值,原因可能是在pH较小时,大量的H+使得吸附剂表面基团质子化,质子化基团与Pb2+的静电排斥,阻碍了吸附剂对Pb2+的吸附。随着pH增大,吸附剂表面基团逐渐去质子化,静电作用力减小,有利于吸附剂对Pb2+的吸附[6-7]。此外,在强酸(pH<3)条件下,二硫代氨基甲酸酯容易分解为胺和二硫化碳,减弱了吸附剂对Pb2+的吸附能力[5]。
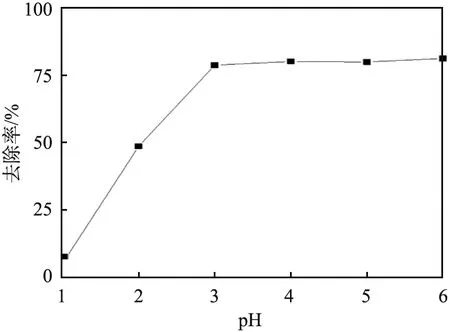
图5 溶液pH对铅离子(Pb2+)去除率的影响
2.4 吸附动力学
吸附时间对Pb2+去除率的影响如图6所示。由图可以看出,平衡吸附时间为15 min,表明吸附达到吸附平衡的用时较短,这与DTC-DVB-AMA吸附剂具有较大的比表面积,提供了较多的吸附位点有关。
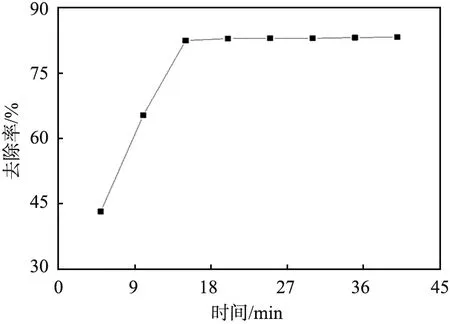
图6 吸附时间对铅离子(Pb2+)去除率的影响
为了进一步研究DTC-DVB-AMA吸附剂吸附机理和吸附过程潜在的速率控制步骤,用拟一级动力学模型和拟二级动力学模型对实验数据进行拟合。该吸附剂对Pb2+的吸附过程更符合拟二级动力学模型(相关系数的平方R2=0.994),说明化学吸附是速率控制步骤[8]。
2.5 吸附等温线
DTC-DVB-AME吸附剂的吸附量随Pb2+平衡浓度的增加而增大,原因是溶液中Pb2+浓度的增大增强了溶液向吸附剂表面传质的驱动力,使得平衡向右移动,吸附剂的吸附量增大。当Pb2+平衡质量浓度达到600 mg/L时,吸附剂的吸附量不再增加,说明此时已经达到饱和吸附,最终测得吸附剂最大平衡吸附量为342.3 mg/g,见表1。与已经报道的Pb2+吸附剂[6,7,9-12]相比较(见表1),DTC-DVB-AMA聚合物具有更加优异的吸附性能。
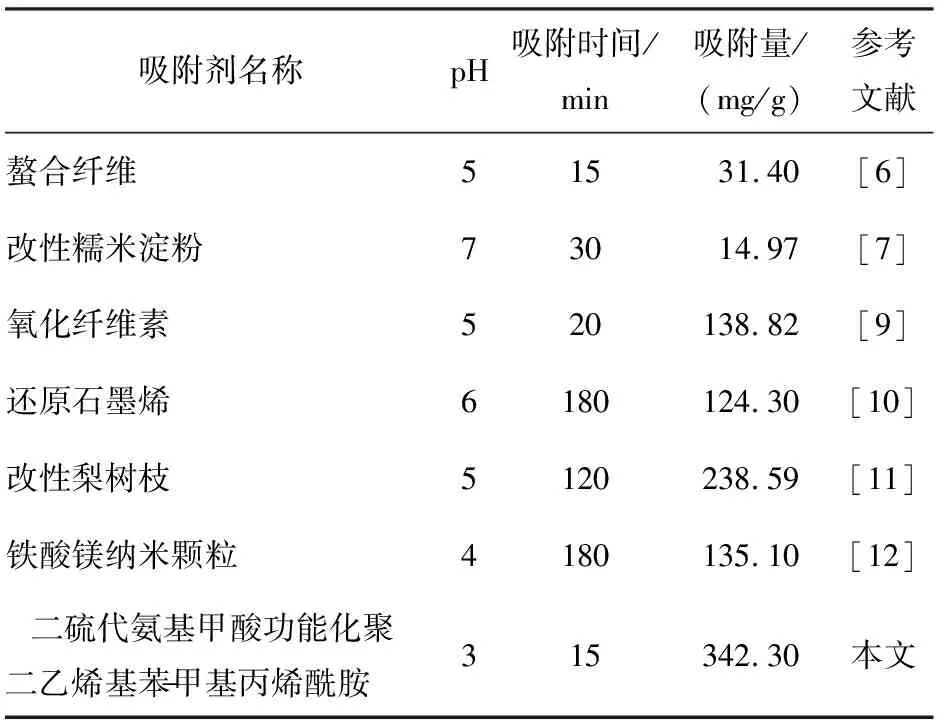
表1 各种吸附剂对铅离子(Pb2+)吸附能力的比较
为了进一步研究DTC-DVB-AMA吸附剂与Pb2+之间的作用机理,将测得的数据分别通过Langmiur、Fruendlich以及Temkin吸附等温方程进行拟合[13],结果显示,该吸附剂吸附Pb2+过程更加符合Langmiur吸附等温线(R2=0.999),因此Pb2+的吸附为吸附剂表面的单分子层吸附。根据等温线模型计算得出理论的吸附量为358.4 mg/g,实际测得饱和吸附量为342.3 mg/g,与理论值接近。
2.6 再生性能
对DTC-DVB-AMA吸附剂进行了10次吸附-脱附循环实验,结果如图7所示。由图可以看出,重复利用10次以后,吸附剂的性能逐渐稳定,吸附率仍保持在85%以上,表明该吸附剂具有优秀的再生性能。
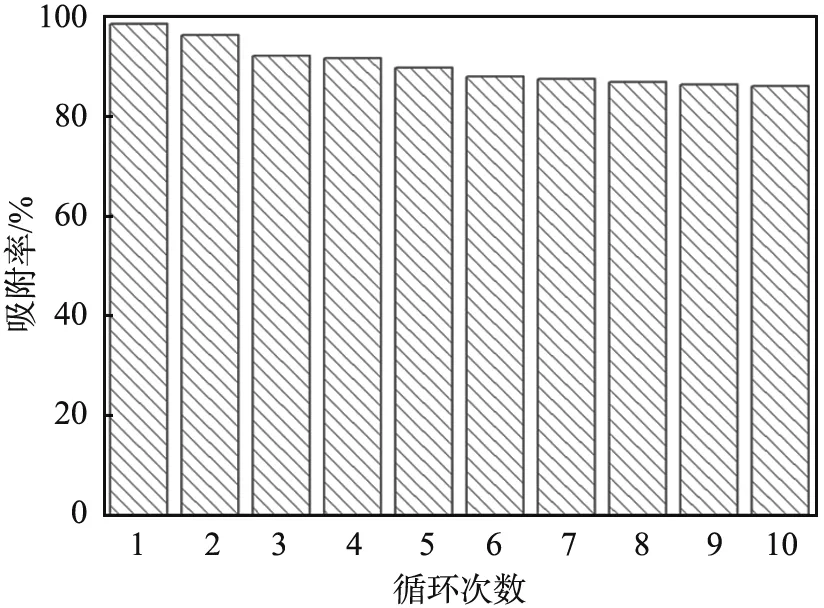
图7 二硫代氨基甲酸功能化聚二乙烯基苯-甲基丙烯酰胺 (DTC-DVB-AMA)的重复使用效果
2.7 对不同金属离子的吸附能力
DTC-DVB-AMA吸附剂对不同金属离子的吸附能力如图8所示。从图中可以看出,DTC-DVB-AMA吸附剂对Pb2+、Cu2+、Cd2+、Zn2+表现出了良好的吸附效果,对Co2+、Ni2+、Na+、Mg2+、K+几乎不吸附。根据软硬酸碱(HSAB)理论,含硫的官能团属于软碱,而Pb2+、Cu2+、Cd2+均属于软酸,因此二硫代氨基甲酸基团表现出较强的吸附的能力;而Co2+、Ni2+、Zn2+离子属于交界酸,Na+、Mg2+、K+属于软碱,该吸附剂对它们的吸附效果较差,表明二硫代氨基甲酸基团具有良好的吸附选择性。
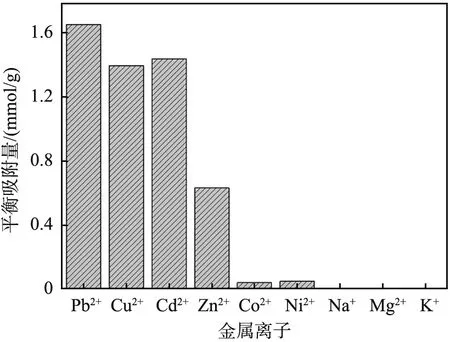
图8 二硫代氨基甲酸功能化聚二乙烯基苯-甲基丙烯酰胺 (DTC-DVB-AMA)对不同金属离子的吸附量
2.8 吸附机理

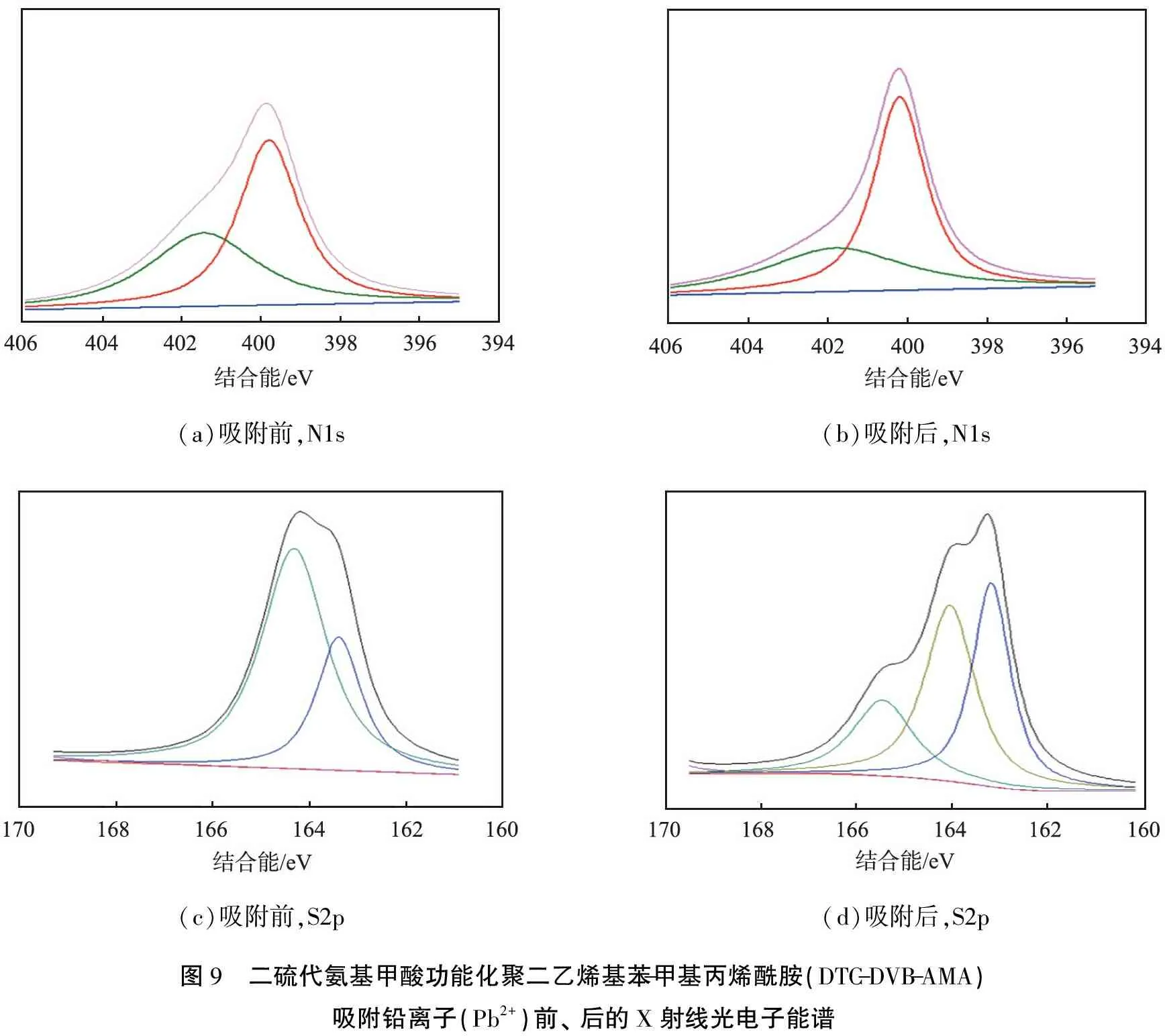
(a)吸附前,N1s(b)吸附后,N1s(c)吸附前,S2p(d)吸附后,S2p图9 二硫代氨基甲酸功能化聚二乙烯基苯-甲基丙烯酰胺(DTC-DVB-AMA)吸附铅离子(Pb2+)前、 后的X射线光电子能谱
3 结论
本文中采用溶剂热法合成了二硫代氨基甲酸功能化的高分子聚合物聚二乙烯基苯-甲基丙烯酰胺(DTC-DVB-AMA)吸附剂,比表面积达到230.2 m2/g,在pH=3的溶液中对Pb2+具有良好的吸附性能,表明其在处理酸性矿山废水中具有实际应用价值。该吸附剂对Pb2+的吸附平衡时间为15 min,最大吸附量为342.3 mg/g,吸附等温线符合Langmiur模型,属于表面单分子层吸附。吸附动力学符合拟二级动力学模型,说明化学吸附是该吸附剂的速率控制步骤。经过10次吸附-脱附实验,吸附剂仍保持85%以上的吸附率,再生性能良好。本研究为构建用于去除酸性废水Pb2+的新型吸附剂提供了新思路。

