基于溶血估算的膜式氧合器内部流场分析与结构优化
张智鑫, 李冬梅, 张 瑞*
(1.郑州大学机械与动力工程学院, 郑州 450066; 2.广东顺德创新设计研究院, 佛山 528318)
体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)又称体外生命支持,是以体外循环系统为基本设备,采用体外循环技术进行操作和管理的一种辅助治疗手段,通过完全或部分替代肺或心功能,使心肺得到充分休息,近年来开始应用于常规生命支持无效的各种急性循环和(或)呼吸衰竭的危重患者[1]。作为一种高级生命支持方法,ECMO 是重症加强护理病房(intensive care unit,ICU)中生命支撑的终极手段、重症患者的“最后救命稻草”,是一个医院、一个地区救治重症病患能力的最高水平;尤其在新冠肺炎疫情中,ECMO在救治重症患者中起到关键作用,成为患者的“最后一道防线”[2]。
膜式氧合器又称膜式人工肺,是ECMO设备的两大核心部件之一,其主要功能就是将流入氧合器中的静脉血氧合为动脉血并清除血液中的二氧化碳;通常用于心肺外科手术或者体外循环中,用以辅助或者短暂代替天然肺功能[3]。由于大多核心技术被国外企业垄断,目前中国关于膜式氧合器的研究尚不成熟,近年来随着膜式氧合器在临床中的大量使用,发现膜式氧合器在临床应用中普遍存在溶血和血栓形成现象[4]。为了研究和解决这些问题,叶菲华等[5]基于多孔介质模型对膜式氧合器的内部流场进行了研究分析,并从材料方面改善了膜式氧合器的血液相容性,但血液流过膜式氧合器时,其内部的结构和流体运动特性同样会对血细胞损伤产生影响[6]。
现选用一款国产某型号一次性成人用膜式氧合器作为研究对象,以多孔介质模型和快速溶血模型相结合,对膜式氧合器内部流场的流动特性和溶血特性研究分析,并在此基础上对膜式氧合器的结构进行优化设计,旨在解决血液流过膜式氧合器的血液损伤问题,以提高膜式氧合器的溶血性能、延长膜式氧合器的使用寿命、减轻心肺患者的经济负担,为新型长效膜式氧合器的开发提供理论支撑。
1 膜式氧合器数值模型建立
1.1 膜式氧合器的工作原理
该型号的膜式氧合器工作原理图如图1所示,其主要由氧合腔室,变温腔室以及氧气、温水和血液的进出口管道、排气孔等组成。在氧合室和变温室内都有相应的中空纤维束填充,并且变温室置于氧合室的下方;血液首先从血液入口流入变温室,在变温室中与从上往下流的温水在中空纤维膜表面进行热交换,然后再经过中间管道从上往下流过氧合室,在腔内中空纤维膜表面与纤维膜内从上往下的氧气进行气交换,然后流出膜式氧合器。其中氧合室的功能是将静脉血氧合成动脉血,并排出血液中的二氧化碳;变温室的功能是调节血液的温度,使之与血液在人体中的温度相近。中空纤维膜避免了水、血液和氧气的直接接触,从而降低了血栓形成的可能性。
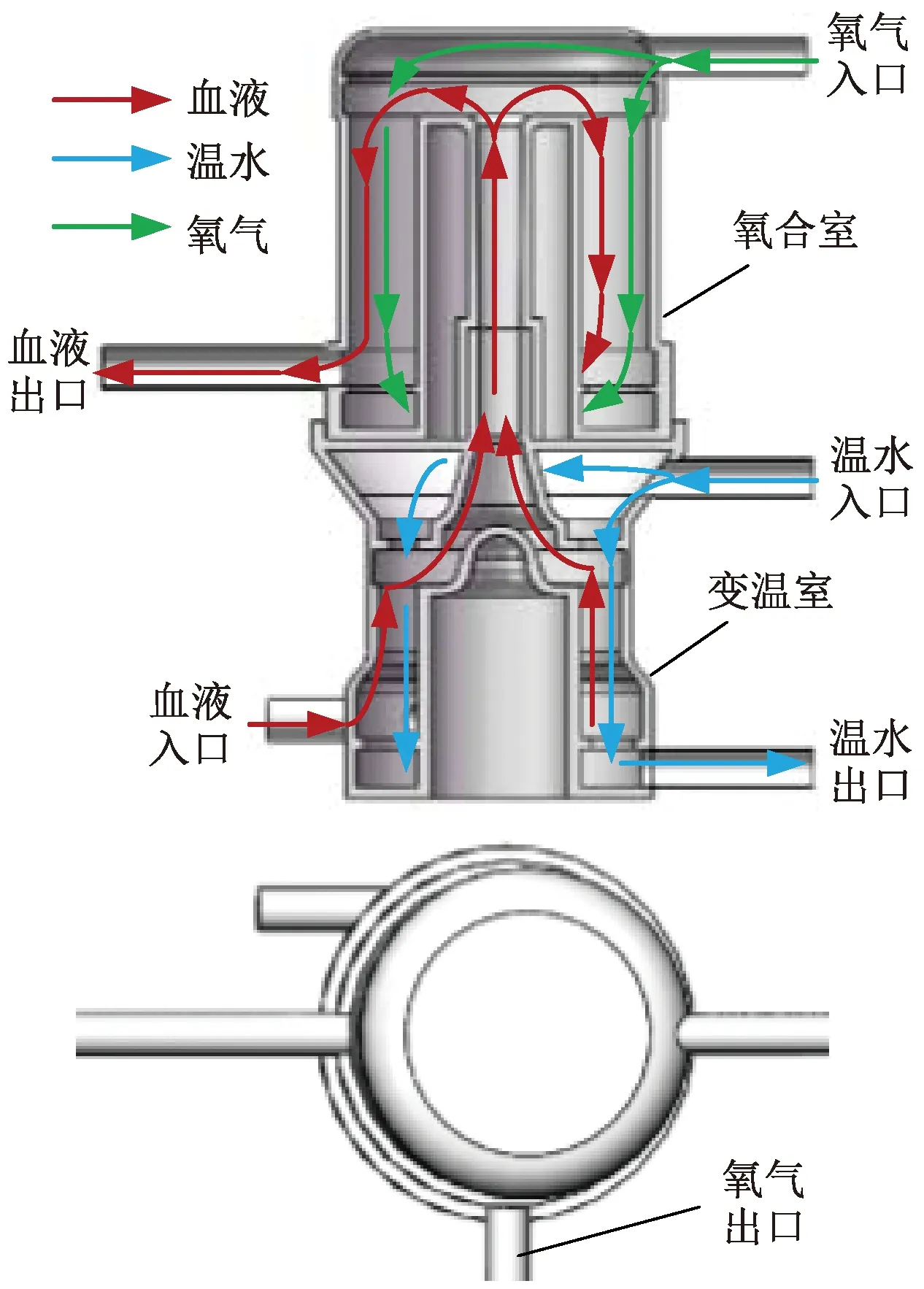
图1 膜式氧合器工作原理图Fig.1 Working principle diagram of membrane oxygenator
1.2 多孔介质模型
采用方程和连续性方程描述笛卡尔坐标系中不可压缩黏性流体的稳态运动,通过将动量吸收项S添加标准流体流量方程式中来预测压力损失,公式为

(1)

(2)
式中:ρ为密度;ui为xi方向的流速;uj为xj方向的流速;xi、xj为流体流动的方向(其中i、j可取x、y和z轴的任一方向);P为压力;τij为应力张量;gi为重力加速度;S为源项。

(3)
式(3)中:μ为流体动力黏度;α为多孔介质渗透率;c2为多孔介质惯性阻力系数;|u|为速度。
源项由两部分组成:等式的第一项代表黏性损失,第二项代表惯性损失。在流量Q<6.00 L/min时,惯性损失可以忽略不计[7]。因此,多孔模型的特性仅取决于从达西定律获得的黏性阻力。
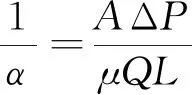
(4)
式(4)中:1/α为黏性阻力系数;A为通过纤维束的横截面面积;ΔP为流体通过纤维束的压力差;Q为流量;L为中空纤维束的长度。
1.3 剪切应力计算模型
在湍流状态下,血液中的剪切应力包括流体黏性引起的分子切应力和湍流引起的雷诺应力张量。

(5)

(6)
由式(5)和式(6)可得

(7)
式(7)中:μτ为湍流黏度;k为湍流动能;δij为Kronecker数。利用米泽斯屈服准则[8](mises yield criterion)简化剪切应力张量形式为

(8)
1.4 溶血预估模型
文献[9-10]基于双曲输运方程开发了一种三维快速溶血数值模拟的方法预测溶血。双曲输运方程为

(9)
式(9)中:V为速度矢量;Dl为线性溶血指数;σ为源项;另外由于Giersiepen等[11]得到的经验常数存在被高估现象。因此选用Taskin等[12]、Heuser等[13]由实验得出的经验常值C=1.8×10-8,α=1.991,β=0.765,用于研究膜式氧合器的标准溶血参数值,即
Dl=D1/0.765=σΔT
(10)
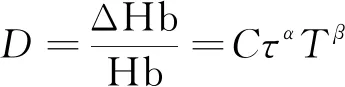
(11)
式中:D为溶血值,衡量溶血量;ΔHb为红细胞被损伤后溢入血液中的血红蛋白浓度;Hb为总血红蛋白浓度(Hb=140 g/L);τ为剪切应力;T为暴露时间。从而源项σ定义为
σ=(1.8×10-8)1/0.765τ1.991/0.765
(12)
待流场稳定后,流场整体平均溶血特性计算公式为

(13)

(14)
标准溶血参数值(normalized index of hemolysis,NIH)计算公式为
NIH=HbD(T,τ)×100
(15)
1.5 实验方案设计
实验的主要目的是从实验室中分别测得不同入口流量下氧合室和变温室中的压降,以计算氧合室和变温室的黏性阻力,并将黏性阻力数值代入模拟计算,最后将模拟计算的压强结果与实验测量的数据进行对比,以验证模拟计算的准确性和可行性,实验装置平台如图2所示。
实验采用一款市售的某型号一次性成人用膜式氧合器,以猪血为流体介质,通过便携式ECMO控制台来控制膜式氧合器的入口流量,使入口流量范围为2.0~6.0 L/min,与一般成人血液流量范围一致。实验时首先由离心血泵将贮血箱中的静脉血由血液入口泵入氧合器的变温室中,然后由变温室变温将血液温度保持在37 ℃,再将变温后的血液泵入氧合室中进行氧合并排出二氧化碳,最后再将氧合后的血液由血液出口泵回贮血箱;为了分别测得氧合室和变温室的压降,需对设备进行改进,在氧合室和变温室的上部分别创建2个检修孔,并与压力传感器相连接(其中流量传感器为 SONOFLOW CO.56,压力传感器为NORa有创压力传感器),使得每部分两个检修孔之间呈90°分布。
用Origin对测得的数据进行线性拟合,氧合室、变温室压降与入口流量的拟合曲线如图3所示,其中氧合室中ΔP=2 997.15Q,R2=0.993,变温室中ΔP=1 465.57Q,R2=0.998;将其分别代入式(4)中可以得到氧合室和变温室两个腔室中的中空纤维束的黏性阻力,且分别为1.35×109m-2和3.59×108m-2。

图2 实验装置平台图Fig.2 Platform diagram of experimental devices

图3 氧合室和变温室压降-流量拟合曲线Fig.3 Pressure drop-flow fitting curve of oxygenation chamber and variable greenhouse
2 仿真计算与分析
2.1 边界条件设置
如图4所示,将整个计算模型划分为两个多孔介质域和一个流体域,同时为了在研究中让流动充分发展以及避免回流,加长了出口管道长度。由于膜式氧合器内部结构复杂,对其采用非结构化网格划分。
为了对模拟计算的准确性以及网格无关性验证,以3种不同网格数(192万、295万、442万),采用速度入口(入口流量为2.0~6.0 L/min,该范围与成人正常血流量范围一致),流体介质为猪血(密度为1 052 kg/m3,黏度为2.36 cP,并设置为不可压缩的牛顿流体),出口指定为0 Pa压力出口,进行模拟计算,并将在不同流量下计算出的压强差与实验数据进行对比;如图5所示,3种不同网格数在不同流量下的模拟计算结果并无明显变化,并且与实验结果相比误差很小,这验证了网格的无关性与模拟计算的准确性;为了提升模拟计算效率,选用192万网格进行流场模拟计算。
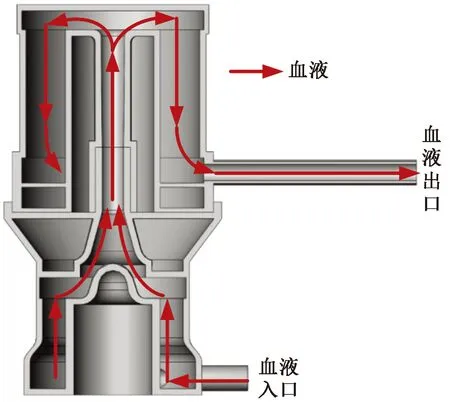
图4 模型简化图Fig.4 Simplified model of the model
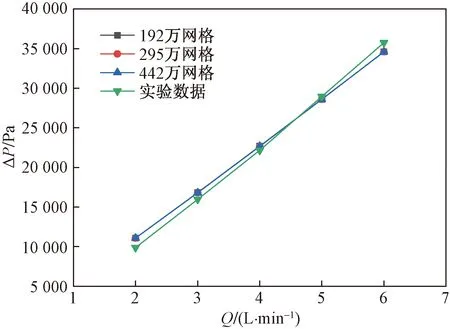
图5 网格无关性验证Fig.5 Grid independence verification
2.2 仿真结果与分析
为了探究膜式氧合器内部流体运动特性对溶血特性的影响,并确定血液损伤多发的区域,对膜式氧合器内部流场速度分布、压力分布、湍流强度分布等云图进行研究分析,以下分析均以入口流量为4.5 L/min为例。
由图6显示了膜式氧合器整体速度的分布状况,其中A、B、C三截面分别为氧合器入口管道、出口管道以及中间管道的中间截面;由图可知最大流速主要分布于进口、出口以及中间管道处,氧合室和变温室中的流速较小且均匀;在管道与变温室、氧合室的交界处存在湍流区,且随着入口流量的增加湍流区域逐渐增大。
图7显示了膜式氧合器的压力分布状况,出入口的总压降为25 704.4 Pa,氧合室中的压力损失约占69.8%,热交换室中的压力损失约占21.5%,压力损失大多位于中空纤维束中,并且呈倾斜状分布;在出口管道与氧合室的交界处存在负压区,且负压区与湍流区一致。

图6 速度云图Fig.6 Speed cloud chart

图7 氧合器压降分布图Fig.7 Pressure drop distribution diagram of oxygenator
图8展示了膜式氧合器中间截面湍流强度和标量剪切应力的分布状况,由图8(a)可知,流场稳定后中间截面的最大湍流强度为42.96%,且位于中间管道与氧合室的交界处;出、入口管道中的湍流强度次之,氧合器室与变温室这两个多孔介质域中湍流强度较小;由图8(b)可知,中间截面的标量剪切应力分布状况,其中99%的区域的标量剪切应力低于19.43 Pa,最高标量剪切应力为194.25 Pa,位于中间管道与氧合室的交界处,与最大湍流强度位置一致;标量剪切应力、湍流强度较大的区域血液损伤多发[14-15]。
2.3 血液损伤分析
图9显示了膜式氧合器在入口流量范围为2.0~6.0 L/min时,不同流量下的NIH范围为0.002 85~0.012 9 g/100 L(小于人体生理允许的最大标准溶血参数值0.1 g/100 L),满足使用要求;并由FLUENT中的用户自定义函数(user-defined functions,UDF)计算得出99%的标准溶血参数值位于流道中,也即血液损伤多发于除氧合室和变温室以外的流道中;结合前边对膜式氧合器内部流场中速度分布、压差分布、中间截面湍流强度和标量剪切应力分布等评价指标分析,可以确定血液损伤多发于流道中,其中在出、入口管道以及中间管道与变温室、氧合室交界处最为严重;并且与湍流区、负压区一致。
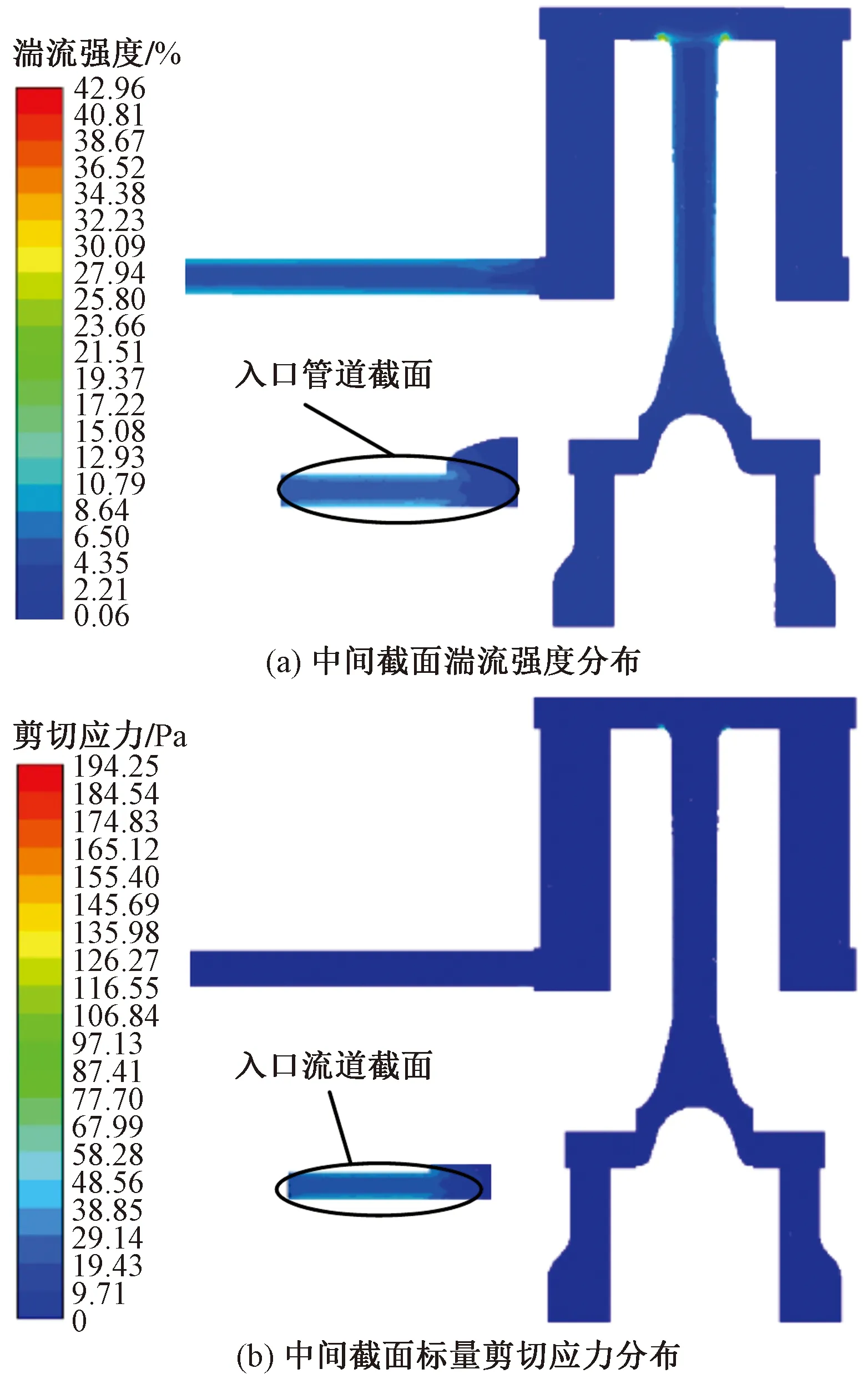
图8 中间截面湍流强度与标量剪切应力分布图Fig.8 Distribution diagram of turbulence intensity and scalar shear stress in the middle section

图9 不同流量下的标准溶血值Fig.9 Standard hemolysis values under different flow rates
3 结构优化及结果分析
3.1 利用正交试验进行结构优化
针对于上述分析可知血液损伤主要发生在除氧合室和变温室以外的流道中,为了减小血液流经氧合器的血液损伤,在保证变温和血液氧合效果的情况下对该膜式氧合器流道中的结构进行优化设计;利用控制变量法进行大量的仿真计算,最后选用了3个影响溶血性能的主要结构参数Φ1、Φ2、Φ3,如图10所示。
在入口流量为4.5 L/min时,3个单因子对标准溶血参数值的影响规律如图11所示。由图11可知,在只考虑Φ1的变化对NIH的影响时,当Φ1为1°时为最优值,此时NIH值最小;相应的只考虑Φ2的变化对NIH的影响时,Φ2为6°时为最优,此时NIH最小;同理Φ3为1°时为最优,此时NIH最小。由以上可选择单因子最优值的前后两个结构参数值,作为结构参数Φ1、Φ2、Φ3的取值范围,并在取值范围内选取3个水平进行正交试验分析[16],如表1所示,试验设计及结果如表2所示。

图10 氧合器结构尺寸Fig.10 Structure and size of oxygenator

表1 正交试验与水平表
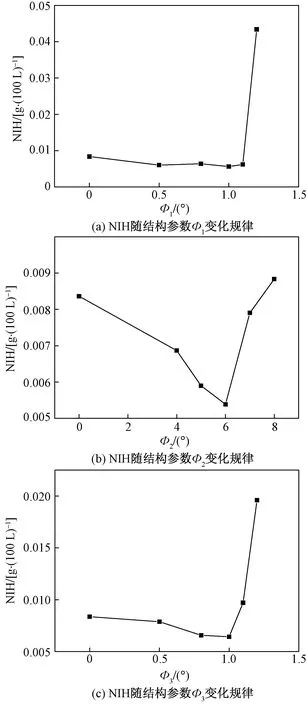
图11 NIH随结构参数变化规律示意图Fig.11 Schematic diagram of NIH changes with structural parameters
3.2 结果分析
根据表3由极差分析法可以确定最优组合为A1B3C3,即:当Φ1为0.8°,Φ2为8°,Φ3为1.2°时为最优方案;并且由极差得出影响溶血性能因素的主次顺序依次为:Φ1>Φ3>Φ2;根据最优方案建立膜式氧合器的三维模型进行计算分析,所得的数据与优化前对比如表4所示,由表4可知,优化后流场中的最大流速由1.31 m/s降为1.18 m/s、进出口总压降由25 704.4 Pa降为19 513.7 Pa、最大湍流强度由42.96%降为33.11%、最大壁面剪切应力由102.22 Pa降为55.66 Pa、最大中间截面标准剪切应力由194.25 Pa降为133.86 Pa;也即最大流速降低了9.9%,进出口总压降减少了24.1%,最大湍流强度降低了22.9%,最大壁面剪切应力减少了45.5%,中间截面的最大标量剪切力减少了31.1%,出、入口以及中间管道中的血液损伤得到了明显改善。
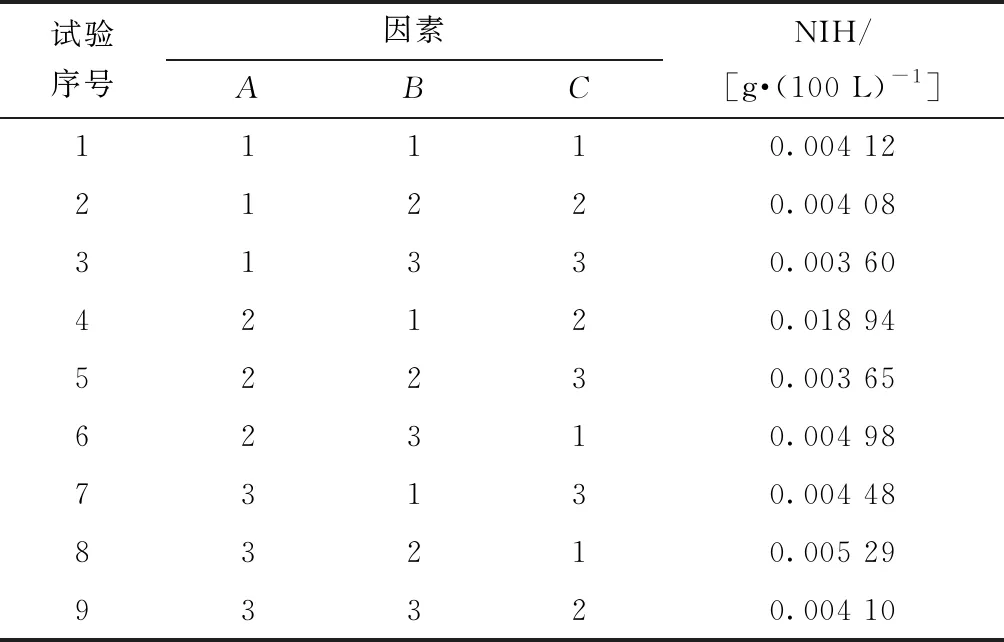
表2 正交试验设计及计算结果

表3 均值及极差分析
图12为优化前后在不同流量下标准溶血值的对比图,由图12可知,优化前NIH范围为0.002 85~0.012 9 g/100 L,优化后NIH范围为0.002 44~0.004 46 g/100 L(远小于人体生理许用值0.1 g/100 L),优化后的标准溶血参数值明显降低,溶血性能得到了明显提高。该优化设计方法为新型长效膜式氧合器的开发与应用提供了理论指导。

表4 优化前后流场中量化指标数据表

图12 不同流量下优化前后NIH对比图Fig.12 NIH comparison chart before and after optimization at different flow rates
4 结论
以多孔介质模型和快速溶血模型相结合,对膜式氧合器的内部流场、溶血特性进行研究分析,并基于溶血估算利用正交试验对膜式氧合器流道中的结构参数进行优化设计。得到以下结论。
(1)在该膜式氧合器中,血液损伤大部分位于除氧合室和变温室以外的流道中,其中入口、出口管道与氧合室、变温室交界处最为严重。
(2)由正交实验得到影响标准溶血参数(NIH)的主次顺序依次为:Φ1>Φ3>Φ2,并且得到三结构因子的最优组合为Φ1为0.8°、Φ2为8°、Φ3为1.2°。
(3)优化后的NIH值范围为:0.002 44~0.004 46 g/100 L(远小于人体生理许用值0.1 g/100 L),相对于优化前溶血性能得到了明显提高,该优化很大程度地降低了血液损伤,为新型长效膜式氧合器的开发与应用提供了理论支撑。

