基于基因编辑技术的DMD人诱导多能干细胞模型构建
王 伟, 林 翔, 陈万金, 王 柠, 金 铭
杜氏进行性肌营养不良(Duchenne muscular dystrophy,DMD)是一种致死性的X连锁隐性遗传病,是儿童最常见的遗传性神经肌肉疾病,发病率为(10.71~27.78)/105[1]。致病原因为X染色体上的dystrophin基因发生突变,导致编码的细胞骨架蛋白Dystrophin的功能缺失以及持续性的肌纤维退行性变,造成肌纤维的强度和稳定性下降,出现进行性肌肉萎缩。患者常在13岁前失去独立行走能力,20~30岁时因心肺功能衰竭而死亡,目前尚无成熟有效的治疗手段[2]。
在DMD的治疗研究中,除了大规模的药物临床试验,主要使用各类研究模型,常见的有小鼠、犬、猪和猴,以及人诱导多能干细胞(human induced pluripotent stem cells,hiPSCs)等[3-6],其中作为遗传特性与人体最为接近的hiPSCs,由于可以定向分化为肌肉组织,是目前研究肌肉疾病最重要的体外模型,在基因编辑治疗、长链非编码RNA治疗和小分子药物筛选方面都发挥了重要作用[7-9]。hiPSCs由已终末分化的细胞通过重编程的方式,重新获得与胚胎干细胞相同的多向分化与自我更新能力[10]。然而,人体来源的hiPSCs依赖于患者组织的获取,如皮肤、血液、尿液等,获取渠道有限,对于一些特殊类型获取难度较大。本研究拟通过CRISPR-Cas9技术,在正常hiPSCs中切除dystrophin基因的52号外显子,从而引入大片段缺失突变,构建DMD细胞模型,为后续治疗研究提供实验基础。
1 材料与方法
1.1 材料 (1)细胞:293T细胞由中国科学院干细胞库提供;正常的hiPSCs为本团队前期研究中通过重编程方式获得[11]。(2)试剂:SpCas9表达载体构建自张锋实验室的PX-330(42230,美国Addgene公司);干细胞培养基Essential 8TMMedium(A1517001,美国Thermo Fisher Scientific公司);PEIpro (PT-115-0015,法国Polyplus Transfection公司);T7E1酶切试剂盒(E3321,美国New England Biolabs公司);Y-27632 (10005583,美国Cayman Chemical公司);Accutase干细胞消化液(07920,加拿大Stemcell公司);干细胞电转试剂盒(VPH-5012,瑞士Lonza公司)。(3)仪器:多功能全自动流式细胞分选仪(MA900,日本Sony公司);核转仪(NucleofectorTM2b Device,瑞士Lonza公司)。
1.2 方法
1.2.1 表达载体构建 以PX-330为骨架构建U6-sg-BpiI-CBA-SpCas9-CMV-EGFP及U6-sg-BpiI-CBA-SpCas9-CMV-mCherry载体,使用BpiI酶切后回收作为质粒骨架。单链引导RNA(single guide RNA,sgRNA)挑选使用高保真Cas9深度学习预测模型(deep learning for high-fidelity Cas9,deepHF)在线工具[12],选择dystrophin基因52号外显子上下游约800 bp剪切效率最高的sgRNA,并使用MIT特异性分值[13]及切割频率测定(cutting frequency determination,CFD)特异性分值[14]计算工具评估其脱靶效率,选用评分在适用范围内的序列作为sgRNA。采用T4连接酶将质粒骨架与sgRNA连接,构建sgRNA1/2-Cas9-EGFP(上游)及sgRNA3/4/5/6-Cas9-mCherry(下游)质粒。
1.2.2 T7E1分析 293T细胞使用DMEM培养基+10%胎牛血清,每日换液,1∶3传代,传代后12 h,使用PEIpro转染试剂盒分别将各质粒单独转染至293T细胞,质粒与PEIpro比例为1∶2。48 h后进行流式分选,收集荧光细胞约104个,使用直接扩增PCR试剂盒对切割区域进行片段扩增,所用引物见表1(Ex52_1_F/R, Ex52_2_F/R),反应条件:95 ℃ 5 min,95 ℃ 20 s→60 ℃ 20 s→72 ℃ 60 s,35个循环,72 ℃ 5 min。切胶回收,使用T7E1酶切试剂盒,按说明书的方法进行切割,通过Image J计算切割的条带占总条带的比例,得到sgRNA的切割效率,结合MIT特异性分值,挑选切割效率高、预测脱靶可能性低的sgRNA组合进行后续实验。
1.2.3 hiPSCs突变模型构建 构建流程示意图见图1。hiPSCs的培养:细胞维持使用干细胞培养基Essential 8(E8),每日换液。使用0.5 mmol/L EDTA解离细胞,1∶3~1∶5传代。细胞传代后3 d,长至90%融合时准备电转,电转前换含有10 μmol/L Y-27632的E8培养基于37 ℃下孵育1 h,随后换Accutase于37 ℃下孵育10 min(可根据不同细胞系调整时间至完全消化为单细胞),加入培养基中和,1 000 r/min离心3 min后收集细胞。每个反应电转5×106个细胞,2种质粒按1∶1(物质的量)混合,总量不高于10 μg,设置程序B016,电转后铺于基质包被的6 cm 培养皿上。电转后48 h,充分消化为单细胞后进行流式分选,流式数据以FACS格式导出,使用FlowJo软件分析,收集红、绿双阳性的细胞约3×104个,均匀分散在50 mL含5 μmol/L Y-27632的E8培养基中,分铺于5个10 cm培养皿上,置于37 ℃、体积分数为0.05的CO2中孵育,24 h后换液。5 d后挑选形态良好、未分化的单克隆,转移至包被过的48孔板中。5 d后消化传代,留取部分细胞使用直接扩增PCR试剂盒裂解后进行基因型鉴定。所用引物见表1(Ex52_cut)。反应条件:95 ℃ 5 min,95 ℃ 20 s→60 ℃ 20 s→72 ℃ 90 s,35个循环,72 ℃ 5 min。
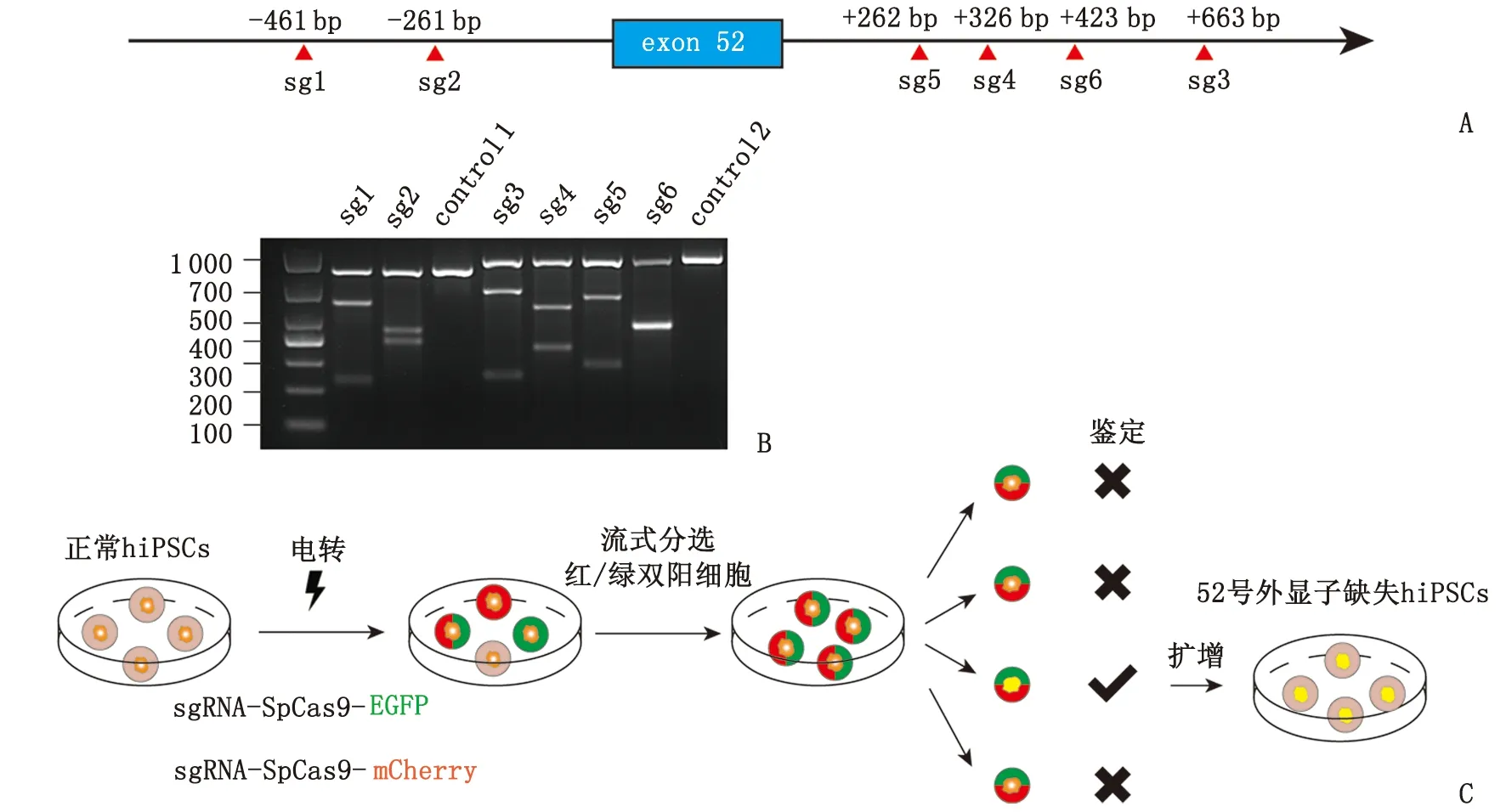
sg:sgRNA,单链引导RNA;hiPSCs:人诱导多能干细胞。

表1 引物序列
2 结 果
2.1 sgRNA选择 deepHF计算得到的sgRNA如表1所示,MIT特异性分值及CFD特异性分值计算结果如表2所示。为了验证不同sgRNA的切割效率,使用293T细胞测试载体的切割效率。T7E1酶切凝胶电泳如图1B所示,切割效率如表2所示。
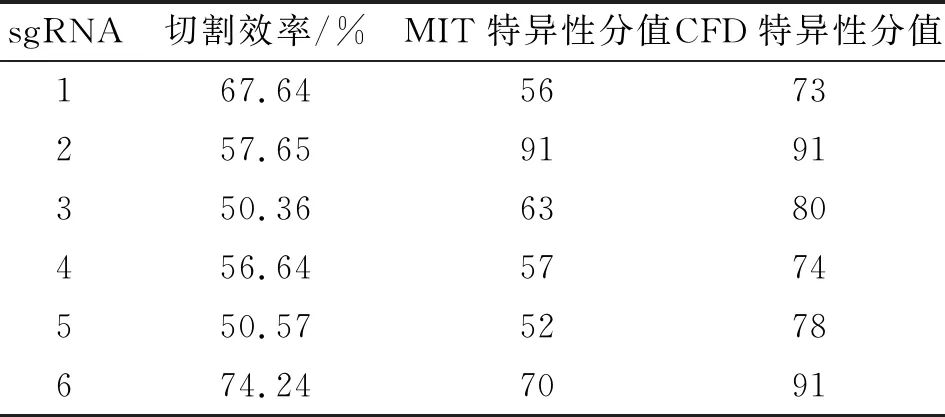
表2 各sgRNA切割效率
2.2 hiPSCs电转及流式分选 电转后24 h观察hiPSCs贴壁及荧光情况(图2A)。电转后48 h进行流式分选,收集Q2区域的红、绿双阳性的细胞,双质粒电转效率可达40.2%(图2B),将分选下来的单细胞铺于10 cm培养皿中长成单克隆,图2C为分选后24 h贴壁的单细胞。
2.3 单克隆基因型鉴定 根据设置的鉴定引物,正常基因型扩增片段长度为1 397 bp,而sgRNA 1+sgRNA 3组合为185 bp(图3A),23/48株中出现该截短片段;sgRNA 1+sgRNA 4组合为492 bp(图3B),6/35株中出现该截短片段;sgRNA 2+sgRNA 4组合为692 bp(图3C),4/24株中出现该截短片段。截短片段的Sanger测序结果也证实了以切割位点为断裂点的非同源末端连接模式。

sg:sgRNA。A:sgRNA 1+sgRNA 3的单克隆基因型鉴定结果;B:sgRNA 1+sgRNA 4的单克隆基因型鉴定结果;C:sgRNA 2+sgRNA 4的单克隆基因型鉴定结果。
3 讨 论
本研究通过电转CRISPR-Cas9系统的方式,利用双sgRNA切割,以非同源末端连接的方式,在正常hiPSCs中切除了dystrophin基因第52号外显子及上下游小段内含子,成功构建了52号外显子缺失的DMD hiPSCs细胞模型,为后续的基因修复研究提供帮助。
dystrophin基因自1987年被发现以来,一直是遗传性疾病研究的热点,尽管经历了诸多挫折,但作为治疗遗传性疾病的样板,医生和科学家们始终未放弃对该基因的研究。近年来,随着递送技术及基因编辑技术的进展,DMD的治疗有了跨越性的进步[2]。这种进步离不开各种DMD模型的贡献,例如最经典的mdx小鼠,在23号外显子中发生了无义突变,导致dystrophin基因翻译提前终止[15],可以很好地模拟出dystrophin基因突变与蛋白表达之间的关系,加上其遗传背景单纯,繁殖速度快,在几乎所有的DMD治疗研究中均作为重要的在体实验对象[2]。另外,犬、猪、猴等大型动物模型由于可较好地模拟人类的临床表型,也在治疗研究中发挥重要的验证作用[16-17]。然而,动物模型也存在一定的局限性,如小鼠模型缺少典型的人类临床表型,大动物模型饲养周期长、成本高、难以大量繁殖。更重要的是,无论模型动物的临床表型如何接近人类,他们的遗传背景还是与人类不同,针对它们设计的基因修复方案并不一定适用于人类,而患者来源的细胞模型可克服这个局限性。常见的DMD患者来源的细胞有成纤维细胞、外周血单个核细胞、羊水上皮细胞、成肌细胞等,而全长Dystrophin蛋白只在骨骼肌、心肌、大脑中表达[18],在上述细胞中并不表达,不能直接用于治疗研究。成肌细胞可在体外分化为骨骼肌细胞,但因来源于骨骼肌活检,对患者创伤较大,制备方法复杂且得率低,可传代次数少,难以支持规模化的基础研究,如治疗性小分子、sgRNA筛选等。借助hiPSCs则可克服上述缺点:首先,hiPSCs可以在体外制备出遗传背景与患者完全相同的各种组织类型的细胞,如心肌细胞、骨骼肌细胞、神经元、肾小球、肝细胞、自然杀伤细胞等[7,9,19-22],可有效补充动物模型在体试验的不足;其次,hiPSCs在体外可长期保持分化潜能,需要时可大量分化制备表达Dystrophin蛋白的细胞,目前已成为DMD治疗研究中首选的细胞模型。
随着基因编辑技术的发展,科学家们甚至能便捷、快速地对hiPSCs进行改造,使其更高效地辅助研究,如将荧光蛋白序列插入目的基因可检测基因表达的报告系统[23],又如敲除基因的相关功能区以研究蛋白功能等[24]。本研究采取的CRISPR-Cas9大片段切除是对hiPSCs进行改造的一种方案,其他可拓展的方案还包括利用同源重组在基因组中插入重复片段制备外显子重复模型,利用单碱基编辑系统制备无义/错义/剪切位点突变模型等。目前,绝大多数hiPSCs模型都来自患者的体细胞重编程,由于各种原因,可能存在难以获得特定基因型体细胞的情况,而本研究提供了一种解决方案,即在无法获得相应基因型的患者来源的体细胞时,可采用基因编辑技术构建出某种特定基因型的细胞模型,为后续的机制或治疗研究提供研究材料。
综上所述,本研究仅以dystrophin基因的52号外显子切除为例,介绍了运用基因编辑工具构建hiPSCs模型的方法及流程。这种方法可用于多种疾病的研究,适用于不同类型的基因功能验证。基因编辑构建的hiPSCs模型相较于疾病动物模型更贴近人类遗传背景,是在无法获得特定基因突变类型体细胞时的一种有效替代。

