外周血CD3+CD4-CD8+T细胞与T1期高级别尿路上皮癌预后的关系
蒋立人 高峰 陈思腾 潘麒
膀胱癌是男性最常见的恶性肿瘤之一,位于我国所有男性恶性肿瘤的第7位,约50%的患者会复发,另外约15%的患者会发生进展[1-2]。因此有必要寻找简便的预后标志物。肿瘤、免疫细胞、炎症因子和间质细胞构成肿瘤免疫微环境,影响肿瘤生长和增殖[3-4]。T细胞主要分为两类,并可以被CD3标记[5]。CD8+T细胞可以杀伤肿瘤细胞,但外周血CD8+T细胞对肿瘤的预后价值尚未明确[6-9]。本研究回顾性分析了168例T1期高级别尿路上皮癌患者,研究外周血CD8+T细胞数量与肿瘤预后的关系。
对象与方法
一、研究对象
收集2012年1月至2016年12月上海市第一人民医院诊治为T1期高级别尿路上皮癌患者168例。纳入标准:①所有患者均为初次行经尿道膀胱肿瘤电切术(transurethral resection of bladder tumor, TURBT)治疗的尿路上皮癌;②术后经病理诊断为T1期高级别尿路上皮癌(按《第四版世界卫生组织泌尿系统及男性生殖器官肿瘤分类》[10]的标准诊断);③后续接受膀胱内灌注化疗,药物为吡柔比星50 mg,每周1次,共2个月,随后改为每月1次,持续到术后2年或复发。排除标准:①伴有原发性心、肺、肾等器官疾病者;②围手术期前有感染性疾病、自身免疫性疾病、服用免疫抑制剂病史;③在围手术期出现严重并发症者;④有其他肿瘤。患者在手术2年内每3个月随访1次,2年后每6个月随访1次,随访时间至术后5年,记录患者随访时间内肿瘤复发与肿瘤进展情况。每个研究对象在手术前已在我院检验科进行外周血免疫细胞分群检测。根据研究目的,将外周血CD8+T细胞数量少于320个/μl的患者纳入CD3+CD4-CD8+数量低组,其余纳入CD3+CD4-CD8+正常组。
二、分析指标
本研究主要评估的临床及病理因素包括患者年龄、性别、术前外周血CD3+CD4-CD8+T细胞数量高低、肿瘤大小(≥3 cm)、单多发性、肿瘤术后复发和进展的情况。无复发生存(recurrence free survival, RFS)被定义为首次行TURBT到首次复发的这段时间,无进展生存(progression free survival, PFS)被定义为首次行TURBT到肿瘤进展(任意肿瘤分级、分期的提高)的这段时间。
三、统计学方法
研究使用SPSS 21.0软件。CD3+CD4-CD8+正常组和CD3+CD4-CD8+数量低组之间的临床病理因素比较使用t检验和卡方检验。采用Kaplan Meier分析各临床病理因素对RFS和PFS的影响,生存曲线的显著性差异检验用log-rank检验。多因素Cox回归生存分析包括下列因素:年龄、肿瘤大小(≥3 cm)、单多发、外周血CD8+T细胞数量高低。用Cox回归模型(逐步向前)进行多因素回归分析,计算出调整过的HR,评估影响RFS和PFS的预后因素。双侧P<0.05作为显著性检验水准。
结 果
一、CD3+CD4-CD8+正常组和数量低组间的各项临床病理因素的分析
168例T1期高级别尿路上皮癌患者中,男女比例131∶37,年龄28~93岁,平均(66.26±16.28)岁。其中复发91例(54.2%),进展37例(22.0%),平均RFS(37.30±23.15)个月,PFS(52.12±16.08)个月。CD3+CD4-CD8+正常组和CD3+CD4-CD8+数量低组在性别、年龄、肿瘤大小、肿瘤单多发、术后复发和进展方面的差异均无统计学意义(表1)。

表1 CD3+CD4-CD8+正常组和CD3+CD4-CD8+数量低组间各因素的比较
二、外周血CD3+CD4-CD8+细胞数量与RFS和PFS的关系
Kaplan-Meier生存分析显示CD3+CD4-CD8+正常组和CD3+CD4-CD8+数量低组的PFS均值分别为54.97个月(95%CI:52.23~57.70个月)和49.07个月(95%CI:45.09~53.05个月),两组的RFS均值分别为37.36个月(95%CI:32.45~42.27个月)和37.26个月(95%CI:32.30~42.22个月)。外周血CD3+CD4-CD8+细胞数量低与T1期尿路上皮癌患者更短的PFS相关(P=0.029)(图1),而与RFS无关(P>0.05)(图2)。多因素生存分析显示肿瘤≥3 cm(P<0.001,HR=3.05)、肿瘤多发(P<0.001,HR=2.64)是T1期尿路上皮癌复发的独立危险因素,而年龄≥70岁(P=0.022,HR=2.17)、肿瘤≥3 cm(P=0.003,HR=2.83)、外周血CD3+CD4-CD8+T细胞数量低(P=0.017,HR=2.31)是肿瘤进展的独立危险因素(表2)。
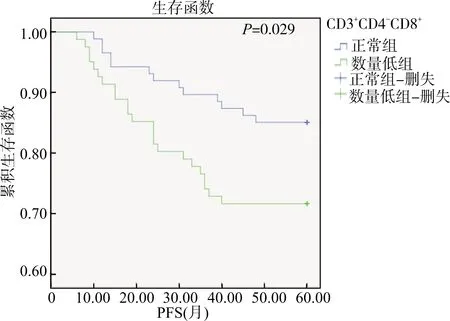
图1 Kaplan-Meier生存分析比较两组间的PFS

图2 Kaplan-Meier生存分析比较两组间的RFS

表2 多因素Cox生存分析各因素对T1期高级别尿路上皮癌患者RFS和PFS的影响
讨 论
目前研究认为肿瘤中T细胞的功能紊乱与T细胞功能的改变有关,处于肿瘤免疫抑制微环境中的CD8+T细胞对肿瘤细胞的杀伤力减弱[5,8]。肿瘤微环境中的抗原识别是T细胞功能失调的重要驱动因素[6,11]。通过激活CD8+T细胞对肿瘤细胞的识别和杀伤作用可以起到抑制肿瘤细胞的作用[5,8,12]。
有研究提示CD8+T细胞与膀胱癌患者的预后密切相关[7-8]。CD8+T细胞浸润的增加会随着肿瘤分期和/或分级而升高,特别是CD8+T细胞出现在不同的位置会对预后产生截然不同的影响[7-8,13]。当CD8+T细胞大量浸润肿瘤组织或肿瘤边缘时,患者的总生存期和无病生存期显著提高[8,14]。而当CD8+T细胞在肿瘤间质大量浸润时,患者的预后反而更差[15-16]。此外,在不同病理分级的膀胱癌患者中,CD8+T细胞对患者预后的影响也不尽相同。有研究认为在低级别非肌层润性膀胱癌患者中,CD8+T细胞的浸润与不良预后有关[16]。而在高级别尿路上皮癌中,CD8+T细胞的低表达和快速复发紧密相关[17]。我们基于对168例T1期高级别尿路上皮癌的分析发现,术前外周血CD8+T细胞数量低和肿瘤进展相关,提示外周血CD8+T细胞的数量可能反映了机体肿瘤免疫的状态。
本研究也有不足之处,首先本研究是回顾性研究,明确外周血CD8+T细胞和T1期高级别尿路上皮癌的预后关系仍需要前瞻性的队列研究。其次,由于患者术后外周血免疫全套的检测缺失,我们无法比较术前术后CD3+CD4-CD8+值变化的情况。另外,外周血CD8+T细胞的水平受到多种因素的影响,需进一步研究来排除其他的混杂因素。
综上所述,本研究发现术前外周血CD3+CD4-CD8+细胞数量可以作为判断T1期高级别尿路上皮癌患者预后情况的标志物,为临床医师诊治提供了一定的参考价值。

