米槁组织培养不定芽发生与继代增殖
梁格林,刘济明,2*,武梦瑶,刘 欢,唐子燕
(1 贵州大学 林学院, 贵阳 550025;2 贵州大学 森林生态研究中心, 贵阳 550025)
米槁(CinnamomummigaoH. W. Li)系樟科(Lauraceae)樟属(Cinnamomum)常绿乔木,主要分布于中国贵州、广西、云南等省份[1],其干燥成熟的果实为贵州省十大苗药之一的大果木姜子,具有散寒怯湿、行气止痛等功效[2]。现代研究表明米槁果实精油中主要的化学成分为1,8-桉叶素(23.75%)、香桧烯(10.63%)、柠檬烯(8.77%) 和a-松油醇(6.36%)等,具有减少心肌耗氧量,增加心肌供氧,促进冠脉流量,对急性心肌缺血和梗死具有良好的保护等药理作用[3-5]。常见的以米槁果实为原料研发的制剂有“理气活血滴丸、心胃止痛胶囊、金喉健喷雾剂”等民族中成药[2]。前期调查发现米槁药材主要来源于野生资源,由于人为扰动过大,生态环境破坏,现存的有效野生资源多为成年古树,幼树罕见,种子发芽率低,造成米槁种群呈衰退趋势,无法满足药用需求[6]。为了满足市场需求,实现药材资源的可持续健康发展,米槁人工培育势在必行。目前米槁主要通过播种育苗繁殖,但种子生物学研究表明,米槁种皮坚硬且厚,种子透水性差,种子活力会随时间的增加而下降,正常播种发芽率低[7]。这些问题严重制约了米槁的实际生产及大规模规范化种植的开展。同时,前期米槁扦插研究发现[8],米槁插穗中存在对生根起抑制作用的物质,影响其成活率。本实验对米槁离体培养进行研究,通过不定芽的诱导及增殖,旨在建立米槁繁殖体系,满足种苗需求,为米槁产业化和规范化种植奠定基础。
1 材料和方法
1.1 试验材料
于2018年11月采集贵州大学林学院(106°39′26.50″E,26°27′14.58″N)播种栽培的2年生优质米槁植株为供试材料。选取当年生生长健壮、未木质化或半木质化的带芽茎段为外植体。
1.2 方 法
1.2.1 外植体消毒处理选取当年生生长健壮、无病虫害枝条,摘除叶片,用牙刷蘸取洗洁精水,轻轻刷去外植体表面灰尘,并把刷洗好的外植体放置在流水下冲洗2 h左右,将外植体表面灰尘与洗洁精水冲洗干净,然后转移到组培超净工作台上操作。用75%酒精浸泡30 s,再分别用0.1% HgCl2和2%次氯酸钠溶液处理6.5、7.0、9.0 min后,用无菌水冲洗3~5次(3个处理),无菌滤纸吸干外植体表面水分,用无菌刀片切除茎段上下两端,保留1.5~2 cm长的带腋芽茎段,接种于配制好的培养基中,每个处理20瓶,每瓶接种1个外植体,重复3次。接种20 d后,记录存活、感染及褐化情况。
1.2.2 外植体最佳取材时间分别于1月、4月、6月、7月、9月、10月、11月选取外植体,采用相同消毒方式对其进行消毒处理。将消毒后的茎段切去与药液接触的伤口后,接种于均添加蔗糖30 g/L、琼脂6.5 g/L的MS基本培养基中。每处理30个外植体,重复3次。培养15 d后,观察并统计带芽茎段染菌率、褐化率及发芽率。
1.2.3 不定芽初代诱导培养选用最佳消毒时间和取材时间处理外植体,将带芽茎段接种到均添加蔗糖30 g/L、琼脂6.5 g/L的MS培养基中,再分别添加不同浓度(1.0、2.0 和3.0 mg/L)6-BA与IBA(0.1、0.2 和0.3 mg/L),共9个不同浓度组合的处理。每个处理接种20瓶,每瓶1~2个带芽茎段,重复3次。接种25 d后观察带芽茎段的变化,统计不定芽诱导率。
1.2.4 不定芽继代增殖培养通过茎段培养获得的不定芽为培养材料,将不定芽分割成2 cm长的芽,接种到含有不同浓度6-BA(0.1、0.3和0.5 mg/L)与NAA(0.2、0.5和1.0 mg/L)以及AC(0.3 g/L)的MS培养基中进行增殖培养。正交试验,共9个处理,每个处理接种20瓶,每瓶1~2个不定芽,重复3次,接种30 d后开始观察和记录不定芽增殖情况。
1.2.5 培养条件以上试验培养条件为:温度(25±2)℃,光照时间12~14 h/d,培养基pH5.8。对米槁带芽茎段进行不定芽诱导和增殖时光照强度1 500~2 000 Lx。
1.3 数据统计与分析
所有数据于Excel 2016中进行,使用SPSS25.0软件进行数据处理与统计分析,Origin2018软件绘图。结果统计中涉及的测定指标计算公式如下:
污染率(%)=污染外植体数/接种外植体数×100%
成活率(%)=成活外植体数/接种外植体数×100%
褐化率(%)=褐变外植体数/接种外植体数×100%
发芽率(%)=腋芽萌发外植体数/总接种外植体数×100%
不定芽诱导率=诱导出不定芽的带芽茎段数/接种的带芽茎段数×100%
增殖系数=增殖后长出的不定芽总数/接种的不定芽个数。
2 结果与分析
2.1 不同消毒处理组合对米槁不定芽诱导培养的影响
采用0.1% HgCl2进行不同消毒时间的灭菌,接种到MS培养基上,结果(表1)显示,外植体污染率、褐化率及存活率在各处理组间的差异达到显著水平,其中,A1处理组的污染率最低(1.06%),外植体褐化率最低(3.26%),存活率最高(95.74%)。A2处理组的外植体污染率与A3处理组的外植体褐化率极显著高于其他两组处理,达到13.31%和20.00%。因此,综合考虑适用于米槁外植体的消毒方式为75%酒精 30 s+0.1% HgCl26.5 min。
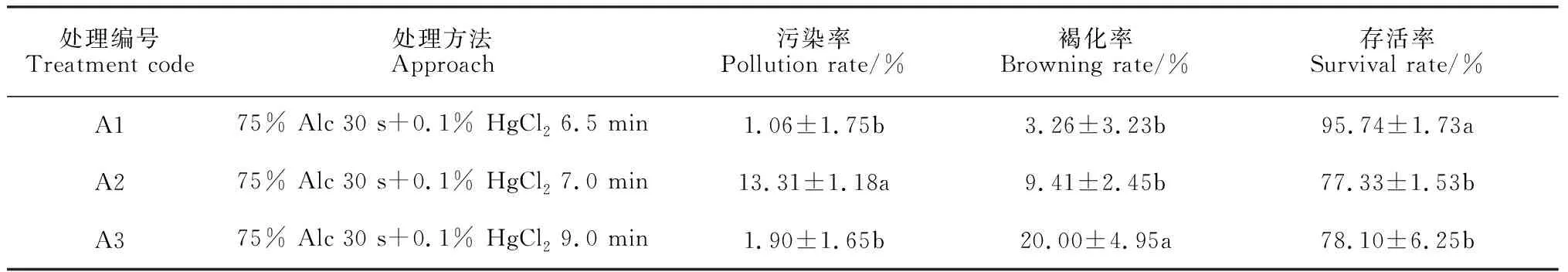
表1 不同消毒组合处理对外植体污染率的影响
依照上述最佳消毒时间,取不同时期的米槁带芽茎段作为外植体,在MS培养基中进行接种,其外植体的染菌率、褐化率及发芽率会因取材时期的不同而不同(图1)。方差分析表明,不同取材时期对污染率、褐化率和发芽率有显著性影响。1月、7月和10月外植体染菌率最高,达到16.00%、9.59%和17.77%。6月和7月米槁外植体的褐化率相比其他月份较高,且发芽率最低。9月、10月和11月米槁外植体的发芽率较高,褐化率也较低,其中,11月污染率也低(4.04%)。因此,整体情况综合分析, 11月份是外植体取材进行消毒的最佳时期。
2.2 激素配比对米槁不定芽诱导培养的影响
不定芽诱导过程中,带芽茎段接种7 d左右,腋芽出现萌动;10 d后,腋芽开始长出,叶片嫩绿细长;15 d后,所处理的腋芽都开始萌发,茎段长出新的侧枝,叶片伸展,茎变粗壮,由于带腋芽茎段的腋芽处于萌动时期,所以分化时间快(图2,A-C);培养30 d后可继代培养,芽生长情况好,颜色深绿,茎段粗壮。对9种培养基上的不定芽诱导率进行方差分析(表2),结果表明,不同植物生长调节物质及其浓度对不定芽诱导的影响差异极显著(P<0.01),说明6-BA与IBA均是影响米槁带芽茎段诱导率的重要因素。由表2可见,在MS培养基上,随着6-BA浓度的增加,不定芽诱导率先升高后下降,说明6-BA浓度过高会抑制不定芽的产生; IBA浓度过高也会抑制腋芽的诱导,使诱导率有所下降。3.0 mg/L 6-BA 与0.3 mg/L IBA处理组C8与C4处理无显著差异,但处理组C8的诱导率达最大值(84.02%)。因此,最适合米槁带芽茎段诱导的培养基为MS + 3.0 mg/L 6-BA + 0.3 mg/L IBA。
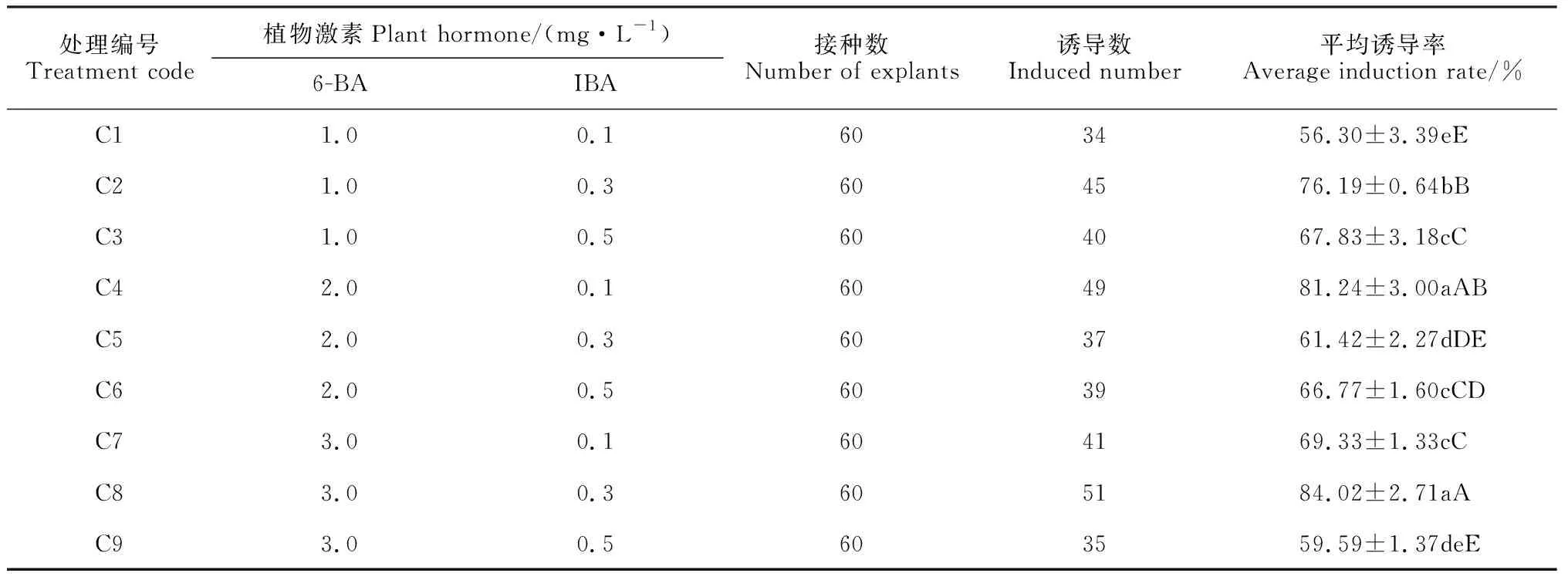
表2 激素配比对米槁不定芽诱导培养的影响
2.3 激素配比对米槁不定芽继代增殖培养的影响
由正交试验结果(表3)可知,不定芽诱导极差显示为RB>RA,两种激素的影响效应表现为NAA>6-BA,NAA浓度一定时,不同浓度6-BA处理下的增殖系数无显著差异,证明不定芽诱导增殖主要与NAA浓度有关。根据各因素水平增殖系数平均值(Ki)的大小,可得到最优水平组合为A1、B3;同时,方差数据分析表明(表4),激素NAA对增殖系数有极显著影响(P<0.01),而6-BA以及6-BA与NAA的交互作用均无极显著影响(P>0.01)。综上所述,最适宜米槁增殖的培养基为: MS+ 0.1 mg/L 6-BA + 1.0 mg/L NAA。
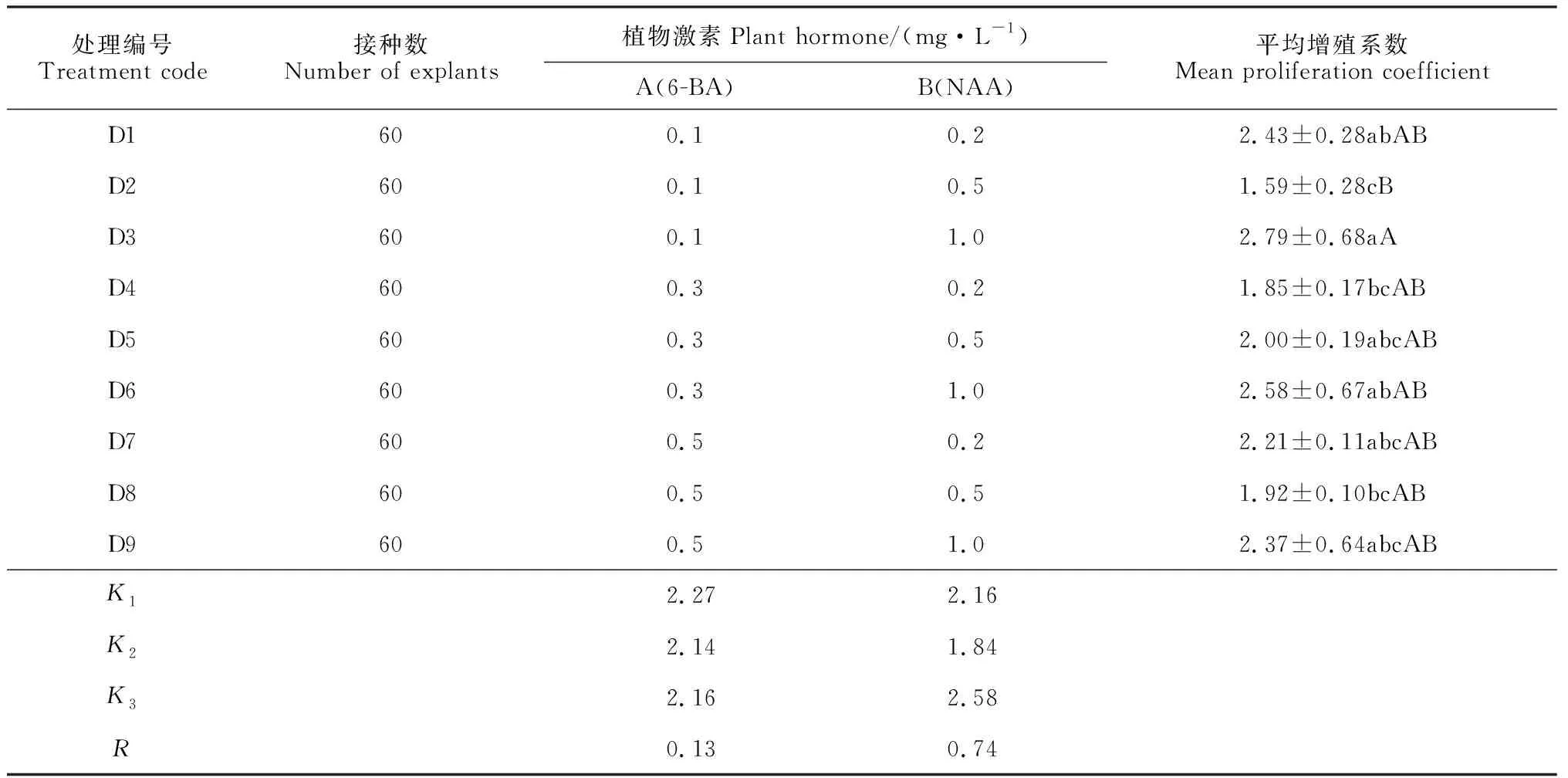
表3 米槁不定芽继代增殖培养的正交试验

表4 增殖系数方差分析结果
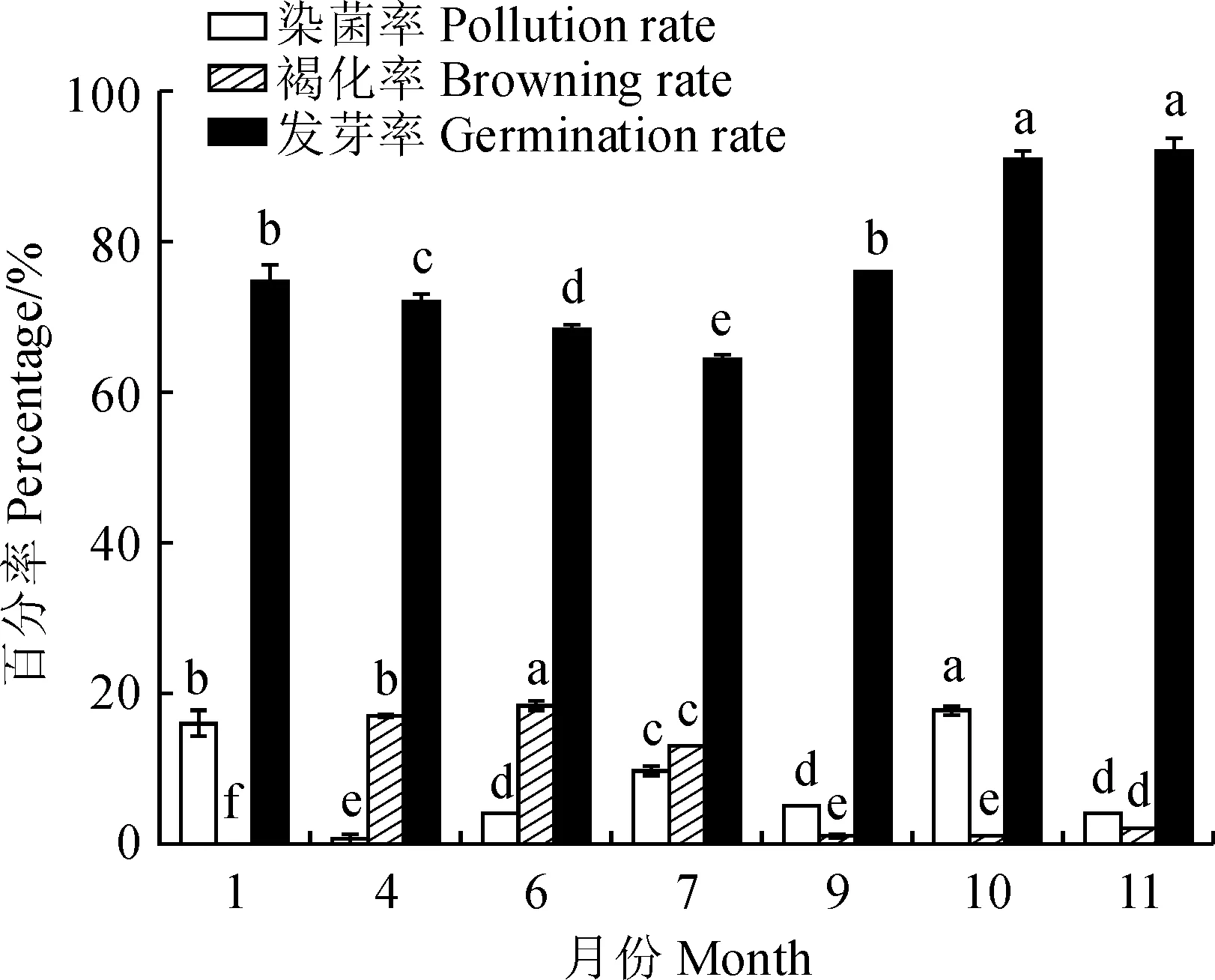
不同小写字母表示同一处理在不同月份之间差异显著(P <0.05)图1 不同取材时期对外植体的影响Different normal letters indicate that the same treatment has significant differences in different months (P<0.05)Fig.1 The effect of different sampling time points on explants

A. 培养7 d后腋芽萌动;B. 培养10 d后叶片伸长,叶片嫩绿细长;C. 培养15 d后茎段长出新侧枝,叶片舒展,茎渐粗壮图2 茎段培养不定芽的发生和生长情况A. The axillary buds germinate after 7 days of culture; B. After 10 days of culture, the leaves are elongated, green and slender; C. After 15 days of culture, the new side branches grow from stems, the leaves stretch, and the stems become thickerFig.2 Adventitious buds induced by stem segments
将生长健壮的芽进行切割,接种于增殖培养基中,培养一周左右茎段腋部及其他部位开始萌发出腋芽;培养15 d后,腋芽明显伸长,基部不定芽丛明显增多,并开始伸长,整体呈翠绿色;30 d后基部不定芽丛生长快速,侧芽分化出芽,叶片伸展,颜色转为深绿色(图3,A-B)。

A. 培养10 d的小苗;B. 培养30 d后的丛生芽及小苗图3 茎段的继代增殖与培养A. The seedlings cultivated for 10 days; B. The cluster buds and seedlings cultivated for 30 daysFig.3 Subsequent proliferation and cultivation of stem segments
3 讨 论
本研究采用米槁带芽茎段为外植体直接诱导不定芽,进而进行不定芽增殖。省去了外植体诱导产生愈伤组织,再由愈伤组织分化出不定芽的阶段,缩短了从外植体到组培苗的整个诱导周期,同时也提高了增殖系数,是一种更加快速高效的再生体系[9]。
组培工作的两大重点和难点包括外植体的消毒和培养基的组配,其中获得有活性的无菌材料是植物离体快繁体系的首要条件[10]。本研究表明米槁外植体的最适消毒方式为75%酒精30 s + 0.1% HgCl26.5 min,污染率和褐化率分别低至1.06%和3.26%。与脑樟(Cinnamomumcamphora)[11]、大叶芳樟(Cinnamomumporrectum)[12]、牛樟(CinnamomumkanehiraeHay)[13]在组织培养过程中选用的消毒方式相同,但采用HgCl2进行消毒的时间受外植体的大小和幼嫩程度影响。在本研究中,11月为外植体取材的最佳时期,而彭东辉等[11]采集脑樟带芽茎段进行研究后发现,3-4月及9-10月两个时间段腋芽萌发率最高,分别为68.5%和64.6%;官锦燕等[14],辛亚龙等[13]以牛樟带芽茎段为外植体进行诱导试验,发现3-4月、6月出芽率高于9-10月和12月。这可能由于外界环境和季节的变化引起了植物体内内源激素含量的变化[15-16];秋季植物体茎段二次抽梢,由于气温低,外植体生理代谢的活动减弱,细胞内参与氧化反应的多酚活性减低[17]。依据上述研究,以茎段作为外植体,在采集时间上既要考虑外植体的生理状态、芽体实际情况及内源激素含量存在的差异,也要考虑当地的气候条件。
植物激素作为调节植物生长发育的物质,在植物再生缺失的组织和器官的进程中,能够诱导缩短再生进程,既能起到诱导的作用,也能抑制植物的生长[18]。试验研究发现6-BA和IBA均对米槁不定芽的诱导影响显著。6-BA作为一种常用的植物细胞分裂素,在使用过程中需要控制好浓度,过高浓度会抑制不定芽的诱导(IBA浓度为0.3 ml/L除外);同时过高浓度的IBA会降低诱导率,这与官锦燕等[14]、辛亚龙等[13]对牛樟的研究结果相似,高浓度的IBA会更容易诱导出愈伤组织,从而降低不定芽诱导率。与申展[19]、林萍等[20]研究结果不同:以MS培养基为基本培养基添加6-BA及NAA,对香樟(Cinnamomumcamphora)、闽楠[Phoebebournei(Hemsl.)Yang]及滇润楠(Machilusyunnanensisvar.duclouxii)的诱导效果更佳。这可能是由于基因型不同,对不同激素诱导的响应不同。
在樟科的组织培育中,MS基本培养基附加1.5~2.0 mg/L的6-BA增殖效果更好[13, 21],甚至在脑樟[11]和香樟[22]的研究中,使用3.0~4.0 mg/L的6-BA腋芽均能正常生长并增殖;并表明6-BA对不定芽增殖影响差异显著,NAA差异不显著,高浓度的NAA易诱导愈伤组织,不利于细胞分化形成芽苗。而本研究发现不定芽的增殖主要与NAA的浓度有关,添加1.0 mg/L NAA的培养基中增殖系数最高。可能是因为增殖过程中内源激素与外源激素需要达到一种动态平衡,不同基因型的外植体内源激素含量不一样,导致在增殖分化时需要添加的外源激素的种类及浓度也有所差异。Skoog[23]“激素平衡”假说也提到:生长素生物学效应大于细胞分裂素时,诱导植物组织脱分化;细胞分裂素的效应大于生长素时,诱导愈伤组织再分化;值得注意的是,激素的生物学效应是内源激素与外源激素效应的总和。也有研究认为NAA与6-BA具有一定的互作效应[24],导致这一差异的原因也可能是培养基内激素浓度配比不同所致。Amirchakhmaghi等[25]提出使用1/2MS培养基可获得更好的增殖系数,而MS培养基更有利于芽的伸长,因此,利用1/2MS培养基为基本培养基或者选用更高浓度的6-BA进行米槁增殖培养是否会达到更好的增殖效果还有待进一步研究。
辛全伟[26]、冯瑜[27]对香樟的研究均表明AC对抑制褐化作用最明显,且有利于增殖系数的增加,本试验中添加了0.3 g/L AC,有效减少了增殖过程中的褐化现象。在组织培养阶段,需要持续观察增殖苗的生长状况,以便使用适量的外源植物生长调节剂;同时,为了达到快速繁殖的目的,既要维持一定的诱导率与增殖系数,也需提升有效苗的数量。该研究通过组织培养技术进行了米槁种苗的快速繁殖,为其规模化和产业化人工种苗生产及应用提供了基础。

