荷兰鸢尾突变株‘紫韵’的花色突变相关机理分析
林 兵,陈艺荃,方能炎,钟淮钦,叶秀仙,樊荣辉*
(1 福建省农业科学院 作物研究所,福州 350013;2 福建省农业科学院 农业工程技术研究所,福州 350013)
荷兰鸢尾(Irishollandica)为鸢尾科(Iridaceae)鸢尾属(Iris)秋植球根花卉。花姿优美、如鸢似蝶、花色艳丽,主要有白色、黄色和蓝紫色等色系。很多植物中,蓝紫色花的形成主要由花色素苷途径控制,如葡萄风信子(Muscari)、睡莲(Nymphaeaspp.)等[1-3],蓝紫色花的深浅程度主要取决于花色素苷途径中飞燕草素(delphinidin)及其衍生物含量,红色主要取决于矢车菊素(cyanidin)及其衍生物含量[4-5]。花青素苷合成后会进行分子修饰,这是花色素结构多样化和稳定性的基础,在不同的物种中呈现多样性,其修饰类型包括糖基化、酰基化和甲基化。花青素苷的糖基化和甲基化使颜色更红,而花青素苷的酰基化改变波长吸收最大值,使颜色更蓝,并且酰化的花青素苷分子间的堆积,能使形成的蓝色非常稳定[6-8]。目前,在月季(Rosachinensis)、康乃馨(Dianthuscaryophyllus)和菊花(Dendranthemamorifolium)中已获得转基因蓝紫色花[8-9]。荷兰鸢尾花色素苷途径大部分相关基因被研究[10-11],其蓝紫色花的深浅主要由花色素苷的种类、含量,黄酮等助色素及类胡萝卜素的含量三者共同作用,其中花色素苷的种类和含量为主控因素[12],这为花色研究奠定了基础。然而,由于特定位点突变导致色素缺失,进而导致花色变浅或变深的可能分子机制存在广泛性和不确定性,可能是某个基因、某个蛋白,也可能是某个转录因子的突变,导致花色变异机理的研究难以澄清,这就需要更多的数据去解释花色变异原因。本团队从荷兰鸢尾蓝紫色野生型‘展翅’中选育出紫色突变株‘紫韵’,本研究以‘展翅’和‘紫韵’为材料,研究花色由蓝变紫的色素差异及分子机制,为荷兰鸢尾蓝紫色花中花色苷积累机制提供更全面的了解,同时为花色变异机理研究提供技术支持。
1 材料和方法
1.1 试验材料
野生型‘展翅’和突变株‘紫韵’种植于福建省农科院花卉研究中心种质资源圃中。野生型‘展翅’旗瓣颜色(93A, violet blue, 蓝紫色),突变株‘紫韵’旗瓣颜色(86A, dark violet, 紫色)。
分别采取‘展翅’(蓝紫色)和‘紫韵’(紫色)旗瓣,液氮中速冻,-80 ℃保存,用于色素成分分析及转录组测序;分别取‘展翅’和‘紫韵’的花发育3个时期(花蕾前期、花蕾中期和始花期),用于qRT-PCR,以检测目的基因随花发育的表达情况。
1.2 方 法
1.2.1 花色素苷的定性定量分析花色素苷的定量定性分析采用超高效液相色谱-四级杆飞行时间串联质谱联用(UHPLC-QTOF-MS) 技术进行,每个样品 3 个生物学重复。
花色素苷的提取: 实验材料在冻干机中冻干后,取出100 mg左右,采用上海净信实业发展有限公司型号为JX-24的全自动组织研磨仪,于40 Hz频率研磨4 min;加入1 mL 60%乙醇溶液(含0.1%盐酸)于恒温水浴锅中35 ℃下浸提2 h;在4 ℃离心机中14 000 r/min离心15 min,取上清,用温和氮气吹去其中的乙醇,并补充一定体积0.1%盐酸的水溶液,用于后续分析。
UPLC 条件: 色谱柱为Acquity uplc beh C18(100 × 2.1 mm, 1.7 μm, Waters), 温度为 45 ℃。流动相组:A相,水(含0.5% 甲酸溶液);B相,乙腈(含0.5% 甲酸溶液)。洗脱条件: 2 min,1%B;1 min,5%B;6 min,20%B;3 min,50%B;3 min,100%B; 100%B保持2 min; 最后1%B平衡 3 min。流速0.4 mL·min-1, 进样体积3 μL。
质谱条件: LockSpray离子源在正电喷雾电离和负电喷雾电离(ESI)模式下运行。扫描模式为MSE模式,以低能扫描(CE 4eV)和高能扫描(CE倾斜20-45eV)来破碎离子,氩气(99.999%)被用作离解气体。扫描范围50~1000 amu(atomic mass unit),速度 0.2 s /扫描。毛细管电压2 kV(正模式),锥电压40 V,源电压偏移60 V。光源温度115 ℃,脱溶剂气温度为450 ℃。去溶剂气流量900 L·h-1,锥气流量50 L·h-1,氮气(> 99.5%)用作去溶剂和锥气。
花色素苷含量测定采用标准曲线法,利用标准品矢车菊素3-O-葡萄糖苷(cyanidin-3-O-glucoside)作为外标对花色素苷含量进行半定量分析。标准品的浓度梯度为 500、250、100、50、10、5及1 μg· mL-1。每个样品重复3次。采用UNIFI 1.8.1(Waters) 软件进行数据分析。
1.2.2 转录组测序及分析通用RNA提取试剂盒(北京百泰克生物科技有限公司)提取总RNA。RNA完整性用NanoDrop 2000(Thermo Scientific,MA,USA)检查。使用Illumina HiSeqTM4000进行文库构建和转录组测序(北京百迈克生物技术公司),每个样品2个重复。
应用Fastx-Toolkit软件获得原始测序数据(Raw reads),利用FastQC (http://www.bioinformatics.babraham.ac.uk/projects/fastqc)软件对Raw reads过滤得到高质量的过滤后数据(Clean reads);Clean reads再组装成基因转录本(Transcripts)和单基因簇(Unigene)。利用RSEM软件对基因表达量进行预测,采用FPKM(fragments per kilobase million)方法对测序数据标准化处理[13]。使用DESeq软件差异表达基因进行评估[14]。差异基因间的阈值为错误发现率(false discovery rate,FDR) < 0.01且差异倍数(fold-change value) ≥ 2。
1.2.3 实时荧光定量PCR(qRT-PCR)分析使用ABI 7500实时PCR系统(Applied Biosystems)进行qRT-PCR。Primer Premier 5.0引物设计以确定基因的相对表达水平(表1)。熔解曲线分析确认PCR的特异性。每个样品3个生物学重复。β-actin为内参。相对定量计算方法应用2-ΔΔCt法[15]。

表1 qRT-PCR所用引物序列
2 结果与分析
2.1 花色素苷鉴定
应用UHPLC-QTOF-MS技术,对野生型‘展翅’(蓝紫色)和突变品种‘紫韵’(紫色)的旗瓣进行花色素苷定量定性鉴定(图1),共鉴定出9种花色素苷,且均为花色素的糖基化,形成花色素-葡萄糖苷。‘展翅’总花色素苷含量为543.5 μg· g-1,‘紫韵’总花色素苷含量有所降低,为392.7 μg· g-1,其中有3种花色素苷含量显著降低,矢车菊素-3-芸香糖苷(矢车菊素-3-鼠李葡糖苷)含量由144.42 μg· g-1降为46.39 μg· g-1,矮牵牛素-3-(6-鼠李糖基-2-木糖基葡萄糖苷)含量由61.86 μg· g-1降为31.67 μg· g-1,矢车菊素-3-(2G-木糖基芸香糖苷)含量由25.22 μg· g-1降为7.65 μg· g-1,1个花色素苷含量显著升高,6-羟基矢车菊素-3-葡萄糖苷含量由5.88 μg· g-1升为10.34 μg· g-1(表2)。花色素苷含量的变化可能是导致花色由蓝紫向紫方向转变的原因。
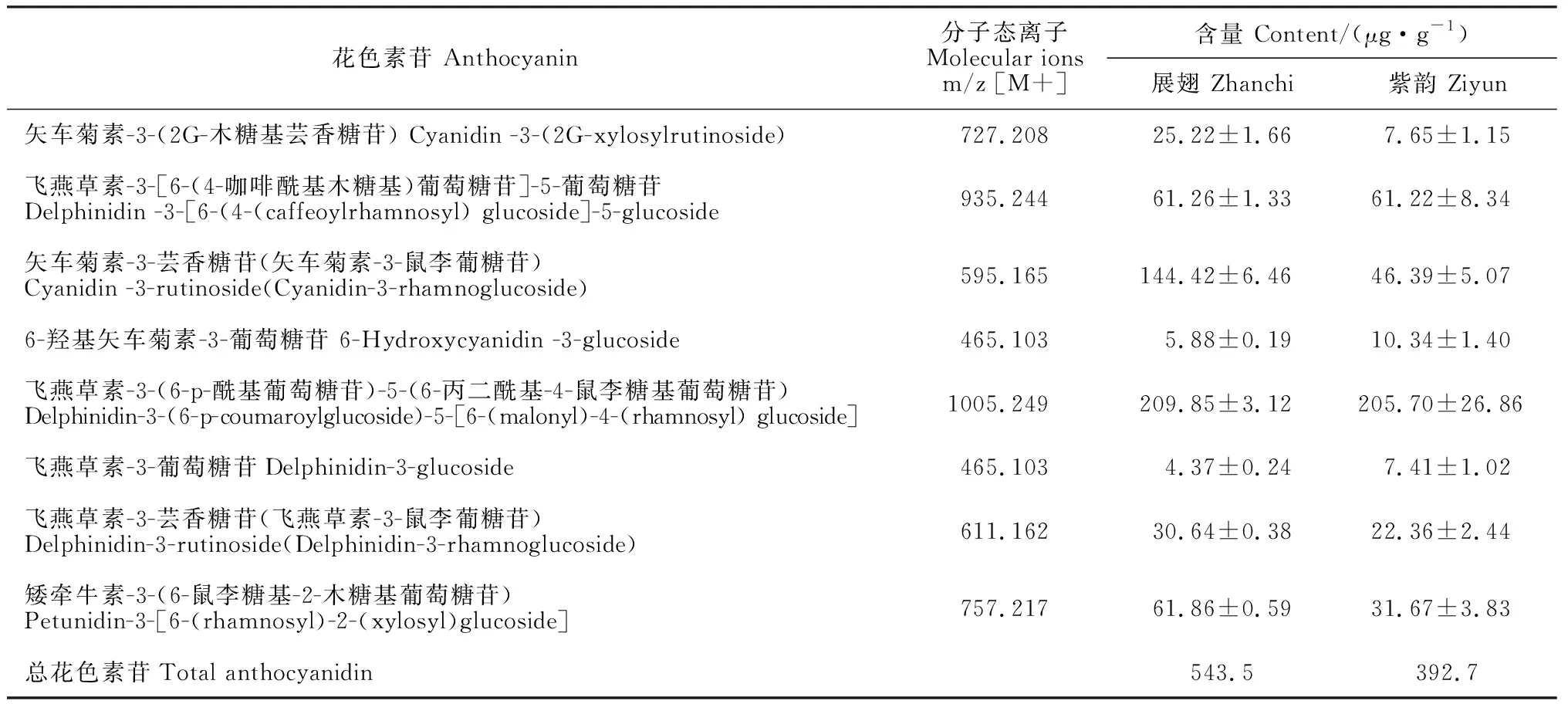
表2 荷兰鸢尾花中花色素苷的鉴定

图1 荷兰鸢尾野生型‘展翅’及突变品种‘紫韵’Fig.1 The parent ‘Zhanchi’ and mutant variety ‘Ziyun’ of Iris hollandica
2.2 转录组数据分析
为了进一步探索‘紫韵’突变为紫色的原因,将‘展翅’和‘紫韵’的旗瓣进行转录组测序,共获得26.61 Gb Clean reads(表3), 通过组装获得46 530个Unigenes,平均长度为1 081 bp。其中128 90个Unigene长于1 000 bp,占总数的27.70%。与‘展翅’相比,有43个基因上调表达,有73个基因下调表达,转录本丰度通过层次聚类分析法进行聚类(图2)。花色素苷途径共发现2个差异表达基因,1个查尔酮合成酶(chalcone synthase,CHS)基因和1个UFGT基因均下调表达。
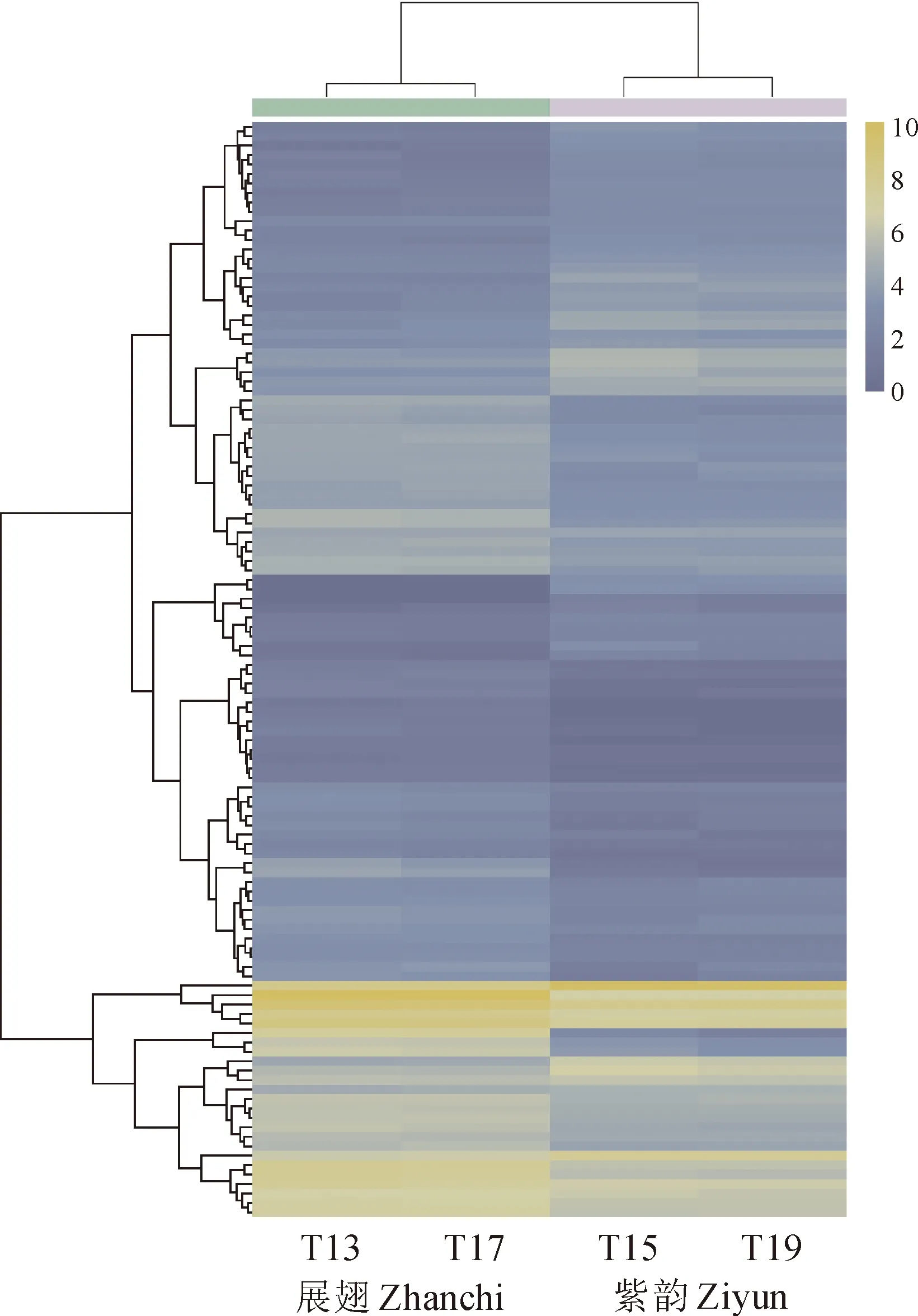
图2 荷兰鸢尾2个品种的表达谱分析Fig.2 Expression profiles analysis of unigenes in two varieties of Iris hollandica

表3 转录组测序数据
2.3 花色变异相关基因分析
转录组数据中共发现14个CHS基因,2个在‘展翅’和‘紫韵’花中均高表达,表达量达到上千,1个(IhCHS1, BMK_Unigene_25661)在‘展翅’花中表达量偏高,而在‘紫韵’花中较低(图3),其余11个在2个品种表达量均偏低。IhCHS1在偏紫色‘紫韵’中的下调表达,一定程度上可能会限制花色素苷代谢流,但笔者认为这不是导致花色变紫的主要原因,因为有2个CHS在‘紫韵’花中高表达。共发现5个UFGT基因,1个基因(IhUFGT1, BMK_Unigene_00148)在‘展翅’花中高表达,在‘紫韵’花中表达量相对较低,其余4个基因在2个品种表达量均很低,推测IhUFGT1在‘紫韵’花中的较低表达,导致某些花色素葡萄糖苷合成降低,使颜色由蓝紫转为紫色。

P1. 花蕾前期;P2. 花蕾中期;P3. 始花期图3 CHS和UFGT基因表达分析P1. Early bud period; P2. Mid-bud period;P3. Early flowering periodFig.3 Expression analysis of CHS and UFGT genes
IhUFGT1的开放阅读框(ORF)为1 383 bp, 编码461个氨基酸。聚类分析表明,IhUFGT1与已知鸢尾UFGT亲缘关系最近,其次与同为鸢尾属的小苍兰(Freesiahybrid)聚为一类(图4)。对‘展翅’和‘紫韵’的3个花发育时期进行qRT-PCR分析,结果显示,IhCHS1和IhUFGT1 在‘展翅’和‘紫韵’中随着花的发育表达量逐渐上升,到始花期达到最高。在始花期,IhCHS1和IhUFGT1 在‘展翅’中的表达高于‘紫韵’(图3)。 qRT-PCR进一步证实IhUFGT1在‘紫韵’中的相对低表达。UFGT催化花色素形成花色素-葡萄糖苷,IhUFGT1的相对低表达,导致花色素-葡萄糖苷含量变化。

图4 荷兰鸢尾UFGT进化树分析Fig.4 Phylogenetic analysis of UFGT of I. hollandica
3 讨 论
花色素苷是植物重要的次生代谢物之一,通常以糖基化的形式存在。糖基化可增加花色素在细胞内的稳定性、溶解性并加强其转运特性[16-17]。本研究通过UHPLC-QTOF-MS分析,共鉴定出9种花色素苷,均为糖基化花色素苷,在花色偏紫的‘紫韵’中,4种花色素苷含量与亲本‘展翅’有显著差异,推测是花色由蓝变紫的主要原因。研究表明,荷兰鸢尾蓝紫色花的深浅主要由花色素苷的种类和含量,黄酮助色素的辅助着色及类胡萝卜素的含量三者共同作用,其中花色素苷的种类和含量为主控因素[12]。本研究中,未发现类胡萝卜素途径相关基因及黄酮形成关键基因的差异表达。另外,金属离子协同作用和液泡pH值也是影响其颜色的因素[18-21]。在紫色郁金香(Tulipagesnerianacv. Murasakizuisho)中,花瓣紫色部分和花被蓝色部分含有相同的飞燕草色素苷和黄酮醇,而蓝色花被中,金属离子Fe3+的浓度是紫色部分的25倍[22]。紫花牵牛(Ipomoeatricolor)中,紫红色的花蕾在开放后变成蓝色,花冠表皮细胞的pH值从6.6上升到7.7[23]。‘紫韵’花色的改变,除与花色素苷含量有关外,是否存在其他影响因素,还需进一步验证。
蓝紫色花的形成受到花青素途径的多个基因控制,如F3′5′H和DFR对蓝紫色花的形成起重要作用,其中F3′5′H被称为‘蓝色基因’。菊花中过表达风铃草F3′5′H基因,使菊花变为蓝紫色[24]。月季中转入堇菜(Violaspp.)F3′5′H基因和鸢尾(Iris×hollandica)DFR基因,花色由浅紫红色变成了蓝紫色[25]。本研究的转录组数据中,F3′5′H和DFR基因均未发现有差异表达,导致荷兰鸢尾花色由蓝紫色变为深紫色的主控基因可能是花色素苷修饰基因。
UFGT是花色素苷途径的最后一个基因[26]。UFGT作为产生花色素苷的主要控制点,将葡萄糖转移至花色素的C-3羟基上,生成花色素3-O-葡萄糖苷[27]。这是使花色素具有稳定性和植物水溶性的关键一步[11]。UFGT的表达与花色素苷的积累相一致,UFGT的表达改变会导致花色素苷含量发生相应变化,UFGT的过低表达甚至会导致花色素苷缺失或花色素苷含量显著降低[28-30]。转基因烟草中,NtUFGT基因的过低表达,使花色素苷含量显著降低,花色接近白色[31]。本研究中,IhUFGT1在偏紫色突变体‘紫韵’中表达量有所下降,导致花色素苷含量改变,使花色由蓝紫变为紫色。花色素的修饰是一个复杂的系统,目前,对花色素修饰机理的研究还不够透彻,需要大量数据去解析和阐述,这一研究结果为花色素修饰提供一定参考,也为蓝紫色花色改良提供理论基础。后续构建该基因的过表达载体,遗传转化‘紫韵’,进行进一步验证。
紫色花中4种花色素苷含量有显著变化,可能是导致花色由野生型‘展翅’蓝紫色向突变株‘紫韵’紫色方向转变的主要原因。IhUFGT1在紫色‘紫韵’花中表达量相对较低,致使花色素苷含量变化,最终导致花色由蓝紫转为紫色。

