微生物菌肥对退化高寒草甸地上生物量和土壤理化性质的影响
任卓然,邵新庆,李金升,李 慧,何宜璇,古维娜,王茹颖,杨灵婧,刘克思,2,3*
(1. 中国农业大学草业科学与技术学院, 北京 100193; 2. 河北沽源草地生态系统国家野外科学观测研究站, 河北 沽源 076550;3. 中国科学院西北高原生物研究所青海省寒区恢复生态学重点实验室, 青海 西宁 810008)
高寒草地是由耐寒的多年生植物形成的一类特殊的地带性植被类型,是亚洲中部高山及青藏高原隆起之后所引起的寒冷、湿润气候的产物[1]。在我国,高寒草地主要分布在青藏高原,面积约16.538×105km2[2],占中国草地面积的41.88%[3],是我国最大的草地畜牧业生产基地和重要的生态屏障[4]。高寒草地是所在环境相对恶劣的一类草地,具有低的年平均气温(低于0℃)和降水量(约437 mm),非常高的太阳辐射,非常短的植物生长季节(约3.5个月),强烈的风和水侵蚀(48 t·ha-1·a-1),在严酷的环境下的高寒草地对外界的扰动非常敏感[5]。近几十年来,在不合理的利用叠加自然因素的影响下,有接近90%的草地已退化,近26%严重退化[6]。草地退化包括植被的退化和土壤的退化[7]。植被的退化使得植被盖度、生物量、草地产量和质量以及草地上生物多样性逐渐下降[8-13]。土壤的退化使土壤养分减少、土壤结构受损、水分条件变差、土壤微生物活性降低和群落减少[14-18]。随着退化程度的加剧草地生产力和草地质量均明显降低[19]。
土壤微生物作为生态系统中物质循环和能量流动的一个关键因子,在养分循环、碳动态、土壤系统发育和功能等方面发挥着重要作用,是生态系统功能维持和群落稳定的基础[20]。改善退化系统中的微生物活性和群落结构已经成为退化系统修复的一种很有效的手段。随着人们对土壤微生物研究的不断深入,功能性微生物肥料逐渐得到广泛的应用。微生物肥料指一类含有活性微生物的特定制品,通过具有活性的微生物生命活动使植物得到所需营养,其应用于农业生产中,能够获得特定的肥料效应[20-21]。相比于其他肥料,微生物菌肥有着无毒害、无污染的优点[22-24],微生物菌肥施用后可以促进土壤中有机营养分解为植被可以吸收利用的状态并促进植物吸收,进而促进植物生长发育,提升作物产量;除此之外,微生物肥料通过向土壤中添加有活性的微生物,增强土壤微生物的活性,促进土壤中养分转化,从而改变土壤理化性质,促进植物生长[25-26]。微生物菌肥可以与病原菌通过竞争作用、拮抗作用、重寄生等方式来达到抑制植物根部病原菌生长的目的,而且微生物菌肥还可以刺激植被根部的发育,诱导植物自身蛋白质的表达,提升植被核酸的合成效率来提高植物的抗性[27]。柴青等人的研究发现,在不同的土壤湿度条件下施用微生物菌肥均可促进针茅(StipacapillataL.)、扁穗冰草(Agropyroncristatum(L.) Gaertn.)和紫花苜蓿(MedicagosativaL.)的生长[28];赵旭等人研究表明,含乳酸菌(Lactobacillus)类的菌肥可以有效改善苜蓿农艺性状,显著提高苜蓿产量与品质[29];王斌等人的研究表明醋酸杆菌(Acetobacter)可以以醋酸盐作为碳源,产生CO2,释放能量[30],部分醋酸杆菌还具有固氮功能[31]。Pattanop等人的研究表明,酸杆菌具有许多编码纤维素酶和半纤维素酶的基因,在植物残体降解中起到重要的作用[32];王光华等人的研究表明,酸杆菌还可以参与铁循环和单碳化合物代谢,具有光合能力[33]。功能性微生物菌肥在研制之初主要被应用于物种相对单一的大田和温室作物土壤中,在物种相对丰富的天然草地上应用相对较少。物种的丰富度在一定程度上影响着土壤的理化性质和微生物的组成、结构及活动[34]。高寒草地即使在退化的状态下,植被物种数还是比大田和温室作物多,因此高寒草地退化土壤系统内微生物菌肥作用下土壤理化性质和微生物的活动可能不同于耕作系统。但目前这方面的研究信息还很缺乏,因此,在本研究以高寒退化草地为研究对象,研究了以富含有乳酸菌和醋酸杆菌这两种菌的菌肥为施用材料在不同添加梯度下对高寒退化草地土壤理化性质和草地生产力的影响,以期为利用功能微生物修复退化高寒草地提供科学支撑。
1 材料与方法
1.1 研究区域概况
研究区位于青海省贵南县东北部的高寒草地(36°35′ N,101°42′ E,3 220 m a.s.l.)。试验地属典型的高原大陆性气候,冬长夏短;年平均气温为2.3℃,年极端最高气温31.8℃,年极端最低气温—29.2℃,年降水量为403.8 mm,年平均日照时数为2 907.8 h,年平均蒸发量为1 378.5 mm;土壤类型为黑钙土。试验草地主要植物物种包括高山嵩草(Kobresiapygmaea)、黄帚橐吾(Ligulariavirgaurea.)、宿生早熟禾(Poaperennis)、苔草(Carexsp.)等。2017年5月中旬所选试验地初始覆盖度为40%~60%,植物物种数为8~10种,根据国家标准[35]将其划分为中重度退化的高寒草甸。
1.2 试验设计
整个试验采用完全随机区组试验设计,分3个区组,每个区组包括随机排列的4个不同处理。本研究选取富含乳酸菌和醋酸杆菌(比例为1∶1)的菌肥为施用基础材料。组合菌肥中含有的有效活菌数为≥10×108cfu·mL-1。为了评估菌肥不同施用量对退化高寒草地的改良效应,试验中用菌肥是按菌剂∶水=1∶4的比例进行稀释而得,稀释后的菌液按3种不同的施用量[150 mL·m-2(R1),200 mL·m-2(R2)和250 mL·m-2(R3)]进行施用,以不施用菌肥为对照(0 mL·m-2,CK),其中R2施用量是在农田中常用的菌肥施用量。2017年6月5日前往试验地进行小区的划定和施肥处理。每个处理小区面积为3 m×3 m,每个小区间有1.5 m的缓冲带,每个区组间有3 m的缓冲带,缓冲带上不做任何处理。在施用过程中,为了减少对草地的破坏,加快菌液向土壤中的运移,采用孔施和表施相结合的方法。具体操作为:在每个处理小区土壤表面垂直于地面横竖方向上每间隔25 cm用直径为1 cm的改锥打深度为20 cm的小孔,每个小区121个孔,再用注射器将10 mL的菌剂液体注入小孔中,剩余的菌剂溶液用喷壶均匀的撒施在处理小区的表面。
1.3 取样与测定
在2017,2018和2019年的8月初到试验地进行样品采集。对于植物样品,主要通过样方法取样,在每个小区随机选取3个50 cm×50 cm样方,记录样方中植物的地上生物量。植物的地上生物量的测定通过齐地面刈割样方内的植株,装入相应的牛皮纸袋内并带回实验室用烘箱在65℃烘为恒重记录重量。
土壤样品采集,在每个处理小区,随机选取3个点进行土壤取样。在每个取样点,用直径为3.5 cm的土钻按0~10 cm和10~20 cm分层取土。取出的同层土样,迅速混合均匀,分成3份,1份放入准备的铝盒(编号G3,铝盒称重)盖封好,1份放入牛皮纸袋,1份装入自封袋放入0℃的储存箱迅速送回实验室,放进—20℃的冰箱保存。放入铝盒的那份带回实验室迅速称重W1,然后和放入牛皮纸的那份一起放入60℃烘箱烘为恒重。烘完后,铝盒的部分重新称重G2,通过计算得出土壤含水量[含水量(%)=(G1—G2)×100/(G2—G3)]。牛皮袋部分土样在实验室内过2 mm筛,按标准方法测定与土壤营养和健康状态相关的一些指标(土壤pH、土壤电导率(Electric conductivity,EC)、土壤有机碳(Total organic carbon,TOC)含量、土壤总氮(Total nitrogen,TN)含量、硝态氮(Nitrate nitrogen,NN)含量、铵态氮(Ammonium nitrogen,AN)含量、有效磷(Available phosphorus,AP))含量。土壤pH、电导率(EC)测定用酸度计和电导率仪(METTLER TOLEDO,Switzerland)。TOC和TN含量测定用碳氮元素分析仪(Thermo Fisher Scientific,Italy)。土壤铵态氮和硝态氮含量测定用流动化学分析仪(FIA Compact,Germany)。土壤有效磷含量的测定用分光光度计(JingHua,China)。
1.4 数据分析
用Excel 2010进行数据汇总和前期整理及柱状图作图,采用SPSS 19.0进行采用单因素方差分析(One-way ANOVA)和Tukey’s post hoc检验(置信度为95%)。处理间用LSD多重比较分析不同年份和不同土层处理间的不同指标的差异。
2 结果与分析
2.1 菌肥对高寒退化草地地上生物量的影响
与CK处理相比,除2018年R1处理外微生物菌肥的添加显著增加了退化高寒草地地上植被生物量(P<0.05)(图1)。在不同菌肥施用量的处理中,不同的施用年里植被生物量的最大值均出现在R2处理,分别为192.32 g·m-2(2017年),191.76 g·m-2(2018年)和202.68 g·m-2(2019年)。R2和R3处理中植被生物量随着施用时间的增加有增加的趋势。在施肥第一年(2017年),与CK处理相比,菌肥施用处理下的地上植被生物量平均增加126%,到施肥的第三年(2019年),增加幅度达到184%。

图1 2017年、2018年和2019年菌肥施用量对地上生物量的影响Fig.1 Effects of application rates of bacterial fertilizer on aboveground biomass in 2017,2018 and 2019注:各处理菌肥施用量为,R1:150 mL·m-2,R2:200 mL·m-2,R3:250 mL·m-2,CK:0 mL·m-2;不同字母表示同一年中不同浓度菌肥添加下上差异显著(P < 0.05),*表示同一菌肥添加浓度下不同采样年之间差异显著(P<0.05),下同Note:The application amounts of bacterial fertilizer for each treatment are,R1:150 mL·m-2,R2:200 mL·m-2,R3:250 mL·m-2,CK:0 mL·m-2;Different letters indicate significant difference among different microbe additions within the same year at the 0.05 level,* indicates significant difference among different sampling years under the same microbe addition at the 0.05 level,the same as below
2.2 菌肥对高寒退化草地土壤理化性质的影响
在施用菌肥的第一年(2017),退化高寒草地表层土壤(0~10 cm)的pH在微生物菌肥的作用下与CK处理没有显著的差异(图2);到施用的第三年(2019年),各微生物菌肥添加处理的表层土壤pH值显著高于CK处理(P<0.05)。对于同一菌肥施用处理,表层土壤pH随着微生物菌肥施用时间的增加而显著增加(图2)。
在10~20 cm土层中,各处理间的土壤pH值在第一年(2017年)和第二年(2018年)之间变化不显著,但在施用的第三年(2019年),微生物菌肥施用的土壤pH显著高于CK处理(P<0.05)。对于同一菌肥施用处理,该层土壤pH也随着微生物菌肥施用时间的增加而显著增加(图2)。整体而言,高寒退化草地0~20 cm土层中的pH值在微生物菌肥的作用下呈现增加的趋势,并在施用后的第三年(2019年)显著增加(P<0.05)。
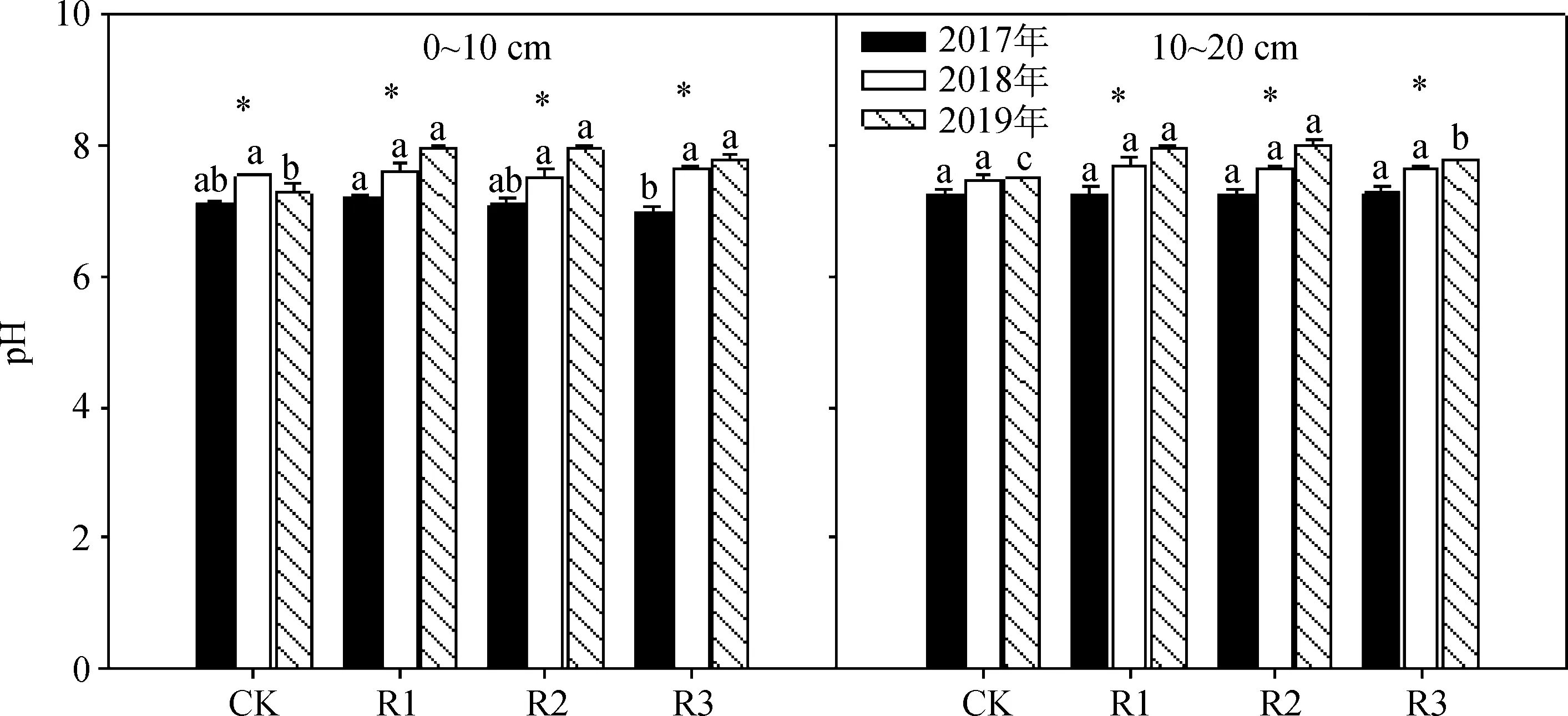
图2 2017年、2018年和2019年微生物菌肥施用量对不同土层土壤pH的影响Fig.2 Effects of application rates of bacterial fertilizer on soil pH in different soil layers in 2017,2018 and 2019
在0~10 cm土层,微生物菌肥施用的第一年(2017年)土壤含水量在各处理间无显著差异;在施用的第二年(2018年),高浓度(R3)的微生物菌肥施用使该层土壤含水量显著高于CK处理(P<0.05);在施用的第三年(2019年),土壤含水量随着微生物菌肥施用量的增加有增加的趋势并在R3处理中达到最高(图3)。
在10~20 cm土层,2017年各处理中的土壤含水量随着微生物菌肥添加量的增加而增加,菌肥添加量最高的R3处理土壤含水量最高,与其他处理有显著性差异(图3);在2019年各处理中的土壤含水量无显著变化。

图3 2017年、2018年和2019年不同微生物菌肥添加梯度对不同土层土壤含水量(SWC)的影响Fig.3 Effects of application rates of bacterial fertilizer on soil water content in different soil layers in 2017,2018 and 2019
在表层土壤(0~10 cm)中,土壤有机碳含量在2017年和2019年整体上随着微生物菌肥施加量的增加呈增加的趋势(图4);在2018年,只有R2处理中的土壤有机碳含量高于对照处理(图4)。
在深层土壤(10~20 cm)中,土壤中有机碳含量在菌肥施用初始两年(2017年和2018年)与CK相比并没有显著的变化,但在施用的第三年(2019年),R1和R3处理中土壤有机碳含量显著高于CK处理(P<0.05),R3处理中土壤有机碳含量最大,值为37.49 g·kg-1。R1处理中的土壤有机碳含量在2019年的显著高于2017年和2018年(P<0.05)(图4)。
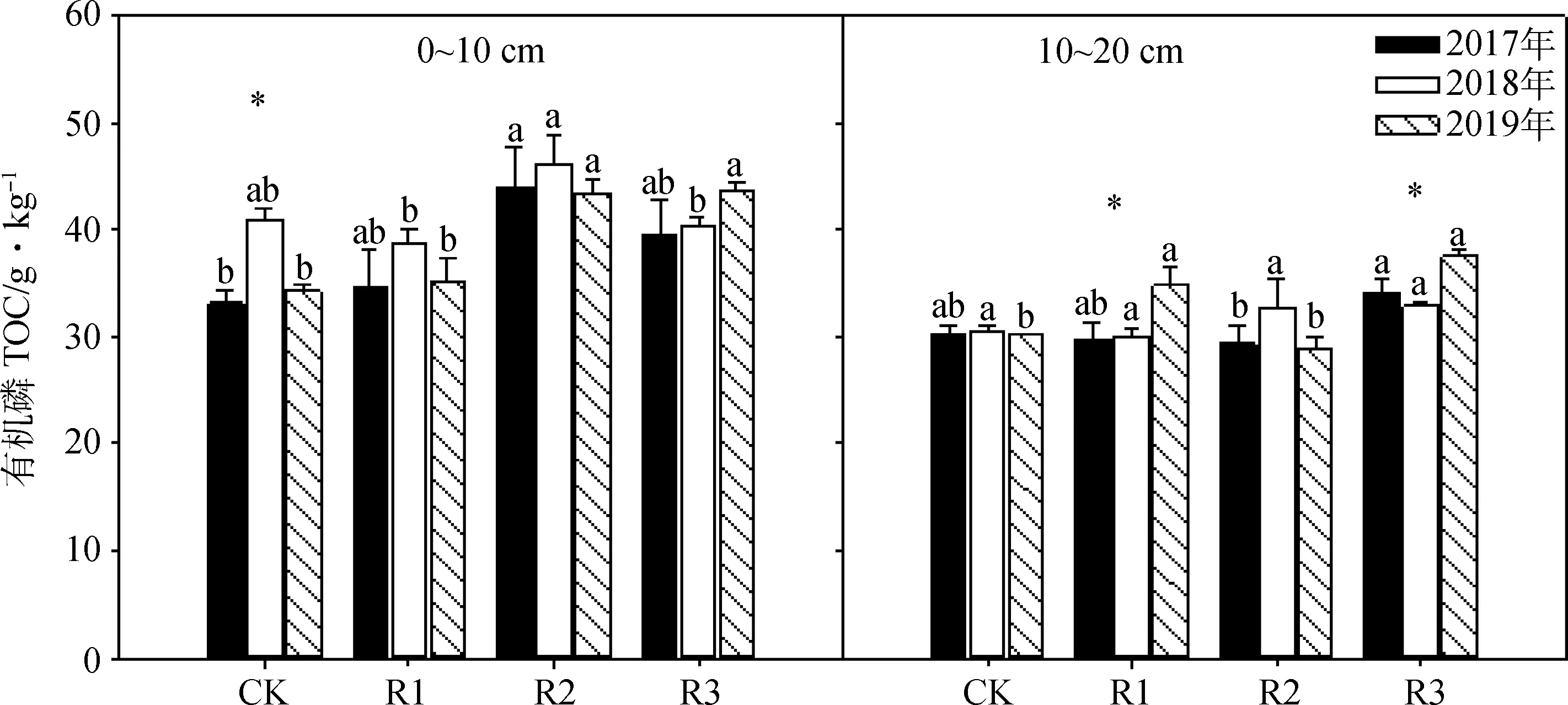
图4 2017年、2018年和2019年微生物施用量对不同土层土壤有机碳(TOC)含量的影响Fig.4 Effects of application rates of bacterial fertilizer on soil organic carbon (TOC) content in different soil layers in 2017,2018 and 2019
土壤全氮含量在表层土壤(0~10 cm)中随着微生物菌肥添加量的增加整体呈现增加的趋势(图5)。在2017年和2019年,R2和R3处理的土壤全氮含量显著高于CK(P<0.05),在2019年,R2处理中的土壤全氮含量显著高于CK处理(P<0.05)。

图5 2017年、2018年和2019年微生物施用量对不同土层土壤全氮(TN)含量的影响Fig.5 Effects of application rates of bacterial fertilizer on soil total nitrogen (TN) content in different soil layers in 2017,2018 and 2019
在10~20 cm土层中,微生物菌肥的添加对土壤全氮含量无显著影响,但随着菌肥施用量的增加,土壤全氮含量有一定程度的增加,土壤全氮含量最大值均出现在R3处理中,分别为2.78 g·kg-1(2017年)、3.51 g·kg-1(2018年)和3.32 g·kg-1(2019年)。
0~10 cm土层中的铵态氮含量在添加不同浓度的微生物菌肥后有不同程度的改变(图6)。在微生物菌肥添加的第一年(2017年),R1和R3处理中的铵态氮含量显著高于CK(P<0.05);在施用的第二年(2018年),铵态氮含量在R2处理达到最大,为50.40 mg·kg-1;在施用的第三年(2019年),只有R3处理中的铵态氮含量高于CK,其值为28.39 mg·kg-1。在同一个施肥处理内,除R1外铵态氮含量在施用的三年间出现先显著升高后显著下降的趋势。
在深层土壤(10~20 cm)中,2017年铵态氮含量在微生物菌肥的处理中显著高于CK(P<0.05);而在2018年和2019年,微生物菌肥的添加使土壤中的铵态氮含量低于CK。在同一微生物菌肥添加的处理中,随着施用时间的增加铵态氮含量显著下降(P<0.05)(图6)。
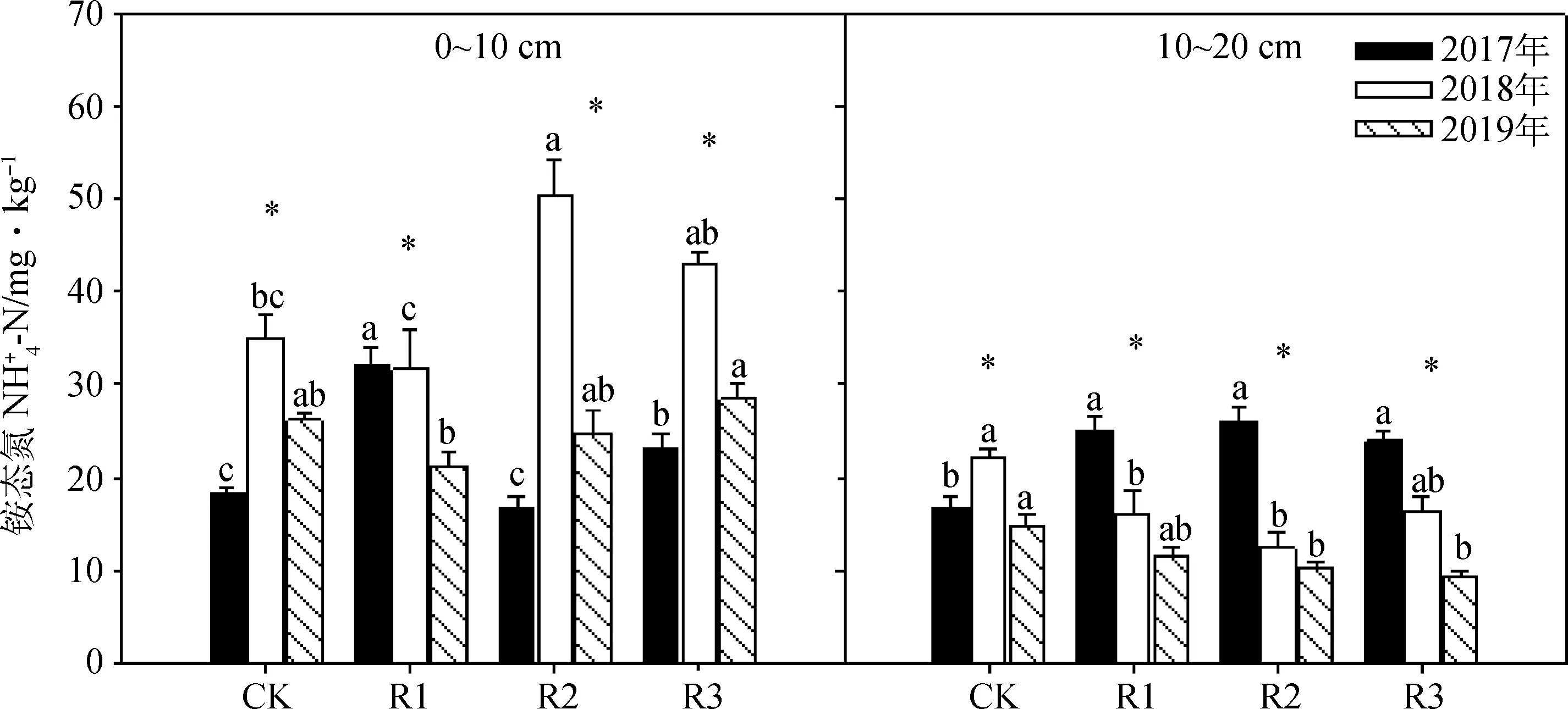
图6 2017年、2018年和2019年微生物菌肥施用量对不同土层土壤铵态氮的影响Fig.6 Effects of application rates of bacterial fertilizer on soil ammonium nitrogen contene in different soil layers in 2017,2018 and 2019
在0~10 cm土层中,土壤中硝态氮含量在菌肥施用的前两年(2017年和2018年)在各处理之间变化较小且无显著差异(图7);在施用的第三年(2019年),随着微生物菌肥添加量的增加,土壤硝态氮含量有增加的趋势,最大值为18.25 mg·kg-1(R3)。在同一施肥处理下,土壤硝态氮含量在施用的第三年(2019年)显著高于2017年和2018年(P<0.05)(图7)。

图7 2017年、2018年和2019年微生物菌肥施用量对不同土层土壤硝态氮含量的影响Fig.7 Effects of application rates of bacterial fertilizer on soil nitrate nitrogen content in different soil layers in 2017,2018 and 2019
在深层土壤(10~20 cm)中,2017年和2019年各个处理中的土壤硝态氮含量无显著差异;在2018年,微生物菌肥添加处理中的土壤硝态氮含量显著高于CK(P<0.05),但微生物菌肥各处理中的土壤硝态氮含量无显著变化。试验结果显示微生物菌肥的施用对表层土壤硝态氮的影响较为显著,且随着施用时间的增加土壤中硝态氮含量有一定增加的趋势。
高寒退化草地施用微生物菌肥后,表层土壤(0~10 cm)中土壤有效磷含量变化幅度较小,特别是在2017年和2018年,除2017年R1显著大于CK外,其他各处理间与CK相比无显著变化(图8),但到施用的的第三年(2019年),微生物菌肥施用的土壤中有效磷含量的显著高于CK(P<0.05),但各微生物菌肥处理间的土壤有效磷含量无显著差异。在同一个处理中,微生物菌肥施用时间的增加没有使表层土壤有效磷含量发生显著变化。
在10~20 cm土层,土壤有效磷含量随着微生物菌肥施用量的增加呈现一定增加的趋势(图8)。与CK处理相比,在2017年R2处理土壤中有效磷含量增加显著(P<0.05),2018年R3土壤中有效磷含量增加显著(P<0.05)。到施用的第三年(2019年),各微生物菌肥处理中土壤有效磷含量均显著高于CK(P<0.05),但各菌肥处理间差异不明显。

图8 2017年、2018年和2019年微生物菌肥施用量对不同土层土壤有效磷(AP)含量的影响Fig.8 Effects of application rates of bacterial fertilizer on soil available phosphorus content in different soil layers in 2017,2018 and 2019
3 讨论
3.1 微生物菌肥对退化高寒草地地上生物量的影响
添加微生物菌肥显著提高植物地上生物量,这与权国玲等人的研究一致[36-37],可能是由于微生物菌肥的施用能促进土壤有益微生物的繁殖并且抑制土壤致病菌的生长[23]。有研究表明乳酸菌能够产生有机酸[38],有机酸的大量积累促进有机质的分解,分解过程中产生的糖可以促进固氮细菌的生长[39],同时,乳酸菌的代谢产物如有机酸、细菌素、胞外多糖、过氧化氢等具有很强的抑菌能力[38],有益微生物的增加和土壤致病菌的减少都有利于地上生物量的增加。
此外,菌肥的施用一方面能够增加微生物的活动从而增加土壤中营养元素如氮、磷和钾等的可用性,促进难溶性的营养物质加速溶解供植物吸收[40]。另一方面菌肥中的乳酸菌可以提高土壤中脲酶的活性[18],而脲酶可通过分解土壤中的尿素降低土壤pH并提供氮源[41]。
在本研究中,微生物的添加促进了土壤有机质的合成(图4),增加土壤氮含量(图5),增加土壤中可利用的速效养分含量(图6,7,8),这些积极的影响都有利于植物生长,从而导致植物的地上生物量在微生物菌肥施用后显著增加。
3.2 微生物菌肥对退化高寒草地土壤理化性质的影响
在高寒退化草地添加微生物菌肥后,土壤pH随着时间的增加有一定的升高。这可能与微生物菌肥添加后所引起的一系列化学过程有关,特别是脱羧作用、有机碳矿化过程,其释放的OH-以及消化H+的质子作用可以提升pH值[42]。土壤中pH的小幅度上升有利于降低土壤中铜离子和锌离子的有效性,这更有利于植被的生长和土壤微生物活动[42]。
退化高寒草地的土壤含水量也在微生物菌肥施用后有一定的增加,这可能是由于微生物添加后,一方面促进了地上植被的生长,减少了照射土壤的阳光,进而减少土壤水分的蒸发;另一方面,微生物菌肥添加后促进了植被地下根系的生长和土壤有机质含量的增加,进而增强了对水分的固持能力,从而增加土壤含水量。
土壤碳氮的含量不仅是表征土壤肥力水平的重要元素,而且在决定土壤生产力和生态系统能量平衡过程中也起着重要作用[43]。本试验研究发现,在高寒退化草甸中添加微生物菌肥会引起0~20 cm土层中有机碳和全氮含量的增加。可能是因为乳酸菌的添加可以提高土壤中脲酶的活性[18],脲酶可通过分解土壤中的尿素增加土壤中的氮含量[41]。而且乳酸菌与醋酸杆菌的代谢产物之一是有机酸[38,44],有机酸的大量积累有利于有机质的分解,而有机质的分解过程中产生的糖可以促进固氮细菌的生长[39],进一步增加土壤中的氮含量。在表层土壤(0~10 cm)中,200 mL·m-2和250 mL·m-2处理均引起有机碳和全氮含量的显著增加,这说明较高的微生物菌肥添加量更有利于土壤有机碳和全氮的积累。宋以玲等[45]研究发现,在花生地中添加不同梯度的微生物肥料可以显著增加土壤中有机碳和全氮含量,并且幅度随着添加量的增加而变大;库永丽等[46]的研究也发现了在土壤添加微生物菌肥后土壤中的全氮和有机质含量会显著增加,与本研究结果一致。而对于土壤中的铵态氮和硝态氮,研究发现微生物菌肥的添加一定程度上增加了表层土壤(0~10 cm)中铵态氮含量的含量,而对深层土壤(10~20 cm)中铵态氮的含量无显著影响;表层土壤(0~10 cm)中的硝态氮含量在菌肥施用的前两年无显著变化,但在第三年(2019年),土壤硝态氮含量显著增加,而在深层土壤(10~20 cm)中,随着微生物菌肥施用时间的增加,土壤硝态氮含量增加。这表明在退化高寒草地中添加微生物菌肥可以增加表层土壤中有效氮的含量,并且随着菌肥添加时间的增加,土壤有效氮含量的增幅变大。在深层土层中,微生物菌肥施用时间的延长增加了土壤铵态氮向硝态氮的转化,这说明在深层土壤中,施用时间和微生物菌肥的双重作用增加了土壤硝化作用,导致了硝态氮含量的增加。这可能是由于硝态氮不易被土壤胶体所吸附,而铵态氮容易被土壤胶体及矿物固定,且在一定条件下可以转化为硝态氮[40],其次土壤pH值的升高也有利于硝化作用。土壤有效磷的含量在微生物菌肥施用后也有所增加,这可能因为微生物的添加提高了有解磷作用的微生物的活性,进而加快了土壤中难溶性或不溶性磷的溶解,提高土壤中磷素的有效性[47]。
4 结论
研究发现富含乳酸菌和醋酸杆菌的微生物菌肥的添加对退化高寒草地地上植被的生长有着显著的促进作用,并且在退化高寒草地土壤修复中具有改善土壤理化性质的潜力。地上植被的生物量随着微生物菌肥施用量和施用时间的增加整体上呈增加趋势;土壤理化指标随着微生物菌肥施用量和施用时间的增加呈现出不同的变化。

