神经旁浸润阳性胃癌患者的临床特征与预后分析
孙明明,钱雷敏,黄建明
(东南大学附属江阴市人民医院胃肠外科,江苏江阴214400)
根据2020年全球癌症负担数据,胃癌是世界范围内发病率排名第五、病死率排名第四的恶性肿瘤[1-2]。我国胃癌早期诊断率低,进展期占比大,导致胃癌5年生存率一直偏低,总体在35% 左右[3],这主要与进展期胃癌易复发、转移有关。TNM 分期一直是胃癌预后评估的重要参考依据,但临床实践发现越来越不能满足临床需求,例如相同TNM 分期的患者预后有时差异很大,或者不同分期的患者预后相似,这意味着除TNM 分期外,还存在影响胃癌预后的其他因素[4-5]。近年研究[6-7]发现,神经旁浸润(perineural invasion,PNI)可能是胃癌继淋巴转移、血行转移和腹腔种植转移之后另一种重要的转移扩散途径,这种嗜神经侵袭特性与预后密切相关。虽然PNI 是癌细胞局部外侵生长的生物学特性之一,但PNI 有可能是远处转移的第一站,并与进展期癌痛发生密切相关。研究还发现PNI 在不同TNM 分期的发生率不同,并未在IV 期癌组织中比例最高[7],PNI 对胃癌预后判断是否有影响尚存争议。已有部分研究者认为应该将PNI 纳入TNM 分期中[6,8],但缺乏大样本研究进行佐证。为此,本研究中心回顾性分析543 例胃癌根治术患者的临床病理资料,探讨PNI 对胃癌预后的影响,为提高胃癌预后综合判断能力提供参考价值。
1 资料与方法
1.1 一般资料
收集我院2011年6月—2016年12月期间胃腺癌患者的临床病理资料和手术切除石蜡标本543 例。纳入标准:⑴经病理确诊为胃腺癌的患者;⑵术前增强CT 排除远处转移;⑶实施标准的胃周淋巴结清扫术,且术后病理学诊断为切缘阴性。病例剔除标准:⑴术前及术中发现存在远处转移;⑵术后病理学诊断为切缘阳性;⑶术前接受过新辅助放化疗;⑷缺乏完整的临床资料。术后定期随访,随访截止日期为2018年12月31日。
1.2 治疗方法
手术方法:采用气管插管全身麻醉,手术方式均为开腹手术,手术者为同一人,根据肿瘤的部位实施根治性全胃切除术、根治性远端胃大部切除术或近端胃大部切除术。
术后辅助化疗:根据术后病理分期及随访复发情况实施以氟尿嘧啶(fluorouracil,5-FU)为基础的静脉化疗或口服化疗。
1.3 标本处理、染色及PNI结果判定
胃癌组织标本经10%福尔马林固定12~24 h,常规石蜡包埋、切片,厚4 μm。切片进行HE 常规染色和S-100 的免疫组织化学染色(ABC 法)。
PNI 结果判断:癌细胞沿神经纤维生长并包绕≥33%神经周径,或癌细胞侵犯3 层神经鞘的任何一层(包括神经外膜、神经束膜、神经内膜),即可确认为PNI (图1)。根据PNI 阳性或阴性进行分组。
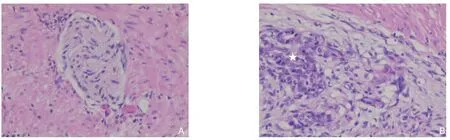
图1 PNI阴性和阳性HE染色(×200)Figure 1 PNI negative and positive HE staining(×200)
1.4 评价指标与定义
临床指标包括年龄、性别、血型、肿瘤大小、肿瘤部位、肿瘤方位、细胞分化程度、TNM 分期、是否存在脉管侵犯、手术切除范围、是否术后辅助化疗和Ki-67 阳性指数。
肿瘤大小取均值5 cm 为截点。肿瘤部位包括贲门胃底部、胃体部、胃角部、胃窦部及弥散型。肿瘤方位包括胃小弯侧、大弯侧、前壁、后壁及弥散型(≥2 个方位)。手术切除范围包括根治性全胃切除术、远端胃大部切除术和近端胃大部切除术。脉管侵犯指淋巴管或血管有癌细胞浸润或癌栓。Ki-67 阳性指数取均值60%为截点。
总生存时间(OS):自手术时间至末次随访时间或死亡时间,或随访数据库截至的时间(如失访、死于其他疾病等)。
1.5 统计学处理
所有数据采用SPSS 22.0 软件包进行处理和分析。除观察因素外,对生存分析有影响,且基本资料不平衡的可观察因素作为协变量,纳入二分类的Logistic回归模型中,产生0~1 间的匹配评分,匹配精度设置为0.1,以最小毗邻法进行匹配后,对胃癌患者进行亚组分析。可能与预后相关的基本资料变量是年龄、性别、血型、肿瘤大小、肿瘤部位、肿瘤方位、细胞分化程度、TNM 分期、脉管侵犯、手术切除范围、Ki-67 阳性指数和是否术后辅助化疗。采用χ2检验比较计数资料;采用Kaplan-Meier 法对匹配后胃癌患者生存时间进行分析,生存曲线差异使用Log-rank 检验,预后相关因素分析采用Cox 风险回归模型。采用双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 临床基本资料
全组543例胃癌患者中,PNI阳性者115例(21.18%)。与PNI 阴性组相比,PNI 阳性组的肿瘤直径大于5 cm的比例高,肿瘤主要位于贲门、胃底部,细胞分化程度集中在低分化、未分化或印戒细胞,大部分病例的TNM 分期处于III 期,合并脉管侵犯病例较多,全胃切除比例偏多,术后辅助化疗的病例较多,两组差异均有统计学意义(均P<0.05);但两组患者在年龄、性别、血型、肿瘤方位和Ki-67阳性指数等方面差异无统计学意义(均P>0.05)。以上13 个因素经倾向评分匹配后,PNI 阳性组胃癌患者65 例、PNI 阴性组98 例;两组间临床基本资料比较差异无统计学意义(均P>0.05),两组基本资料均衡,具有可比性(表1)。
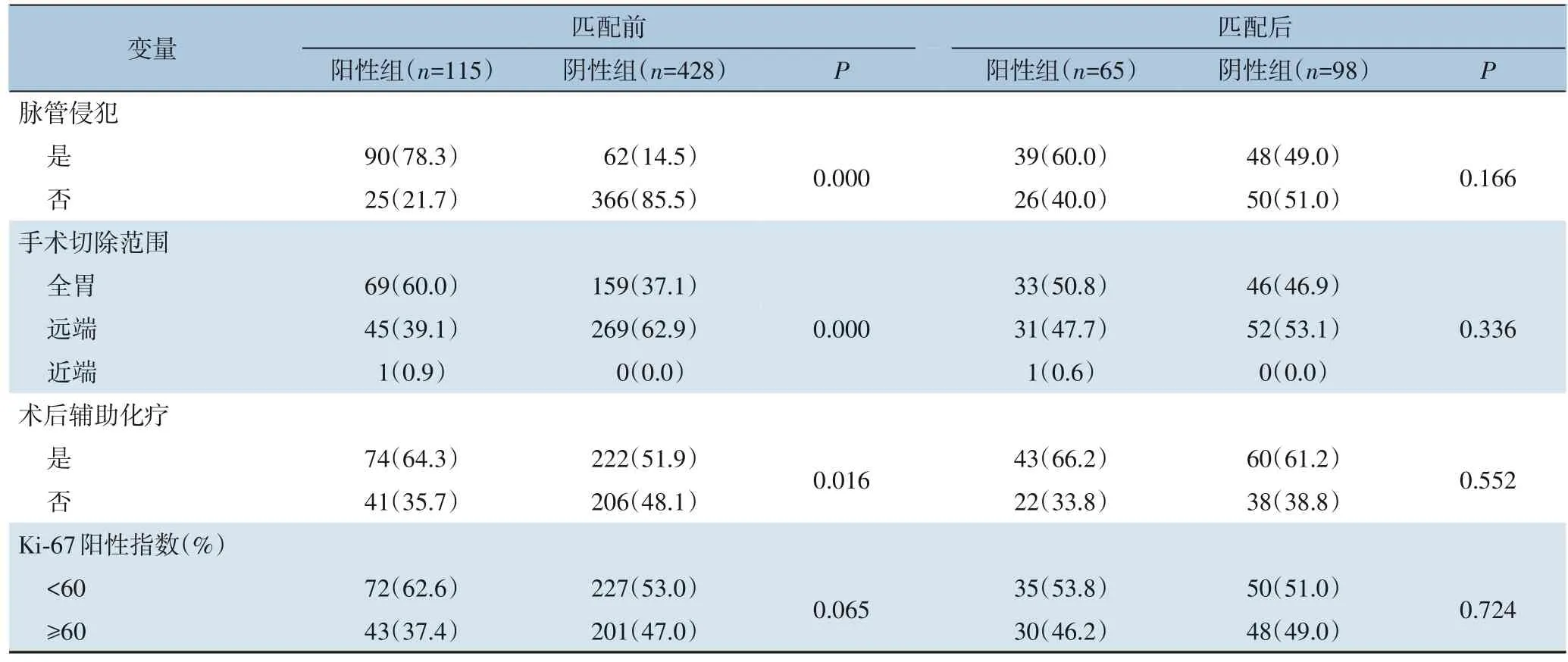
表1 倾向评分匹配前后两组临床基本资料的比较[n(%)](续)Table 1 Comparison of basic clinical data between the two groups before and after propensity score matching[n(%)](continued)

表1 倾向评分匹配前后两组临床基本资料的比较[n(%)]Table 1 Comparison of basic clinical data between the two groups before and after propensity score matching[n(%)]
2.2 生存时间比较
倾向评分匹配后163 例胃癌患者中位OS 为34 个月,PNI 阳性组胃癌患者的OS 明显低于PNI阴性组(中位OS:19 个月vs.49 个月,P=0.002)(图2A)。不同TNM 分期亚组分析提示:I、II 期PNI 阳性组胃癌患者的OS 与阴性组比较,差异无统计学意义(中位OS:40 个月vs.48 个月,P=0.432),III 期PNI 阳性组低于阴性组(中位OS:16 个月vs.37 个月,P=0.009)(图2B-C)。在PNI 阳性胃癌患者中,I、II 期接受术后辅助化疗者的OS 与未化疗者相比,差异无统计学意义(中位OS:30 个月vs.40 个月,P=0.975),III 期接受术后辅助化疗者的OS 明显高于未化疗者(中位OS:18 个月vs.2 个月,P<0.001)(图3A-B)。
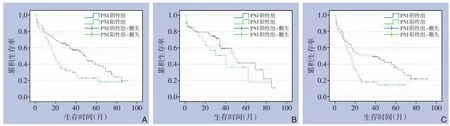
图2 倾向评分匹配后PNI阳性组与阴性组胃癌患者的OS曲线比较Figure 2 Comparison of OS curves of gastric cancer patients between PNI-positive group and negative group after propensity score matching
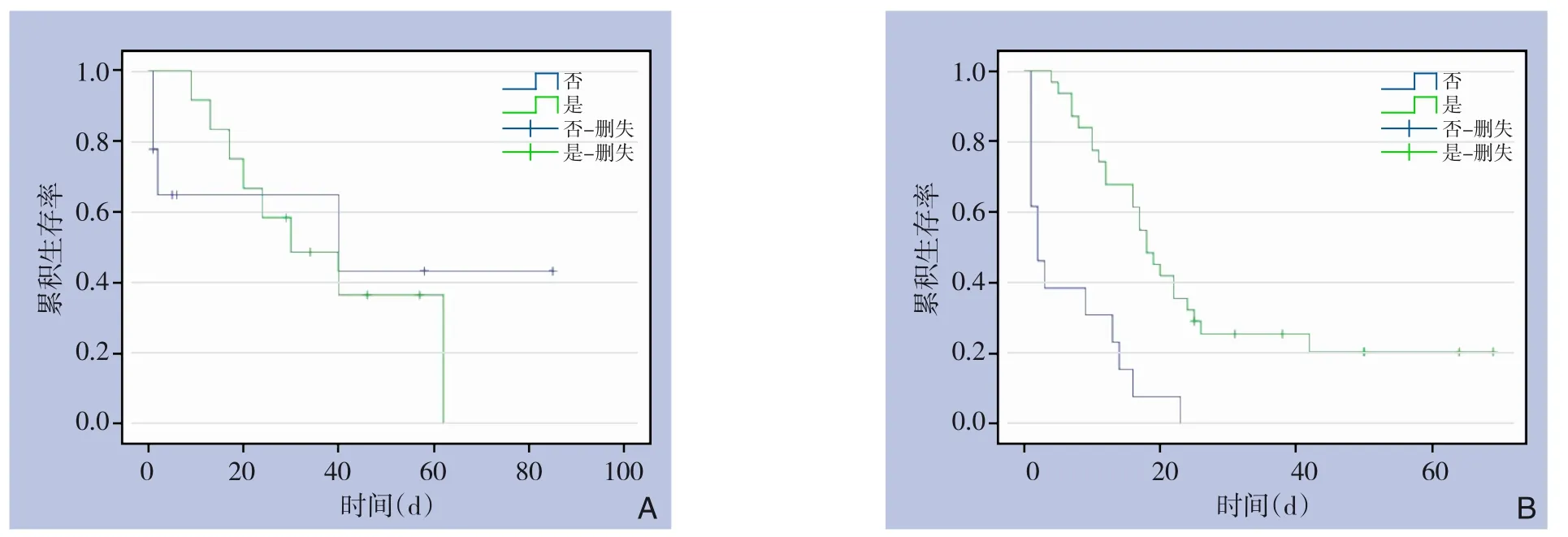
图3 倾向评分匹配后化疗与未化疗PNI阳性胃癌患者OS曲线的比较Figure 3 Comparison of OS curves of PNI-positive gastric cancer patients with and without chemotherapy after propensity score matching
2.3 PNI阳性胃癌术后预后分析
Cox 单因素分析提示年龄、TNM 分期和术后辅助化疗与PNI 阳性胃癌患者术后预后紧密相关(均P<0.05)。多因素分析发现TNM 分期处于III 期(HR=2.591,95%CI=1.291~5.198,P=0.007)、未进行术后辅助化疗(HR=0.345,95%CI=0.184~0.649,P=0.001)是影响PNI 阳性胃癌预后的独立危险因素(表2)。
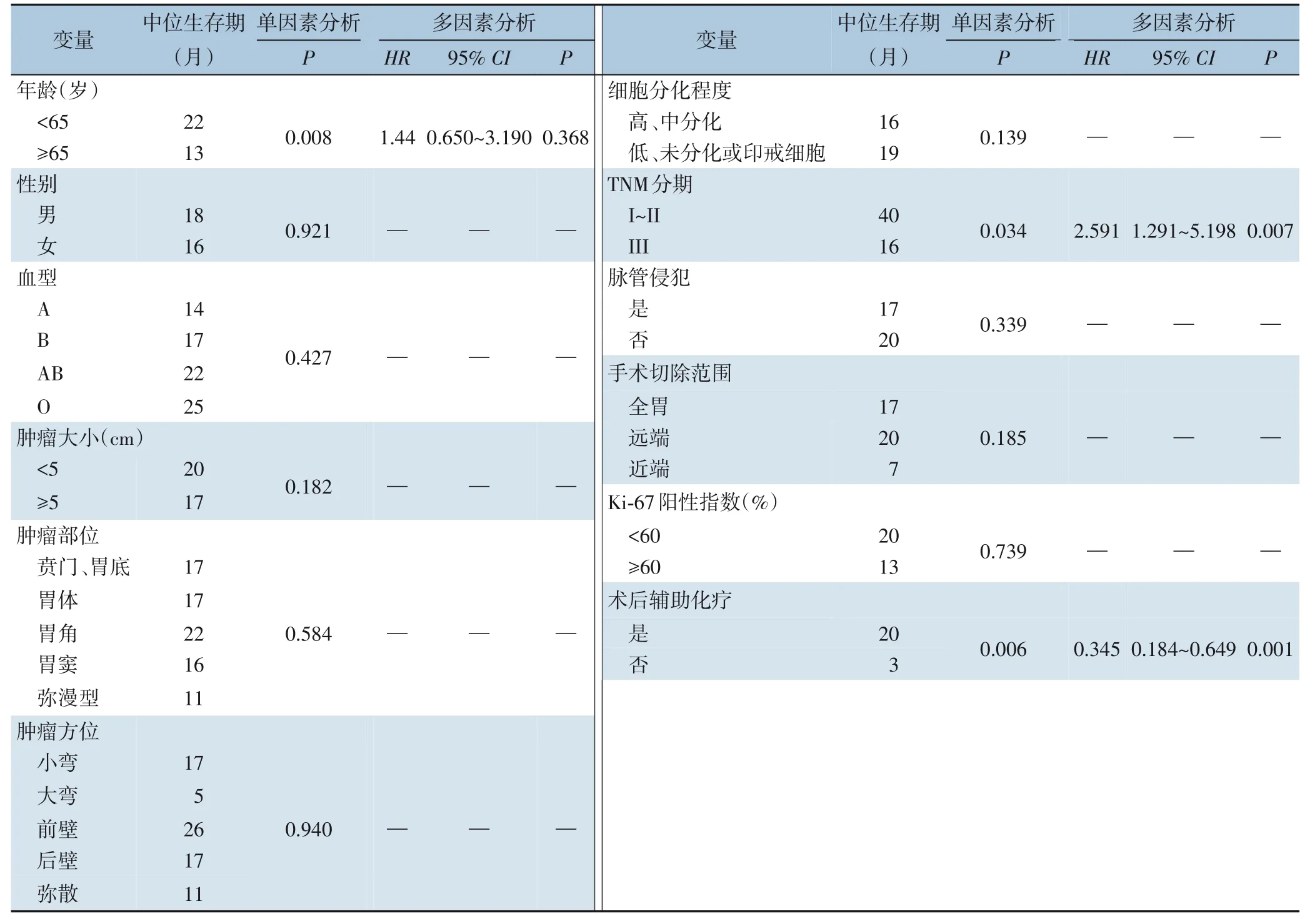
表2 匹配后影响65例PNI阳性胃癌患者预后的单因素和多因素分析Table 2 Univariate and multivariate analysis of the prognosis of 65 patients with PNI-positive gastric cancer after matching
3 讨 论
1985年前神经旁浸润(PNI)尚没有明确、统一的定义,Batsakis 等[9]在1985年提出PNI 的广义,即肿瘤细胞侵入、包绕或穿透神经纤维,具备这些特征就可称为PNI。直到2009年,Liebig 等[10]提出了较为准确的定义,认为PNI 是指肿瘤至少累及1/3 的神经周径,或者肿瘤细胞侵及神经鞘3 层(神经外膜、神经鞘膜和神经内膜)的任何一层,此标准沿用至今。以往关于PNI 的研究主要集中在头颈部鳞癌[11]、胰腺癌[12]、胆管癌[13]、宫颈癌[14]、前列腺癌[15]以及结直肠癌[16],大多是临床病例的回顾性研究,少部分是前瞻性研究或者体外细胞的基础研究。PNI 目前被认为是胃癌局部外侵转移方式之一,不仅仅发生在胃周神经丛,正如本研究图1B 所示还涉及胃壁内的神经纤维。PNI 和淋巴脉管浸润作为肿瘤局部侵袭性能力的代表,它们一起改变着肿瘤细胞生长的微环境,可见PNI 的发生与肿瘤微环境密切相关[17-19]。肿瘤微环境有肿瘤细胞、基质纤维细胞、血管内皮细胞、免疫细胞和神经纤维参与,目前尚无明确机制阐明。PNI 可能是一个动态互动过程,一方面神经细胞、免疫细胞、血管内皮细胞或基质细胞分泌生长因子、细胞因子、黏附因子或基质金属酶2/9 等促进肿瘤细胞增殖、黏附和迁移[20],另一方面肿瘤细胞促进神经轴突延长,肿瘤细胞不断沿神经纤维向远处迁移[21],这可能是胃癌细胞在胃壁中由内向外浸润(对应于TNM 分期中的T)的途径之一,或者向胃周腹腔神经丛播散(对应于TNM 分期中的M)的方式之一,似乎可与淋巴网络系统受侵无关。这种迁移模式已经在体内外实验得到部分证实。胃癌组织中癌相关成纤维细胞(cancer-associated fibroblasts,CAFs)的数量与胃癌TNM 分期、PNI 的发生率呈正相关[22]。在体外实验中,CAFs 与胃癌细胞共育,癌细胞的迁移性、侵袭性增加,研究者认为CAFs 是通过分泌IL-17a,激活了胃癌细胞中的JAK2/STAT3 信号通道,反之,利用IL-17a 抗体或JAK2 抑制剂可降低胃癌细胞的迁移性、侵袭性。
近几年PNI 在胃癌中的临床研究逐渐受到重视,但缺乏大样本研究,观察因素也参差不齐,使得PNI 在胃癌中的预后价值一直存在争议。一项最新Meta 分析研究报道胃癌的PNI 的发生率在6.9%~75.6%,总体胃癌PNI 发生率约为35%[23]。本研究胃癌PNI 发生率约为21%,低于目前研究的总体水平,这可能与研究样本数量、病理检测手段及诊断标准差异相关[6,23-24]。本研究结果显示随着肿瘤体积增大、位于近端胃、分化程度降低、TNM 分期增加、合并脉管侵犯,胃癌PNI 的发生率增高,这与大多数研究结果相似[6,25]。其他研究报道胃癌PNI 与性别、年龄、Lauren 分型弥散型、淋巴结转移数目增多相关[24,26]。本研究还发现PNI 在全胃标本中发现率高,可能与该组病例肿瘤主要位于胃上部有关。接受术后辅助化疗的PNI 阳性患者比例也较高,本研究认为该组病例的病期普遍较晚、癌细胞恶性高,根据胃癌NCCN 指南,患者接受化疗的依从性较高。目前预后相关研究观点认为,PNI 的发生与肿瘤患者的预后密切相关,但能否作为影响肿瘤预后的独立指标报道不一。早在1994年日本学者Tanaka 等[27]在著名杂志Cancer 上详细报道了PNI 与胃癌术后复发的关系,该研究共调查了283 例胃癌患者,PNI 阳性率达49.1%,在216 例根治手术患者中术后复发者103 例,其中65 例为PNI 阳性,占63.1%,而且PNI 阳性的胃癌患者的5年生存率明显低于PNI 阴性患者,多因素分析显示,PNI 显著影响胃癌预后。Bilici 等[28]对238 例行胃癌手术患者进行临床病理分析,PNI 阳性患者有180 例,高达75.6%。他们的研究还显示PNI 阳性组的中位生存期明显短于阴性组,同时认为PNI可以独立作为一个评估胃癌预后的重要指标。国内多个回顾性研究也得出类似的结论[29-30]。Deng等[31]的单中心研究虽然认为PNI 与肿块大小、分化程度、浸润深度、淋巴结转移及血管浸润等均有关,但Cox 多元回归分析却显示PNI 不能作为评估胃癌术后生存期的独立因素,然而通过Meta 分析综合了24 篇研究结果(共30 590 例胃癌患者),结果提示PNI 是影响根治性切除术后胃癌患者总生存的独立的预后因素。本研究多因素分析结果显示TNM 分期和术后辅助化疗是影响PNI 阳性胃癌预后的独立危险因素。PNI 阳性胃癌患者的生存期较短,尤其是III 期患者,而术后辅助化疗可以显著提高III 期患者的生存时间,但对I、II 期患者影响不大,这与国外部分研究结果一致。最近的一项中韩多中心研究项目结果提示,PNI 在预测III 期胃癌患者生存率时提供更多信息,被证明是III 期患者的独立预后因素[26],国内也有类似研究报道[7]。不过,既往研究表明术后TNM 分期处于II 期的胃癌患者进行辅助化疗可提高患者生存期,本研究未获得此结果,可能与本研究方案中纳入II 期的病例数量少有关。我们推测随着TNM 分期的增加,PNI 阳性胃癌患者易出现早期复发和远处转移,生存期自然缩短,而术后辅以5-FU 为基础的化疗可以使胃癌患者获益[19,32]。众所周知,低氧状态影响化疗反应中重要的信号,使肿瘤对化疗产生耐药性。ERO1A 是一种新的肿瘤缺氧相关的内源性标记物,Tao 等[19]研究发现PNI 阴性组肿瘤微环境ERO1A 的表达高于PNI 阳性组,PNI 阴性组同样发现Fu 耐药相关指标(TYMS mRNA 及其编码的蛋白胸苷酸合成酶)的上调。虽然PNI 是胃癌预后不良的指标,但可被辅助化疗所逆转,因此PNI 可用来预测辅助化疗的疗效,这类似于微卫星不稳定(MSI)的作用[33]。Woodham 等[34]研究发现PNI 在胃癌中的预后价值可与淋巴结受侵状态无关,它的临床价值可能高于淋巴脉管浸润。已有研究者提议应该将PNI 因素重点纳入TNM 分期中[6,8],尤其在没有淋巴结转移的情况[34]。
综上所述,PNI 是胃癌预后不良的重要因素,在TNM 分期为III 期中价值尤为重要,PNI 联合TNM 分期可提高胃癌预后评估的准确性,而PNI 可作为术后辅助化疗指征及疗效评价的参考指标。本研究属于回顾性分析,存在一定的局限性。虽然原始病例数较大,同时采用倾向评分匹配法克服选择偏倚,但匹配后的PNI 阳性病例数明显减少,说明原始基本资料存在较大的不均衡性。为了深入研究PNI 的临床价值,已有研究者运用基于CT 的纹理分析和列线图等方法在术前预测PNI 状态,达到优化胃癌患者的术前决策[35-36]。如何准确地评价PNI 在胃癌术后的预后价值和在以化疗为主的术后综合治疗中的疗效判断,尚需更大样本及前瞻性循证医学证据支持。

