柳江流域大型底栖动物群落结构及其与水质因子的关系
李 鑫, 邓培雁*, 刘 威
(1. 华南师范大学环境学院, 广州 510631; 2. 广州大学环境科学与工程学院, 广州 510405)
大型底栖动物是淡水生态系统的一个重要生态类群[1],处于河流生态系统食物链的中间环节,在传递能量和促进物质循环等方面具有重要作用[2]. 大型底栖动物对水质污染反应敏感而且准确,其群落结构可对生态环境的恶化或改善作出迅速响应,反映短期环境变化的影响[3]. 因此,探讨大型底栖动物群落结构与水体环境因子之间的相互关系一直都是淡水生态研究的热点[4]. 目前,我国淮河[5]、太湖[6]、北江[7]等流域相继开展了相关研究,但针对亚热带区域的柳江流域的此类研究较少.
基于以上原因,本文以珠江流域的柳江流域为研究区域,分别于枯水期和丰水期设置了23个采样点位,结合无偏对应分析 ( Detrended Correspondence Analysis,DCA)、双向指示种分析[8](Two-way Indicator Species Analysis,TWINSPAN) 和指示物种分析[9](Indicator Species Analysis,ISA)等方法研究了柳江流域大型底栖动物群落结构的时空变化特征,并运用典范对应分析法 (Canonical Correspondence Analysis,CCA)探究了影响大型底栖动物群落分布的主要水质驱动因子,以期为柳江流域水域生态学的研究提供基础资料.
1 研究方法
1.1 采样点概况
柳江发源于贵州省独山县,流经黔东南及桂北,于广西象州县注入西江干流黔江段,是珠江水系西江干流第二大支流. 柳江流域面积5.717 3万km2,干流全长773.3 km,分为上游都柳江、中游融江和下游柳江,流域年均温18~20 ℃,年降水量1 400~1 800 mm, 4~8月为汛期,占全年径流总量的80%,12月至翌年3月为枯水期. 柳江地势西北高东南低,水系呈树枝状,上游河道滩多流急,中、下游水势平缓,河曲较发育,大部分属喀斯特地貌,沿河阶地、丘陵广布,最大支流龙江从贵州省三都县至广西省柳城县注入柳江,其支流包括打狗河、大环江、小环江等. 柳江上游森林植被覆盖度高,泥沙含量低,中下游流经广西最大的工业城市——柳州市,该地区电镀、冶金产业发达,是广西“三废”排放的重点城市,其每年排入柳江的工业废水达4 365万t,是柳江水体的主要重金属污染源[10]. 本研究结合柳江各河段的地形地貌及污染源分布情况共设23个采样点(S1~S23),各样点的地理位置信息如表1所示,地理分布如图1所示.
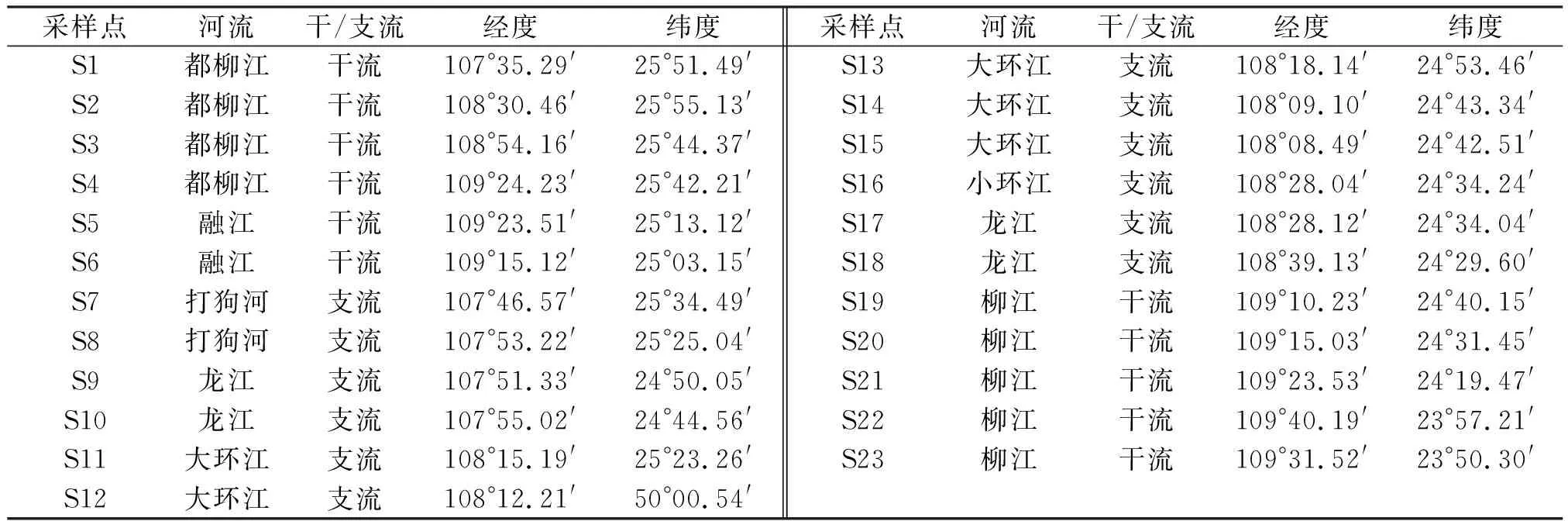
表1 柳江流域采样点地理位置分布表Table 1 The locations of sampling sites in the Liujiang River basin
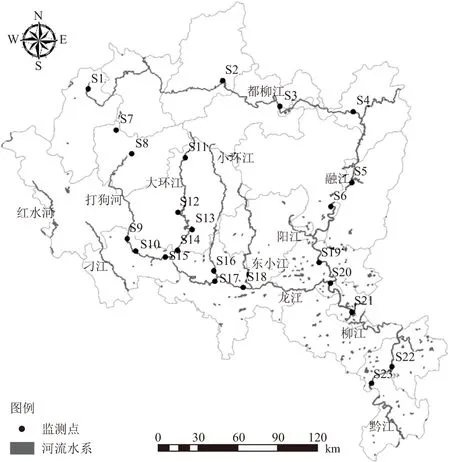
图1 柳江采样点分布图
1.2 样品采集与分析
采样于2019年3月(枯水期)和6月(丰水期)进行. 参照国际通用采样方法,在各采样点水深小于1.5 m、长度100 m的采样区域内,选用直径0.3 m、孔径500 μm的D型拖网逆水流方向采集3个平行样本. 将采集到的泥样经300 μm孔径筛网滤洗后置于白色解剖盘中进行挑拣,挑拣出的底栖动物转入广口瓶中加70%酒精固定保存,在实验室进行分类计数[11],样品鉴定至属或种[12].
1.3 水质指标测定
现场使用便携式水质分析仪(YSI)测定溶解氧(DO),同时将水样低温保存带回实验室测定高锰酸盐指数(CODMn),氨氮(NH3-N)、砷(As)、汞(Hg)、镉(Cd)、铅(Pb)的质量浓度. 测定方法参照《水和废水监测分析方法(第四版)》[13].
1.4 数据处理与分析
(1)Czekanowsiki相似系数(Sc)计算公式为[14]:
Sc=2C/(A+B)×100%,
(1)
式中,A、B分别为枯、丰水期水体中的底栖动物种类数,C为2个水期水体中共有的种类数.
(2)优势度(Y)的计算公式为[15]:
Y=Pi×fi,
(2)
式中,Pi代表大型底栖动物物种i的个体数ni占所有大型底栖动物总个体数N的比例,即Pi=ni/N,fi为大型底栖动物物种i的出现频率.
(3)TWINSPAN和DCA分析. 选取大型底栖动物中相对丰度大于5%的物种,利用TWINSPAN和DCA分析划分柳江流域枯、丰水期主要底栖动物群落类型,并通过物种指示值法(ISA)筛选出不同群落具有显著指示值(IndVals)的物种.
(4)CCA分析. 以样方-水质因子矩阵和样方-底栖动物相对丰度矩阵为基础,采用典范对应分析(CCA)研究底栖动物群落与水质因子之间的相互关系. 因水质指标存在不一致的数量级和量纲,分析前需将所有水质数据进行log(X+1)转化[16].
(5)数据分析软件 TWINSPAN分析采用PC-ORD5.0完成,各物种的IndVal值利用R语言统计软件中的indicspecies程序包进行计算,DCA和CCA排序分析均使用CANOCO5.0,水质因子Mann-Whitney U检验采用SPSS24.0软件完成.
2 结果与分析
2.1 底栖动物群落组成
2次调查共采集到底栖动物4门7纲16目54科68属(种),分别隶属于扁形动物门的涡虫纲、环节动物门的蛭纲和寡毛纲、软体动物门的腹足纲和瓣鳃纲以及节肢动物门的昆虫纲和甲壳纲. 其中,水生昆虫共46种,占物种总数的67.65%;软体动物共15种,占物种总数的22.06%;其他共7种,占物种总数的10.29%. 水生昆虫和软体动物是构成柳江流域底栖动物群落的主要类群. 枯水期共采集到底栖动物955只,其中,S11样点采集到的底栖动物数量最多(图2),达到282只,最少的是S19样点,仅有2只. 丰水期共采集到底栖动物956只,S1样点数量达到367只,最少的是S9、S10、S18、S20样点,因季节原因未采集到底栖动物. 枯、丰水期采集到的底栖动物种数分别为62种和55种,种类相似系数为83.76%. 枯水期各样点底栖动物丰富度(群落中物种数目的多少)变化范围为1~33 种,平均值为7种,丰水期各样点底栖动物丰富度变化范围为0~36种,平均值为5种(图3),物种丰富度在水文季节变化上表现为枯水期略高于丰水期.
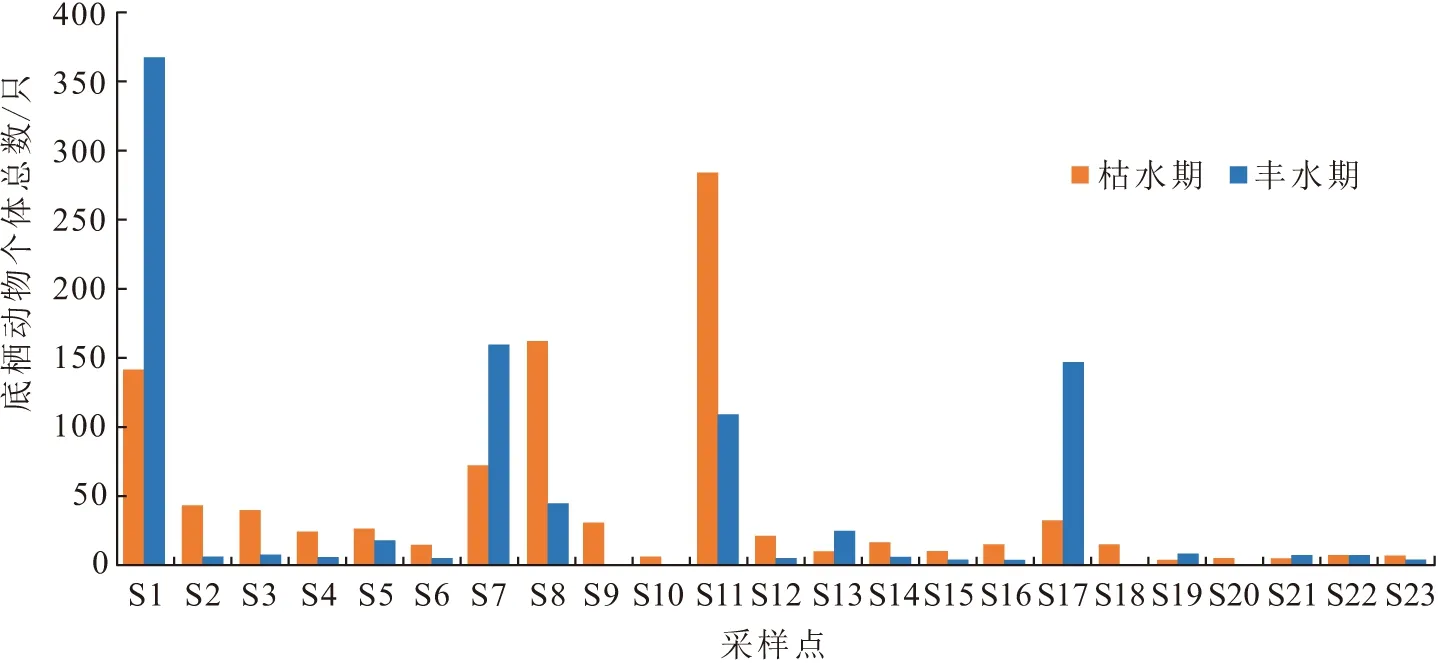
图2 柳江各样点底栖动物个体总数分布图
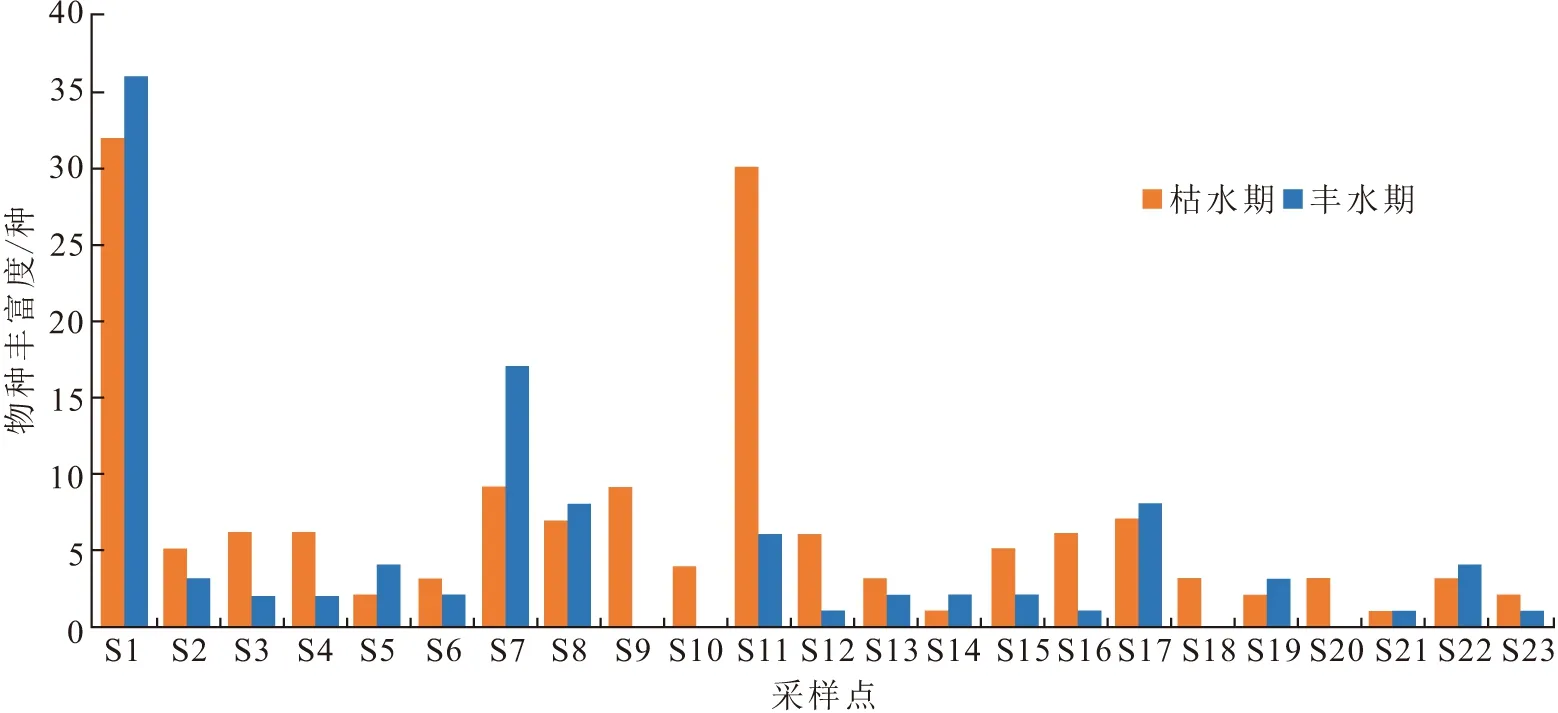
图3 柳江各样点底栖动物物种丰富度分布图
2.2 底栖动物优势种
优势度的统计结果如表2所示,2次调查发现柳江流域共有5种底栖动物优势种,其中枯水期有4种,丰水期有2种,优势度指数为 0.022~0.066. 小划蝽属(Micronecta)为枯、丰水期共有优势种,而萝卜螺属(Radix)、摇蚊属(Chironomus)和囊螺属(Physa)仅在枯水期为优势种,新米虾属(Neocaridina)仅在丰水期为优势种.
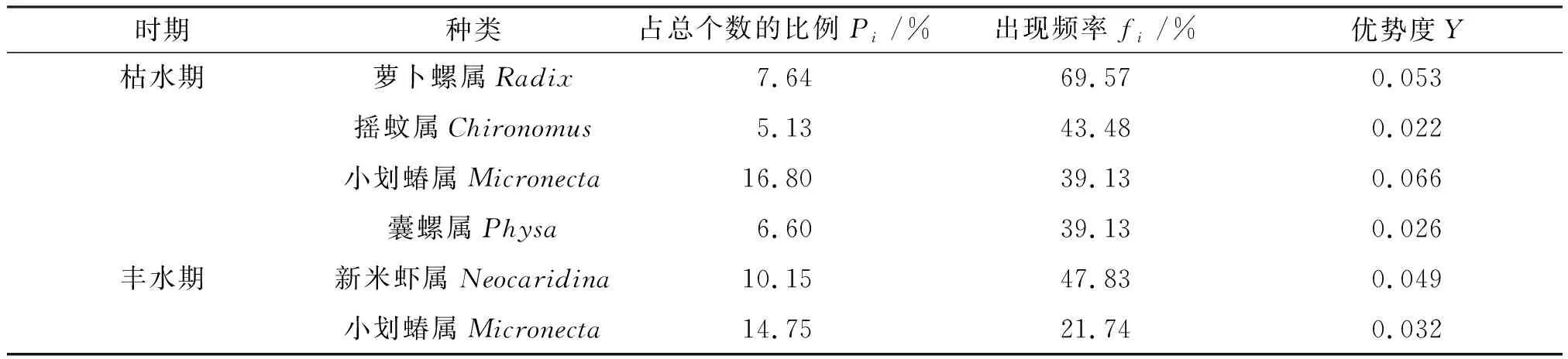
表2 柳江流域大型底栖无脊椎动物优势种组成(Y≥0.02)Table 2 The composition of dominant macrobenthos species in the Liujiang River basin(Y≥0.02)
2.3 底栖动物群落时空分布特征
利用TWINSPAN对柳江流域枯、丰水期采样点位的大型底栖动物进行聚类分析,并结合DCA分析确定柳江流域底栖动物主要群落分布类型,结果如表3所示. 根据底栖动物群落结构特征的相似性,枯水期的23个样点被划分为3个底栖动物类群,类群A1包含8个点位,主要在分布柳江下游、大环江中下游和打狗河段;类群A2包含13个点位,主要分布在柳江中上游及支流龙江、小环江河段;类群A3包含2个点位,主要分布在柳江源头和大环江上游. 丰水期19个样点也被划分为3个类群,类群B1包含9个点位,主要分布在柳江下游及支流大环江河段;类群B2包含7个点位,主要分布在柳江中上游;类群B3包含3个点位,主要分布在柳江源头和打狗河段,由于丰水期S9、S10、S18、S20样点未采集到底栖动物,故未对其进行计算. 枯、丰水期大型底栖动物采样点在DCA轴上的分布如图4所示.
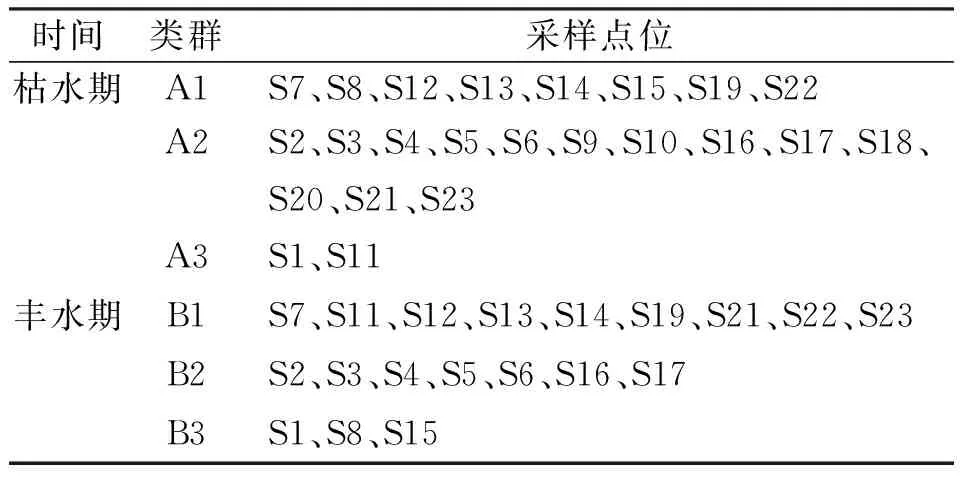
表3 柳江流域大型底栖动物主要群落分布类型
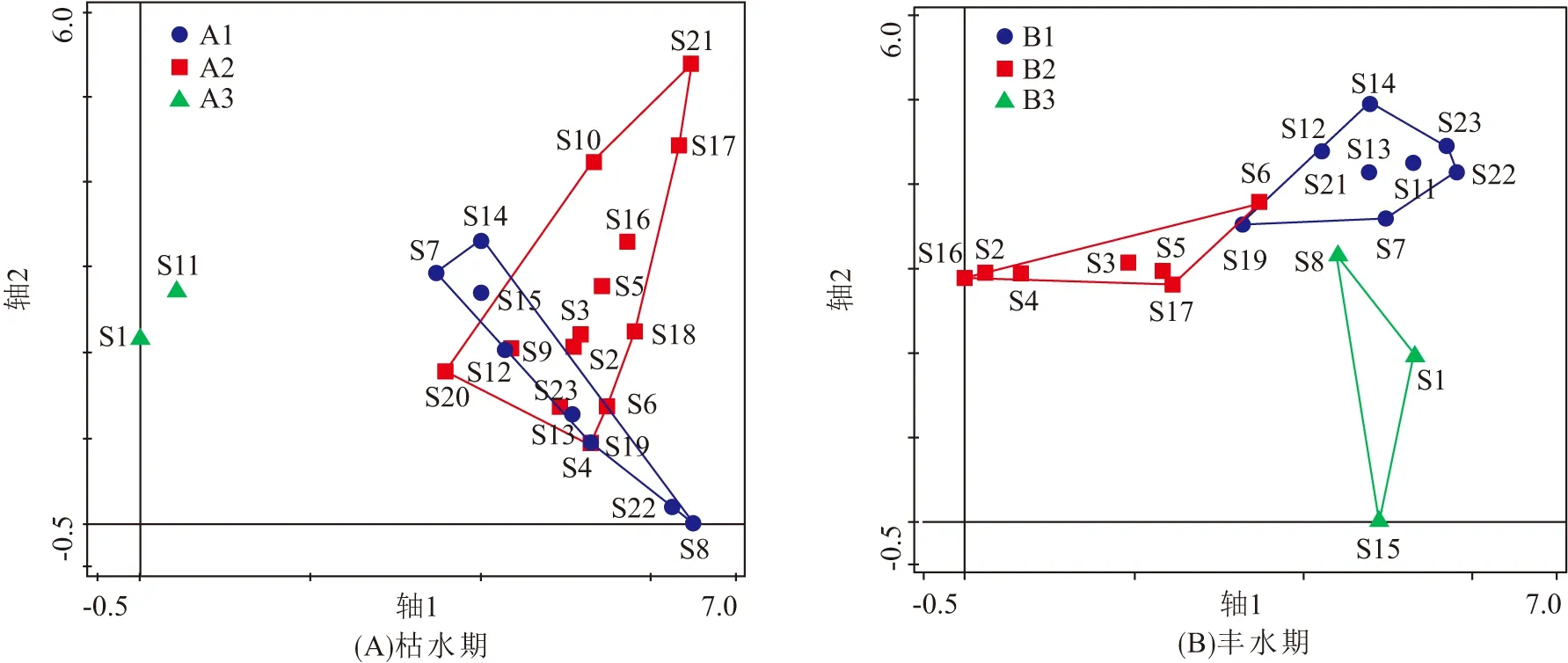
图4 柳江流域大型底栖动物采样点在DCA轴上的分布
2.4 底栖动物群落指示物种分析
利用R语言分别对枯、丰水期底栖动物类群进行指示物种分析,以P<0.05为标准筛选出不同类群的指示种[17]. 如表4 所示,枯水期共有8种底栖动物能作为类群A3的指示种,其中,四节蜉属(Baetissp.)、锯形蜉(Serratellasp.)和溪泥甲一属(Zaitzeviasp.)的指示值均为1.000,表明这3种物种仅出现在A3组所包含的全部样点中,类群A1和A2无显著指示种. 丰水期共有5种底栖动物能作为底栖动物群落划分的指示种,其中,方格短沟蜷(Semisulcospiracancellata)和钉螺(Oncomelaniasp.)是类群B2的指示种,汉森安春蜓(Amphigomphushansoni)、河蚬(Corbiculafluminea)、卷扁螺(Gyrauluscompressus)是类群B3的指示种,类群B1无显著指示种.
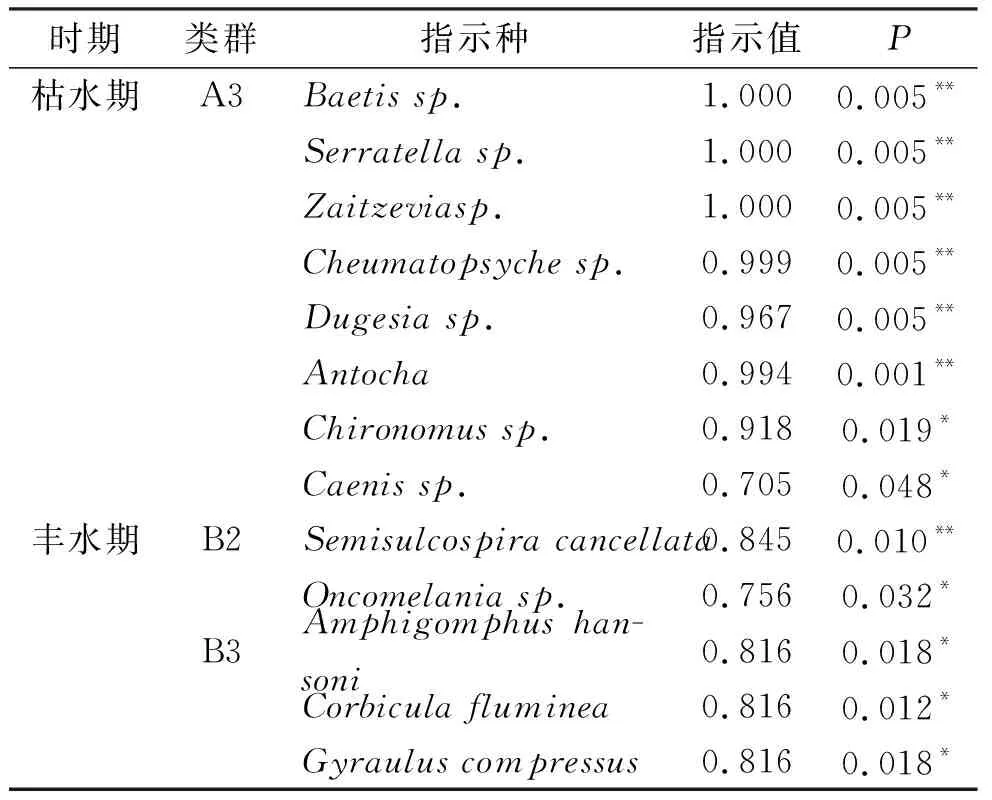
表4 柳江大型底栖动物群落划分及指示物种分析
2.5 水质因子特征分析
对柳江流域的水质理化因子进行比较分析,结果如表5所示,DO的质量浓度在枯、丰水期随着类群A1、A2、A3 和B1、B2、B3在空间分布上的变化呈现逐渐上升趋势,而其他水质指标则呈波动下降趋势.Mann-Whitney U检验结果表明,除As的质量浓度以外,其他水质因子(DO、CODMn、NH3-N、Hg、Cd、Pb)的质量浓度在枯、丰水期之间均存在显著差异(P<0.05),且在丰水期的平均值均高于枯水期.
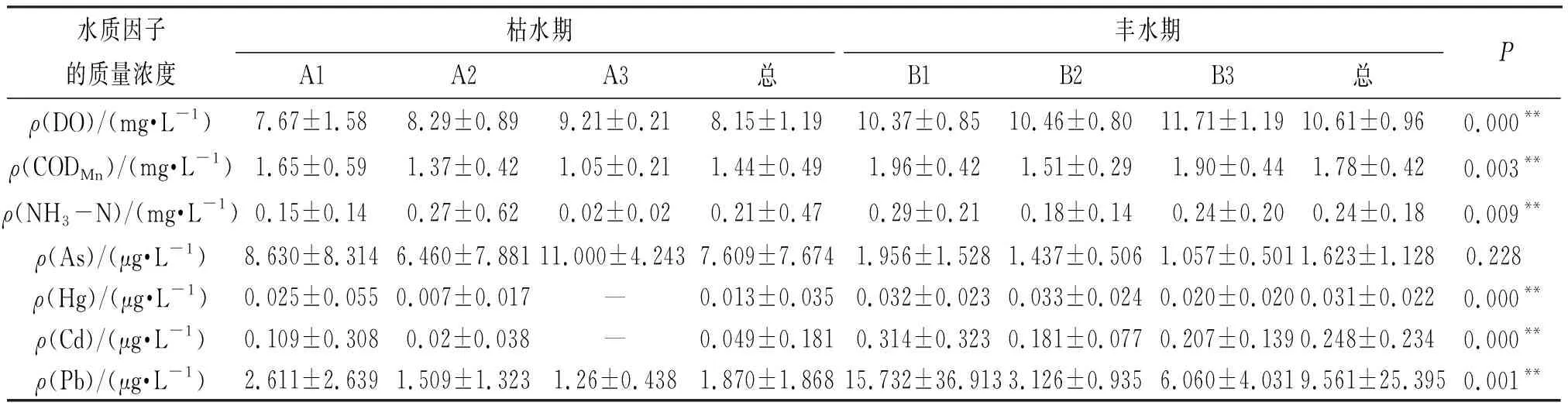
表5 柳江流域水质理化因子特征(平均值±标准差)Table 5 The characteristics of water quality factors in the Liujiang River basin(Mean±SD)
2.6 大型底栖动物与水质因子的关系
DCA分析结果显示,枯、丰水期得到的4个排序轴中的梯度长度最大值分别为6.50和5.83,均大于4.0,故应采用单峰模型的典范对应分析法(CCA)来研究水质因子对柳江流域大型底栖动物的影响. 从表6可以看出,枯、丰水期CCA排序的前两轴共解释了底栖动物群落变异的45.9%和55.6%,说明CCA排序能较好地反映枯、丰水期底栖动物群落分布与水质因子之间的相关关系.
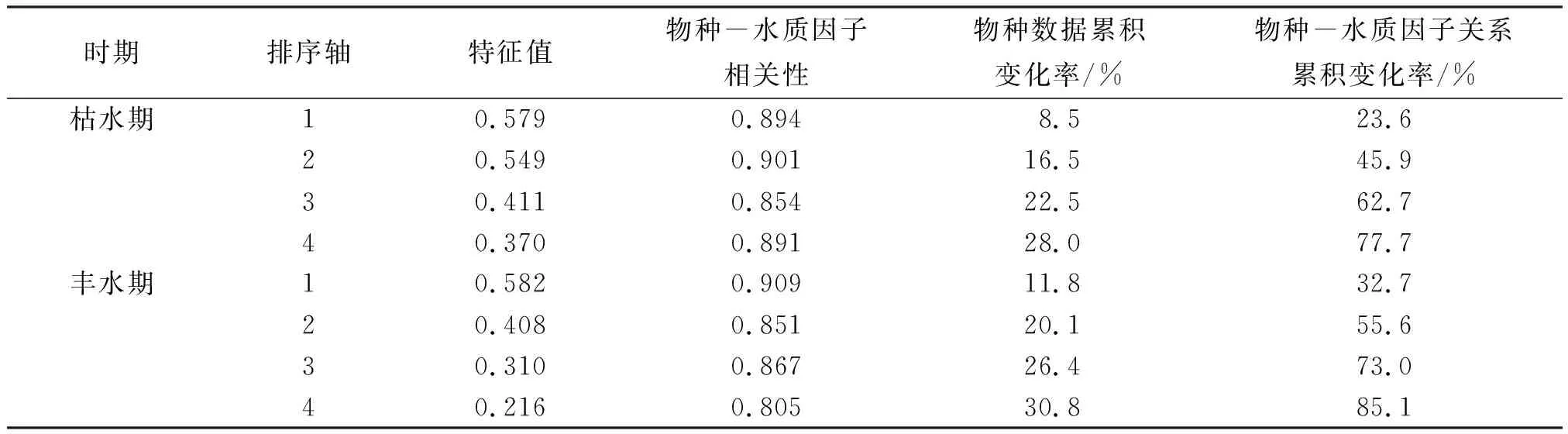
表6 CCA排序轴对应的特征值、物种-水质因子相关性及累积变化率Table 6 The Eigenvalues, species-environment correlation and changing percentages for CCA axis
如表7所示,在枯水期,轴1与DO呈最大负相关;轴2与CODMn呈最大正相关,与Hg、Cd和Pb呈较强正相关. 在丰水期,轴1与CODMn呈最大负相关,与DO呈较强负相关,轴2与DO呈最大负相关,与NH3-N呈最大正相关. 由此可见,枯水期影响柳江大型底栖动物物种分布的主要水质驱动因子为DO、CODMn、Hg、Cd和Pb,丰水期则为CODMn、DO和NH3-N.
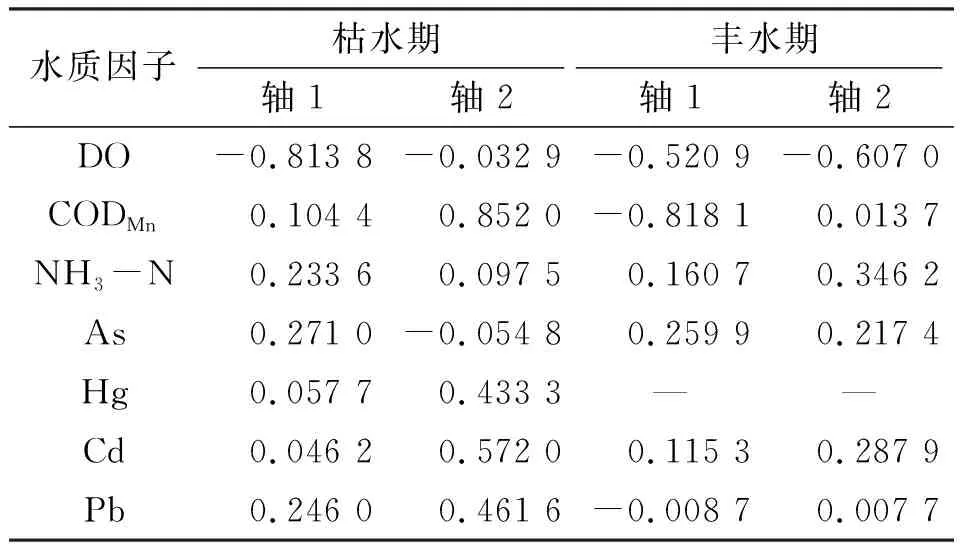
表7 CCA前 2 轴与水质因子相关系数
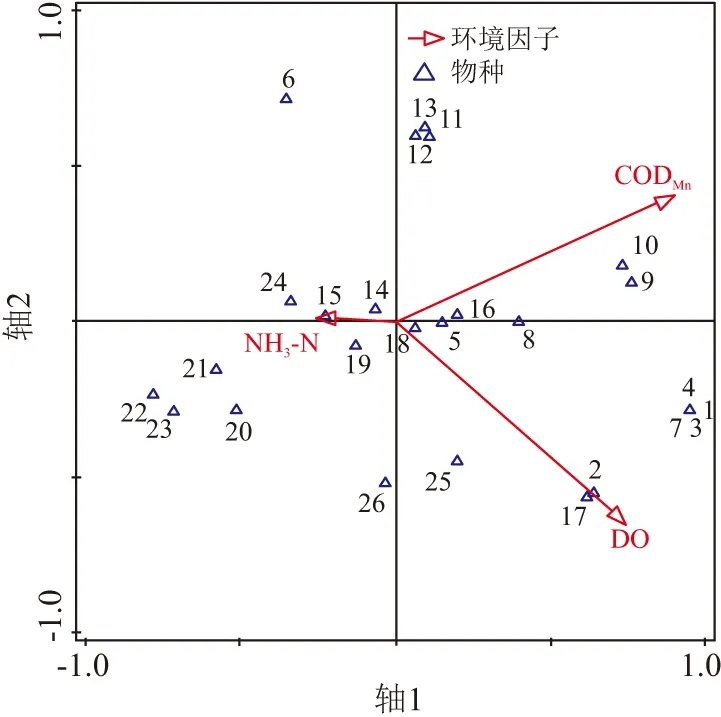
以主要水质驱动因子为环境变量进一步进行CCA分析,图5反映了柳江枯水期时31种主要大型底栖动物与水质因子之间的响应关系,由排序图可知,轴1主要反映的是溶解氧质量浓度的变化情况,沿轴1从左至右,依次分布有四节蜉属(Baetissp.)、蜗虫(Dugesiasp.)、摇蚊属(Chironomussp.) 、河蚬(Corbiculafluminea)等,底栖动物种类由喜好高氧环境的物种逐渐过渡到喜好低氧的物种;轴2反映的是CODMn和重金属(Cd、Pb、Hg)质量浓度的变化情况,沿轴2从上至下,依次分布有扁蛭属(Glossiphoniasp.)、划蝽属(Micronecta)、短沟蜷属(Semisulcospirasp.)等,底栖动物种类对水体重金属(Cd、Pb、Hg)和有机污染的耐受能力逐渐降低. 图6反映了柳江丰水期时26种主要大型底栖动物对水质因子变化的响应,其物种分布与水质驱动因子的对应关系趋势与枯水期表现基本一致.
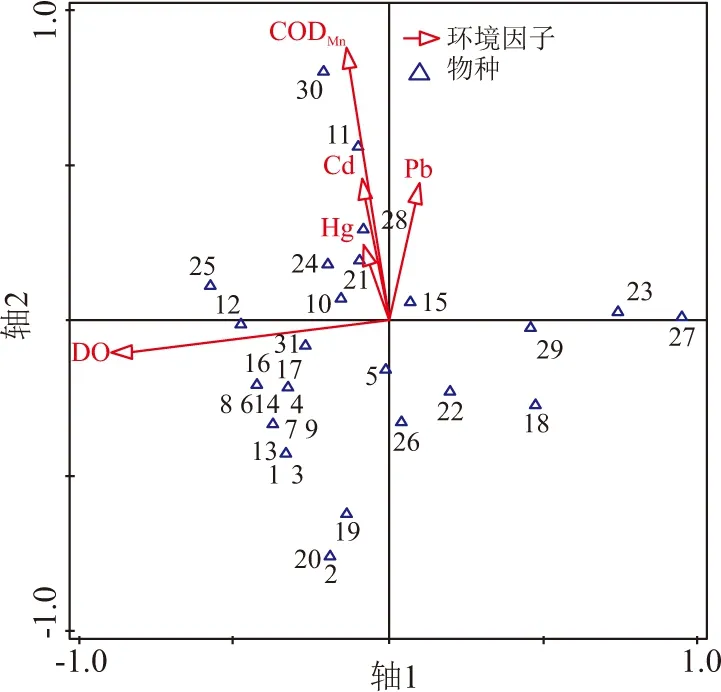
1:Cheumatopsyche sp.;2: Macromidae;3:Antocha;4:Simulium sp.;5:Chironomus sp.;6:Epeorus sp.;7:Choroterpes sp.;8:Baetis sp.;9:Afronurus rubromaculata;10:Labiobaetis ancoralis;11:Labiobaetis atrebatinus orientalis ;12:Procloeon sp.;13:Caenis sp.;14:Serratella sp.;15:Micronecta;16:Zaitzevia sp.;17:Protohermes sp.;18:Sulcospira cf hainanensis;19:Sinotaia sp.;20:Stenothyra sp.;21:Radix sp.;22:Semisulcospira sp.;23:Tarebia granifera ;24:Physa sp.;25:Galba sp.;26:Limnoperna lacustris;27:Macrobrachium sp.;28:caridina sp.;29:Corbicula fluminea;30:Glossiphonia sp.;31:Dugesia sp.
1:Cheumatopsyche sp2;2: Amphigomphus hansoni;3:Leptogomphus intermedius;4: Baetis sp.;5:Labiobaetis ancoralis;6:Labiobaetis atrebatinus orientalis;7:Habrophlebiodes gilliesi;8:Ordobrevia sp.;9:Bezzia sp.;10:Culex sp.;11:Chironomussp.;12:Micronecta sp.;13:Micronecta quadristrigata;14:Neocaridina serrata;15:Corbicula fluminea;16:Galba pervia;17:Gyraulus compressus;18:Sinotaia sp.;19:Bellamya sp.;20:Physa acuta;21:Semisulcospira cancellata;22:Melanodies sp.;23:Tarebia granifera;24:Oncomelania sp.;25:Radix auricularia;26:Radix swinhoei.
3 讨论
3.1 大型底栖动物群落结构及水质因子特征分析
柳江流域大型底栖动物群落组成以水生昆虫和软体动物为主,枯水期优势种为萝卜螺属(Radix)、摇蚊属(Chironomus)、小划蝽属(Micronecta)和囊螺属(Physa),丰水期优势种为新米虾属(Neocaridina)和小划蝽属(Micronecta),优势种群随水文季节变化呈现明显的更替状态且多以耐污种为主,物种丰富度整体水平较低,说明柳江流域大部分样点已受到不同程度的污染. 程谦伟等[18]曾以底栖动物为指示种对柳江市区段进行了水质生态评价,他们在下游4个断面共采集到底栖动物15种,优势种主要有梨形环棱螺(Bellamyapurificata) 、霍甫水丝蚓(Limnodrilushoffmeisteri)、苏氏尾鳃蚓(Branchiurasowerbyi)等,评价结果显示当时柳江下游已经受到了一定程度的污染,并对底栖动物的群落结构造成了影响. 相比之下,本次研究在柳江市区段(样点S19~S21)仅采集到5种底栖动物,分别是划蝽属(Micronecta)、米虾属(caridinasp.)、萝卜螺属(Radixsp.)、蜗虫(Dugesiasp.)和淡水壳菜(Limnopernalacustris),物种多样性水平大大降低,耐污种比例增加,这表明柳江下游水质呈现不断恶化趋势.
水质因子分析结果表明,柳江枯、丰水期的水质从源头、中上游至下游逐渐变差,这与流域内底栖动物的群落分布呈现较为一致的关系. 对比枯、丰水期TWINSPAN和指示物种分析结果发现,柳江流域底栖动物的群落结构存在明显的时空分布差异. 从空间上看,枯、丰水期均有3个不同的底栖动物类群,依次分布在该流域干流及支流的源头、中上游及下游,群落内指示物种也呈现出由清洁种逐渐过渡到耐污种的变化,如四节蜉属(Baetissp.)、锯形蜉(Serratellasp.)等敏感种主要分布在柳江上游站点,而划蝽属(Micronecta)、沼虾(Macrobrachiumsp.)、河蚬 (Corbiculafluminea)等耐污类群主要分布在柳江下游站点,3个底栖动物类群的空间变化体现了柳江流域内水质因子的梯度变化. 从时间上看,柳江流域不同样点的底栖动物群落结构也发生了明显的季节演替,典型代表如样点S11,枯水期该样点底栖动物优势类群以蜗虫(Dugesiasp.)、朝大蚊属(Antocha)等敏感种为主,耐污种分布极少,进入丰水期,该样点优势类群以四纹小划蝽(Micronectaquadristrigata)等耐污种为主,而样点S9、S10、S18、S20进入丰水期后均未见有底栖动物分布,这可能是因为丰水期降雨增多,地表径流增加使有机物等陆源性物质被冲刷汇入河流,水体水质变差,无法满足底栖动物繁殖、生存的要求. 同时,河流水量突增对底栖动物群落的稳定性也可能造成一定影响.不同样点底栖动物优势种的季节演替,体现了这些物种对水质变化的响应,说明了底栖动物群落物种组成与水化学变量和水文季节的变化有较密切的关系.
3.2 水质因子对底栖动物群落的影响
CCA分析结果表明:影响柳江流域底栖动物群落分布的主要水质驱动因子在不同季节存在一定差异. DO和CODMn是2次采样中均对底栖动物群落分布有重要影响的环境因子,这与许多学者在其他区域的研究结果相似. BUSS 等[19]研究了巴西东南地区河流的水质因子对大型底栖动物的影响,结果表明DO与大型底栖动物分布有非常密切的关系. 姚凯胜等[20]研究流溪河底栖动物群落结构及其影响因素时,认为DO是影响底栖动物群落分布的主要环境因子. 众多研究表明:水体中DO质量浓度的高低影响着底栖动物群落结构和物种分布,特别是在质量浓度低的情况下,成为重要的限制因子[21].
不同底栖动物物种对水体中重金属的敏感程度和耐受能力不同[22], 在本研究中,枯水期底栖动物分布受水体重金属(Hg、Cd和Pb)的影响较大,这可能是因为柳江下游是柳州和河地地区重要的有色金属矿区[23],矿业开采和有色冶炼加重了水土流失,从而导致水体中重金属质量浓度增加,对生活于水生生态系统底层的底栖动物造成极大影响. NH3-N作为衡量水体富营养化程度的一个重要指标,在本研究中也显著影响着丰水期大型底栖动物的分布. 研究[24-25]表明,当水体中N、P 等营养盐达到一定程度时,会促使藻类大量繁殖,导致水体缺氧,水质恶化,许多敏感种消失,而一些个体小的耐污种(如摇蚊幼虫和寡毛类)的生物量则会迅速增多. DURAN 等[26]利用底栖动物在对土耳其某个河流进行水质评价时发现,夏季河流下游段因含有较高的磷酸盐和氮离子,致使底栖动物的丰度偏低. 张莹等[27]在研究山东半岛南部海湾底栖动物与环境因子关系时发现,当水体中营养盐物质增加时,大型底栖动物的多样性则相应降低. 由于本研究中涉及到的水质因子有限,尚有近50%的底栖动物群落变异部分未能得到相应解释. 在今后的研究中,其他环境因素如水温、pH、海拔、栖境等均可作为影响大型底栖动物群落结构的因素而加以考虑.

