不同光照和水分对吊罗山薹草生长的影响
杨虎彪 林鹏 刘国道
摘 要:为掌握吊罗山薹草在生境适宜性中对光照及水分的需求特性,采用人工控制光照强度和土壤含水量的方法(设置4个光照和3个水分水平的双因素实验),研究光照强度和土壤含水量对其生长的影响。结果表明,低水分条件抑制吊罗山薹草的生长,但40%(L3)光照和30%(W3)水分的互作下各项指标表现相对较好,说明适当的遮荫有助于减少水分亏缺对其造成的伤害;全光照(L1)条件下的净光合速率(Pn)显著降低,丙二醛(MDA)含量显著上升,生长受到抑制,而40%(L3)光照条件下,Pn值在不同水分条件下均出现最高值;在水分充足的条件下,40%(L3)光照和10%(L4)光照处理下的叶绿素含量和净光合速率之间不存在显著差异,但与全光照(L1)和70%(L2)光照条件下的差异显著,说明吊罗山薹草对高光敏感。综上,吊罗山薹草在生境选择上不适宜低郁闭度和低水分,40%光照和70%土壤水分是其最佳生长环境。
关键词:吊罗山薹草;光照强度;土壤水分;生长特性;生理特性
中图分类号:Q949.71+4.3 文献标识码:A
Effect of Light Intensity and Water Content on the Seedling Growth and Physiological Characteristics of Carex diaoluoshanica
YANG Hubiao1, LIN Peng LIU Guodao
1. Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, China; 2. College of Agro-grassland Sciences, Nanjing Agriculture University, Nanjing, Jiangsu 210095, China
Abstract: In order to explore the characteristics of the demand for light and soil moisture of Carex diaoluoshanica, the effects of light intensity and soil moisture on its growth were studied by controlling light intensity and soil moisture content. Low water content seriously inhibited the growth of C. diaoluoshanica, but the interaction of 40% light and 30% water showed relatively good performance, indicating that appropriate shading could reduce the damage caused by water deficit. Under the condition of full light, the net photosynthetic rate (Pn) decreased significantly, while the malondialdehyde (MDA) content increased significantly, and the growth was inhibited. The highest Pn occurred under 40% light intensity. Under the condition of sufficient water, there was no significant difference in chlorophyll content and net photosynthetic rate between 40% and 10% light treatments, but there were significant differences between them under full light and 70% light conditions, which fully indicated that C. diaoluoshanica was sensitive to high light and was not conducive to its growth. In conclusion, it is not suitable for low caopy density and low water content in the habitat selection for C. diaoluoshanica, and 40% light intensity and 70% soil moisture are the best environment for its growth.
Keywords: Carex diaoluoshanica; light intensity; soil moisture; growth characteristics; physiological characteristics
DOI: 10.3969/j.issn.1000-2561.2021.09.025
瀕危物种的保育是生物多样性保护研究的核心内容[1-2]。吊罗山薹草(Carex diaoluoshanica)是莎草科薹草属植物,该物种是笔者团队在海南吊罗山发现并公开发表的物种[3],模式标本(Holotype)保存于中国科学院华南植物园标本馆,同形标本(Isotype)保存于中国热带农业科学院热带作物品种资源研究所标本馆。吊罗山薹草是热带雨林低层草本植物的重要代表,笔者团队对吊罗山薹草的种群分布展开了深入的调查,目前只发现2个居群,其资源现状总体表现为种群数量极低、单个种群占有面积极小、种群呈破碎化分布。根据《中国生物多样性红色名录—高等植物卷》的评估方法[4],吊罗山薹草达濒危级别。根据分布区域狭窄且破碎化的现状,推测其资源数量存在进一步退化的风险[3,5]。据前期定位观测发现吊罗山薹草对生境的选择高度专一,喜生于郁闭度高、土壤潮湿的区域,生境适宜性的弱化是否制约其种群发展是开展保育研究的重要内容。
光照和水分是影響植物生长和发育的重要因子[6-8]。生境中生态因子的交互作用,使植物在形态、功能性状、生物量分配格局及生理方面产生可塑性响应,以适应变化的环境[9-13],吊罗山薹草的地理分布必然与其生长环境有着密切的关系。故本研究以吊罗山薹草为研究材料,通过人工控制光照强度和土壤含水量的方法,研究光照和水分的协同作用对吊罗山薹草生长的影响,拟探讨吊罗山薹草最佳的生长环境条件。实验的开展将深入了解吊罗山薹草对光照和水分的需求,研究结果可为吊罗山薹草的有效保护提供科学依据。
1 材料与方法
1.1 材料
研究材料为生长状态一致、无病斑的一年龄吊罗山薹草健康种子苗。
1.2 方法
1.2.1 实验设计 实验采用双因素处理,于2018年12月21日—2019年2月21日在海南省儋州市中国热带农业科学院(19°51′ N,109°49′ E)的温室大棚内进行。将吊罗山薹草的小苗移栽至210 mm×180 mm的塑料花盆中,并置于双层遮荫网下缓苗培养,在实验正式开始时,已恢复生长,生长状态一致。培养基质为泥炭∶细沙∶细土∶椰糠=3∶3∶1∶1(体积比)的混合基质,共1800 g,最大持水量为43.28%,初始含水率为1.2%。
实验设4个光照处理,分别为自然光照(无遮荫)、自然光照的70%(使用遮阴度为30%的纱网)、自然光照的40%(使用遮阴60%的纱网)和自然光照的10%(使用遮阴度90%的纱网),分别用 L1、L2、L3和L4 表示;3个水分处理,设置为基质最大保水量的100%、70%和30%,分别用W1、W2和W3表示。本实验采用双因素随机区组方法设计,10次重复,盆栽标记为L1W1-1、L1W1-2……L1W1-5,为避免位置不同带来的实验误差,每7 d随机移动盆栽位置。处理期间采用称重法控制各水平的水分处理,根据基质的最大含水量和基质花盆总重量,计算出每个处理应该达到的总重量,于每天下午6:00对每个花盆进行称重,补充水分至处理所要求的重量。实验期间精细管理,发现杂草立即去除。
1.2.2 测定指标 (1)光合参数的测定。采用Li-6400 XT便携式光合仪(LI-COR,USA)测定相关光合指标。选择生长状态一致的叶片于2019年2月10日上午9:00开始进行光合参数的测定,测定时采用仪器内部的红蓝光源,光强设置为1200 mol/(m2·s),1个处理5次重复。根据光合参数的数据计算瞬时水分利用率。
(2)叶绿素含量测定。选取生长状态一致的叶片,清洗剪碎后,称取0.1 g,置于2 mL离心管中,加2 mL的丙酮-乙醇浸提液,用锡纸包裹置于4 ℃ 冰箱中浸泡24 h,提取过程中经常摇动以保证提取完全。使用紫外分光光度计分别测定645 nm和663 nm波长处的OD值。
(3)丙二醛含量测定。参考陈建勋等[14]的方法,剪取叶片放入冰盒,测定时称取0.3 g,加液氮磨碎后转移至10 mL离心管中,加入TCA 5 mL,离心,取上层液体2 mL转移至另一10 mL离心管中,加入TBA 2 mL,混合摇匀后100 ℃水浴加热0.5 h,迅速冷却后再次离心。使用紫外分光光度计测定上清液在532、600、450 nm波长处的OD值。
(4)生物量的测定。处理结束后,每处理3次重复,将植株按地上、地下部装入尼龙网袋,标记,105 ℃下杀青,70 ℃下烘干,称量并记录。计算根冠比和植株总生物量。
1.3 数据处理
采用SPSS 19统计分析软件对各实验数据进行双因素方差分析(Two-way ANOVA)和处理间差异显著性分析。在方差分析前,对不符合要求的数据进行对数转换,达到方差齐性。数据分析结果使用originPro 9.0软件进行图表制作,结果以平均值±标准差来表示。
2 结果与分析
2.1 光照和水分对吊罗山薹草光合参数的影响
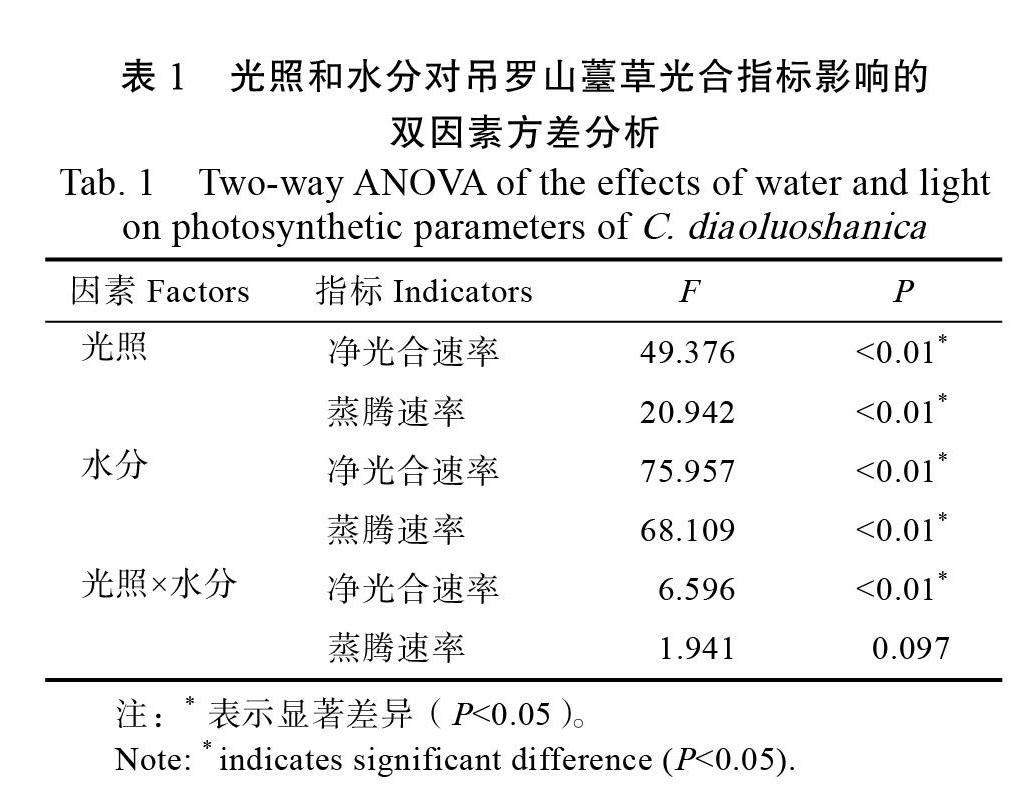
不同的光照和水分处理对吊罗山薹草光合参数的影响表明(表1),光照和水分对净光合速率和蒸腾速率影响显著;二者的交互作用对净光合速率影响显著,而对蒸腾速率影响较小。
从图1可见,实验持续60 d时测定不同水分条件下的净光合速率,结果表明随着光照强度的降低呈先升高后降低的趋势。在W1和W2水分处理下,Pn的最大值出现在L 其次是L4,二者间差异不显著,Pn最小值出现在L1光照处理下,与L2的Pn差异不显著,但Pn在前两种光照处理和后两种光照处理间的差异达到了显著水平。W3水分条件下,Pn的最小值出现在L4光照处理,L4与L1、L2光照处理下的Pn未表现出显著差异,但与L3光照处理时的Pn差异显著。不同水分条件下的净光合速率在光照处理相同时均表现出随着基质含水量的降低先升高后降低,光合速率的最大值均出现在L3光照处理时,而最小值在各光照处理下有些差异。
光照和水分对吊罗山薹草蒸腾速率(Tr)的影响(图1)表现为:在W1和W2水分条件下,Tr呈现出随着光照强度的降低而下降的趋势,L1光照处理时的Tr最高。而在W3水分条件下,蒸腾速率在L4光照处理时出现了回升的趋势,与L3相比,差异显著(P<0.05)。同一水平的光照处理时,蒸腾速率随着基质含水量的降低而降低,各个水分处理间差异显著。
2.2 光照和水分对吊罗山薹草水分利用效率的影响
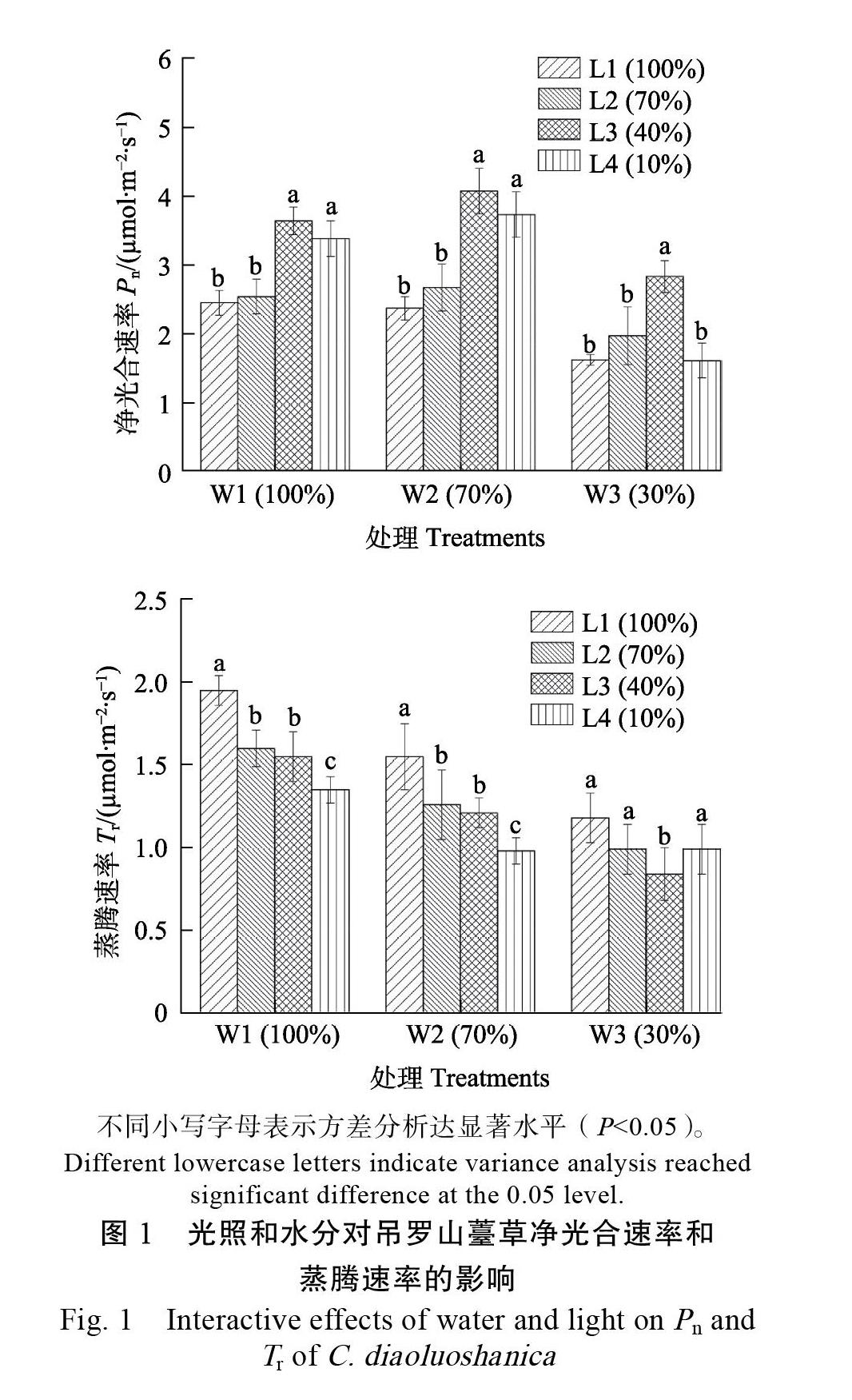
采用双因素方差分析探究光照和水分对吊罗山薹草瞬时水分利用效率(WUE)的影响。结果显示,在本研究中,光照和水分对吊罗山薹草WUE的影响上存在交互作用,F(6, 48)=8.232,P< 0.0 光照和水分对WUE的影响均达到了显著水平,光照F(3, 48)=42.250,P<0.01;水分F(2, 48)= 17.727,P<0.01。
从图2可见,在W1和W2水分条件下,水分利用效率呈现出随着光照强度的降低而上升的趋势,而在W3水分条件时,呈现出先升高后降低的趋势,L3光照下出现最大值,其他3组光照处理间的WUE差异不显著(P>0.05)。同一光照下的WUE总体上表现为随着基质含水量的降低先升高后降低,W2下出现最大值,并与其他两种水分处理间存在显著差异。
2.3 光照和水分对吊罗山薹草叶绿素含量的影响
通过双因素方差分析(表2)可以看出:水分对叶绿素a含量和叶绿素a/b的主效应显著,对叶绿素b含量的影响较小;光照对上述所有指标的影响都达到了显著水平;光照和水分的交互作用除了对叶绿素b含量的影响不显著外,对其他指标的影响均达到了显著水平。
从图3可见,叶绿素a含量在相同水分条件下的不同光照处理间均表示出先升高后降低的趋势,W1和W3水分处理时,L3、L4和L1、L2光照处理间的叶绿素a含量差异显著,但L1和L2间差异不显著、L3和L4间差异也不显著;W2水分条件下时,除L3和L4不同光照处理间的叶绿素a含量的差异不显著之外,其余各光照处理间的绿素a含量存在显著差异。L1和L2光照时,叶绿素a的含量变化与基质含水量的变化一致,各处理间差异显著;L3和L4光照下的叶绿素a含量在不同水分间未出现显著差异。
从图3可以看出,叶绿素b含量在同一水分的不同光照处理间均表示出先升高后降低的趋势,L3和L4光照下的叶绿素b含量显著高于L1和L2。在W1和W2水分条件下,L3和L4光照处理间、L1和L2光照处理间的叶绿素b含量不存在显著差异(P>0.05),但两组之间存在差异显著;W3水分下,除L3与L4光照处理间的叶绿素b含量差异不显著,其他光照处理间叶绿素b含量差异显著。L1光照时,叶绿素b含量随着水分的亏缺呈下降趋势;L3和L4光照时,叶绿素b含量随着基质含水量的减少表现出先降低后升高的趋势,但上述各水分处理间差异不显著;L2光照下,W3水分条件下的叶绿素b含量最高,与W1和W2相比有显著差异。
從图3可以看出,叶绿素a+b含量在水分条件一致时,随着光照强度的降低先升高后降低,L1和L2光照处理时叶绿素a+b的值显著低于L3和L4光照处理。在W2水分条件下,各光照处理间均存在显著差异。W1水分条件下,前两种光照处理间,后两种光照处理间无显著差异,但前后两组间差异显著。W3水分条件下,除L3和L4外其余光照处理间存在显著差异。L1和L2光照处理时,叶绿素a+b的值随着基质含水量的降低而降低,但这种趋势在L3光照处理下表现不明显。
从图3可以看出,在水分条件一致时,叶绿素a/b的值变化与光照强度的变化一致。W1水分条件下,L1和L2光照处理间,L3和L4光照处理间无显著差异,但两组之间差异显著。在W2水分条件下,L3和L4光照处理间不存在显著差异,除此之外的光照处理间叶绿素a/b的值差异显著。W3水分条件下,L2光照处理下的叶绿素a/b的值最高,显著高于其他光照处理,L3和L4处理间不存在显著差异。
2.4 光照和水分对吊罗山薹草丙二醛含量的影响
采用双因素方差分析探究光照和水分对吊罗山薹草丙二醛(MDA)含量的影响。结果显示,在本研究中,光照和水分对吊罗山薹草MDA含量的影响上存在交互作用,F(6, 48)=18.686,P<0.001。简单主效应分析显示,在不同的光照水平下,不同水分水平下的MDA含量不同:光照F(3, 48)=173.957,P<0.001;水分F(2, 48)=255.226,P<0.001。
从图4可见,W1和W3时,吊罗山薹草的MDA含量随着光照强度的减弱呈现出先降低后升高的趋势,L3光照处理时最低,与其他处理间差异显著。W2水分条件时,MDA含量的变化与光照强度的变化一致,但L3与L4光照间的差异不明显。L4光照时,MDA含量随水分的降低先降低后升高,W2水分条件下为最小值,各水分处理间差异显著;其他3种光照下,MDA含量随着基质含水量的降低而升高,各处理之间差异显著。
2.5 光照和水分对吊罗山薹草根冠比、根生物量和地上部分生物量的影响
通过双因素方差分析可以看出,光照和水分二者均对吊罗山薹草的地上部分生物量、根生物量和根冠比影响的主效应显著;而光照和水分的交互作用仅对地上部分生物量的影响达显著水平,对根生物量和根冠比的影响不显著(表3)。
从图5可见,在基质含水量为W1和W2时,随着光照强度的降低,吊罗山薹草地上部分的生物量表现出先升高后降低的趋势,在L3光照条件下为最大值,L4光照条件下为最小值,L2和L3光照处理间差异不显著;而在基质含水量为W3时,这种趋势并不明显,各光照处理间未表现出显著性差异。在4种光照水平下,地上部分生物量均表现出随着基质含水量的降低呈现出先升高后降低的趋势,W2时,地上部分生物量最大,W3时,地上部分生物量最小,L1、L2和L3光照下的W1和W2水分间的差异不显著,但与W3间的差异达到显著水平;L4光照水平下的各水分处理间的差异均达到显著水平。
从图5可见,在基质含水量为W1和W2时,根生物量的变化与光照强度的变化一致;W3时,根生物量随光照强度的降低先增大后降低,但同一水分条件下的各光照处理间的差异未达到显著水平。L1、L2和L3光照水平下,根生物量随着基质含水量的降低先升高后降低,W2与W3水分间存在显著差异,其他处理间的差异未达到显著水平。L4光照条件下的各个水分处理间根生物量不存在显著差异。
从图5可见,在同一水分条件下根冠比随着光照强度的减弱先降低后升高,W1和W2水分条件下除了L2和L4光照间不存在显著差异外,其他处理间的根冠比值的差异均达到了显著水平;W3水分下,除L1、L2和L3之间的根冠比存在显著差异外,其他处理间均不存在显著差异。在L1光照下,随着基质含水量的降低,根冠比逐渐增大,其他3种光照水平下也存在相同的趋势,4种光照下的W1和W2水分处理间的根冠比不存在显著差异,但与W3水分条件下的根冠比的差异达到显著水平。
3 讨论
3.1 光照和水分对吊罗山薹草光合参数的影响
光照和土壤水分是影响植物光合作用的重要因素,植物的光合生理对环境的响应可以在一定程度上反映植物对不良环境的适应能力。本研究发现,在同一水分条件下,不同光照处理均表现出L3光照的净光合速率最高,说明L3的光照最有利于吊罗山薹草进行光合作用;W1和W2水分处理时,L3和L4下的净光合速率没有显著差异,而W3水分条件下,L3的Pn显著高于其他处理,说明适当的水分和光照可以缓解遮荫和水分胁迫给吊罗山薹草带来的伤害,适当的光照可以缓解干旱对其造成的伤害。同一光照下,吊罗山薹草的Pn随着水分的减少逐渐降低,W1和W2下的Pn显著高于W L1和L2光照下具有相似的趋势。同一水分下,Tr随着光照的减弱逐渐下降;同一光照下,Tr的变化与水分的变化趋势一致,这与黄拯等[15]的研究结果相同。以上结果说明,吊罗山薹草在弱光和水分不足的环境下会减少自身的蒸腾作用以减少水分的散失,實现对不良环境的适应。
3.2 光照和水分对吊罗山薹水分利用特征的影响
水分利用效率(WUE)是植物光合作用和蒸腾作用特征的综合体现,是衡量植物生长适宜度评价的关键生理指标[16]。水分不足时,植物叶片会通过减小气孔开放程度,减少水分蒸发从而提高其利用水分的能力,这是植物自身的一种适应性机制[17]。本研究中,W1和W2水分条件下,WUE随着光照的减弱逐渐增加,说明弱光提高了吊罗山薹草的水分利用能力,使其可以固定更多的CO2,更好的积累光合产物,这与张述斌等[18]的结果一致。W3水分条件下,L3的WUE显著高于其他处理,这可能是由于L3光照适合植物的生长。L1光照下,WUE随着基质含水量的降低而升高,但各处理间差异不显著,其他3种光照下的WUE随着水分的减少先升高后降低,这与曲玉莹等[19]的研究结果相似,对上述结果进行分析可知,L3、W2处理时吊罗山薹草的水分利用效率最高,说明吊罗山薹草喜好水分适中,光照较弱的环境。
3.3 光照和水分对吊罗山薹草叶绿素含量的影响
叶绿素(Chl)是参与植物的光合作用的重要色素,其含量可以在一定程度上体现出植物光合能力的强弱,Chl a主要吸收红光,Chl b吸收蓝紫光的能力强,因此,叶绿素a与b的比值可以一定程度反映植物利用光的能力,这些指标对植物的生长发育具有极其重要的作用[20-23]。同一水分下,叶绿素a、叶绿素b和叶绿素a+b含量均随着光照强度的降低先升高后减低,这与钱龙梁等[24]的结果一致,此外,L3和L4之间差异不显著,但显著高于L1和L2,说明吊罗山薹草对强光的适应性较弱,更适宜在低光环境中生长。相同水分处理下的叶绿素a/b的值随着光照强度的降低而降低,全光照下的值与其他处理之间差异显著,说明弱光照下,吊罗山薹草为了更好地利用漫反射的蓝紫光降低了自身叶绿素a的含量,提高了叶绿素b的含量。
L1和L2下的叶绿素a、叶绿素b和叶绿素a+b的含量随着水分的减少而降低,且各处理间差异显著;L3和L4下叶绿素a、叶绿素b和叶绿素a+b的含量随着水分的减少先减少后增加,L3下各处理不存在显著差异,L4、W2下的含量显著低于其他两组,说明在弱光照条件下,水分对叶绿素含量的影响低于强光照时水分对叶绿素含量的影响,弱光照在一定程度上可以抵消水分缺失对吊罗山薹草造成的伤害。
3.4 光照和水分对吊罗山薹草丙二醛含量的影响
细胞膜的稳定是植物维持正常生命活动的基础,叶片丙二醛含量是衡量细胞质膜透性的重要指标,可以反映细胞膜在不良环境下受伤害的程度[25]。本研究结果表明,同一光照条件下,随着水分的降低,MDA含量升高,但W3下的MDA含量显著高于其他两组;W2处理下的变化有些差异,即MDA含量随着光照强度的降低而降低,但L3与L4间的差异不显著。上述结果说明吊罗山薹草有一定的耐涝性。
3.5 光照和水分对吊罗山薹草生物量和根冠比的影响
植物的整个生命过程和其生境条件息息相关,环境的变化会影响植物体的形态建成和生理活动,在面临环境变化时,植物自身的生物量积累和分配比例会产生适应性变化以更好地生存,而光照和水分作为重要的环境因子会直接影响植物生物量的积累和分配比例[26]。前人研究发现植物为了适应弱光环境,更好地利用光能,表现出
随着光照的减弱叶生物量增大,根生物量和根冠比减低[27]。本试验中,根的生物量变化与上述研究结果一致,但地上部生物量和根冠比的表现不同,在水分条件一致时,地上部生物量表现出随着光照强度的减弱先升高后降低,而根冠比的表现是先降低后升高,两种指标均在L3光照处有极值,这可能是由于L4光照强度过弱,超过了吊罗山薹草对弱光的适应能力,导致其生长直接受到了抑制,W3水分下的地上部生物量和根生物量在各光照处理间不存在显著差异,说明当水分不足时,光照已不再是影响植物生物量积累和分配的限制因素,但L3光照下的根冠比显著低于其他3种光照处理下的根冠比,说明在水分不足时,适当的遮荫可以促进植物的生长。
在光照条件相同时,随着水分的降低地上部生物量和根生物量均呈现出先升高后降低的趋势,根冠比呈现出先降低后升高的趋势,L3处有极值,说明吊罗山薹草在L3光照下生长最好。此外,各光照水平下W1和W2水分处理间各指标不存在显著差异,说明吊罗山薹草对过多的水分不敏感,具有一定的抗涝性。
综上,强光照和低水分对吊罗山薹草的影响较大,不利于其生长,40%光照和70%水分是其最佳生长环境。通过本研究可了解光照和土壤水分对濒危植物吊罗山薹草的生长影响具有一定的参考作用,然而也存在一些不足之处,如实验时间短、实验为室内盆栽实验,缺乏野外自然植物群落研究等,在进一步的研究中还需要加强这些方面的研究以便更好地了解吊罗山薹草的最适生长环境。
参考文献
[1] 马克平. 一次新的生物大灭绝[N]. 北京科技报, 2010-07-26.
[2] 马克平. 未来十年的生物多样性保护目标[J]. 生物多样性, 2011, 19(1): 1-2.
[3] Yang H B, Wang Q L, Bai C J, et al. Carex diaoluoshanica (Carex sect. Lageniformes, Cyperaceae), a new species from Hainan, China[J]. PLos One, 2014, 9(6): e97658.
[4] 陈灵芝. 中国的生物多样性现状及保护对策[M]. 北京: 科学出版社, 1993.
[5] Myers N. Biodiversity hot spots for conservation priorities[J]. Nature, 2000, 403: 853-858.
[6] Li Y G, Jiang G M, Niu S L, et al. Gas exchange and water use efficiency of three native tree species in Hunshandak Sandland of China[J]. Photosynthetica, 2003, 41(2): 227-232.
[7] 黄 华, 梁宗锁, 韩蕊莲. 持续干旱胁迫对女贞形态与生长的影响[J]. 林业科学, 2008, 44(8): 145-148.
[8] 徐克章. 植物生理学[M]. 北京: 中国农业出版社, 2007: 335-340.
[9] 宋晓蕾, 杨红玉, 曾黎琼, 等. 植物遮荫效应的研究进展[J]. 北方园艺, 2009(5): 129-133.
[10] 代英超, 徐奎源, 马 凯, 等. 珍稀濒危植物堇叶紫金牛对持续干旱的生理响应[J]. 生态学报, 2015, 35(9): 2954-2959.
[11] Albert K R, Ro-Poulsen H, Mikkelsen T N, et al. Interactive effects of elevated CO2, warming, and drought on photosyn?thesis of Deschampsia flexuosia in a temperate health eco?system[J]. Journal of Experimental Botany, 2011, 62: 4253-4266.
[12] Poorter L, Bongers F. Leaf traits are good predictors of plant performance across 53 rain forest species[J]. Ecology, 2006, 87(7): 1733-1743.
[13] Sack L, Grubb P J. The combined impacts of deep shade and drought on the growth and biomass, allocation of shade-tol?erant woody seedlings[J]. Oecologia, 2002, 131(2): 175-185.
[14] 陳建勋, 陈晓峰. 植物生理学试验指导[M]. 广州: 华南理工大学出版社, 2006.
[15] 黄 拯, 钟秋平, 曹林青, 等. 干旱胁迫对油茶成林光合作用的影响[J]. 经济林研究, 2017, 35(4): 72-79.
[16] 张卫强, 贺康宁, 田晶会, 等. 不同土壤水分下侧柏苗木光合特性和水分利用效率的研究[J]. 水土保持研究, 2006, 13(6): 44-47.
[17] Steduto P, Katerji N, Puertos-Molina H, et al. Water-use efficiency of sweet sorghum under water stress conditions Gas-exchange investigations at leaf and canopy scales[J]. Field Crops Research, 1997, 54(2-3): 221-234.
[18] 张述斌, 张 锐, 徐崇志, 等. 遮阴对‘温185核桃叶片生理特性的影响[J]. 北方园艺, 2017, 41(18): 28-34.
[19] 曲玉莹, 曲 波, 崔 娜, 等. 不同水分胁迫对‘翠鸟玉簪叶片表皮蜡质及生理特性的影响[J]. 园艺学报, 2019, 46(7): 1344-1350.
[20] 张守仁, 高荣孚, 王连军. 杂种杨无性系的光系统Ⅱ放氧活性、光合色素及叶绿体超微结构对光胁迫的响应[J]. 植物生态学报, 2004, 28(2): 143-149.
[21] 杨逢建, 庞海河, 张学科, 等. 光胁迫对南方红豆杉叶片中叶绿体色素和紫杉醇含量的影响[J]. 植物研究, 2007(5): 556-558.
[22] Tjus S E, M?ller B L, Scheller H V. Photoinhibition of pho-tosystem I damages both reaction centre proteins PSI-A and PSI-B and acceptor-side located small photosystem I poly-peptides[J]. Photosynthesis Research, 1999, 60(1): 75-86.
[23] Anne Stenbaek, Poul Erik Jensen. Redox regulation of chlo-rophyll biosynthesis[J]. Phytochemistry, 2010, 71(8): 853- 859.
[24] 钱龙梁, 李佳佳, 曹福亮, 等. 生物遮阴对银杏幼苗次生代谢的影响[J]. 南京林业大学学报(自然科学版), 2019, 43(3): 189-194.
[25] Becana M, Dalton D A, Moran J F, et al. Reactive oxygen species and antioxidants in legume nodules[J]. Physiologia Plantarum, 2000, 109(4): 372-381.
[26] 刘佳宁, 李春友, 贾长荣, 等. 大果榆苗期对不同水分胁迫的生长与生理响应[J]. 西北林学院学报, 2018, 33(4): 24-29, 205.
[27] 宋 洋. 遮蔭干旱互作对榧树苗木生长和生理的影响及其机制[D]. 杭州: 浙江农林大学, 2016.
责任编辑:沈德发

