橡胶树树皮中ACC氧化酶基因(HbACO7)的表达特性及功能探究
王艺玮 冯仁军 黄亚成 刘晓东 方永军 罗红丽 唐朝荣

摘 要:天然橡膠是重要的工业原材料,主要来自橡胶树树皮中的乳管。乙烯能促进橡胶树乳管产胶和排胶,在树皮上施用乙烯利(一种乙烯释放剂)或乙烯可显著提高胶乳产量。基于本课题组前期获得的橡胶树基因组和转录组数据,克隆橡胶树中乙烯合成通路关键酶——1-氨基环丙烷基-1-羧酸(ACC)氧化酶基因家族(HbACOs)的全部8个家族基因,研究其组织表达模式。结果表明:在分析的7种组织中,尽管HbACO基因存在不同程度的冗余表达,但每种基因的组织表达模式具有明显的特异性,其中HbACO7是树皮中表达量最高的家族基因。HbACO7基因的表达在割胶季节的不同月份发生明显变化,其中在8月的表达量最高。成功构建了HbACO7基因的原核表达载体,实现其在大肠杆菌BL21中的诱导表达。纯化后的HbACO7重组蛋白具有明显的ACO酶催化活性,成功地催化了乙烯的体外合成。该结果将为后续橡胶树树皮中的乙烯生物合成调控机制研究提供参考。
关键词:橡胶树;乙烯;生物合成;HbACO7;酶活
中图分类号:S794.1 文献标识码:A
Expression and Function of an ACC Oxidase Gene (HbACO7) from the Bark of Hevea brasiliensis
WANG Yiwei1, FENG Renjun1,2, HUANG Yacheng1, LIU Xiaodong1, FANG Yongjun3, LUO Hongli1, TANG Chaorong
1. Natural Rubber Cooperative Innovation Center, Hainan Province & Ministry of Education of PRC / College of Tropical Crops, Hainan University, Haikou, Hainan 570228, China; 2. Hainan Key Laboratory of Tropical Brain Research and Transformation, Hainan Medical College, Haikou, Hainan 571199, China; 3. Rubber Research Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, China
Abstract: Natural rubber is an important industrial raw material, mainly harvested from the rubber-producing laticifers residing in the bark of rubber tree (Hevea brasiliensis). Previous studies reveal that ethylene promotes both latex flow and regeneration, and the application of ethrel (an ethylene generator) or ethylene on bark could stimulate latex yield. In this study, based on the Hevea genome and transcriptome database we previously constructed, eight HbACO genes encoding the Hevea ACC oxidase (ACO), a key enzyme in ethylene biosynthesis, were cloned and examined for their expression patterns in seven Hevea tissues. Although the HbACO genes exhibited varying degrees of redundant expression in the seven tissues examined, each retained a distinct pattern of tissue expression. Of the eight HbACOs, HbACO7 showed the highest expression in the bark. The expressions of HbACO7 fluctuated greatly with the change of tapping months, showing the highest level in August. The prokaryotic expression vector HbACO7 was successfully constructed, and the expression of HbACO7 protein was induced in E. coli BL21. The purified HbACO7 recombinant protein successfully catalyzed ethylene synthesis in vitro, indicating its functionality as an active ACO enzyme. This study would lay a foundation for further research on the regulatory mechanism of ethylene biosynthesis in the bark of rubber tree.
Keywords: Hevea brasiliensis; ethylene; biosynthesis; HbACO7; enzyme activity
DOI: 10.3969/j.issn.1000-2561.2021.09.001
橡胶树[Hevea brasiliensis (Willd. ex A. Juss.) Muell. Arg],又称三叶橡胶树或巴西橡胶树,大戟科橡胶树属落叶乔木,原产于亚马逊河流域。中国植胶区主要分布于海南、云南和广东地区。由于橡胶樹合成的天然橡胶综合性能优异,迄今无法被人工合成橡胶完全替代,是重要的战略物资和工业原料[1-3]。在天然橡胶的生产过程中,长期使用乙烯作为胶乳增产刺激剂[4]。虽然关于外源乙烯刺激橡胶树胶乳增产的研究较多[5-9],但对于橡胶树树皮内源乙烯生物合成通路中1-氨基环丙烷基-1-羧酸(ACC)氧化酶(ACO)基因的研究却很少,尚未见关于橡胶树ACO酶活方面的研究报道。
乙烯生物合成途径的调控较为复杂,涉及很多因素[7],其中ACO基因家族包含了众多成员,受一定的外界和内在因素影响,从而改变基因表达、蛋白量与酶活性,最终调控乙烯的产生[10-11]。ACO氧化ACC生成乙烯是乙烯合成途径的最后一步[12],近年来许多研究显示,在很多植物生理活动中ACO基因的表达能够被快速地诱导,表明ACO可能是调控乙烯生物合成的一个关键酶[5-6]。在橡胶树中,研究发现在树皮上施用外源乙烯或通过割胶、机械伤害等在树皮中产生的内源乙烯均可刺激胶乳产量[13-14];本课题组前期基于转录组分析发现,橡胶树乳管中的内源乙烯的合成能力很弱,但却存在活跃的乙烯信号传递与应答通路,从源头上回答了外源乙烯显著刺激胶乳产量的机制[15]。基于以上信息,推测橡胶树树皮中的ACO酶可能通过调控树皮中的乙烯生物合成影响橡胶树的产排胶。鉴于此,本研究拟克隆橡胶树树皮中乙烯生物合成关键酶ACO基因(HbACO),并对其进行组织表达特性、不同割胶月份表达、原核表达及酶活性分析,为今后深入研究橡胶树ACO基因的表达调控与产胶关系提供参考。
1 材料与方法
1.1 材料
1.1.1 采样地 采样地点位于海南省澄迈县的红星农场(19.837°N,110.016°E)。该采样点位于海南岛的北部,属热带海洋性季风气候。降水主要集中在5—10月,其中8月台风季时降水量及相对湿度达到峰值,而11—12月几乎无降雨;5—10月的平均温度浮动不大,维持在30 ℃左右,11月开始下降,12月最低,可低至15 ℃以下。
1.1.2 植物材料 巴西橡胶树品种为‘热研7-33-97,树龄9 a,第2年割胶,选取5株长势和树围基本一致的橡胶树,分别于2019年5月24日、6月27日、8月6日、8月27日、9月25日、10月25日、11月23日和12月25日上午6:00割胶,进行不同季节的橡胶树树皮样品采集。采样前,撕去割胶口上附着的胶线,切割树皮后立即装入50 mL无RNA酶的离心管中,盖紧瓶盖,液氮中保存待用。记录每次采样时的天气数据,分析发现采样期间的降水量和温度变化情况。
1.1.3 质粒及菌株 原核表达载体pNC-ET28购自海南壹田生物科技有限公司;pEASY?-Blunt克隆载体、Trans1-T1感受态细胞及BL21感受态细胞均购自北京全式金生物技术有限公司;pET28a质粒为本实验室保存。
1.1.4 试剂 ACC购自Sigma公司;通用植物总RNA大量提取试剂盒(离心柱型)购自北京百泰克生物技术有限公司;通用型DNA纯化回收试剂盒购自天根生化科技(北京)有限公司;TransStart? FastPfu DNA Polymerase购自北京全式金生物技术有限公司;反转录试剂盒PrimeScript? RT reagent Kit购自TaKaRa公司;Nimble Cloning原核表达系统试剂盒购自海南壹田生物科技有限公司;质粒提取试剂盒购自OMEGA公司;FastStart Essential DNA Green Master试剂盒购自Roche公司;镍离子螯合磁珠购自海狸纳米科技(苏州)有限公司;其他常规试剂均购自生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 橡胶树树皮总RNA提取及反转录 根据通用植物总RNA大量提取试剂盒(离心柱型)说明书,提取不同季节采集的橡胶树树皮总RNA,经电泳检测条带完整无降解后,于–80 ℃保存备用。利用反转录试剂盒将总RNA反转录合成cDNA,并置于–80 ℃保存待用。
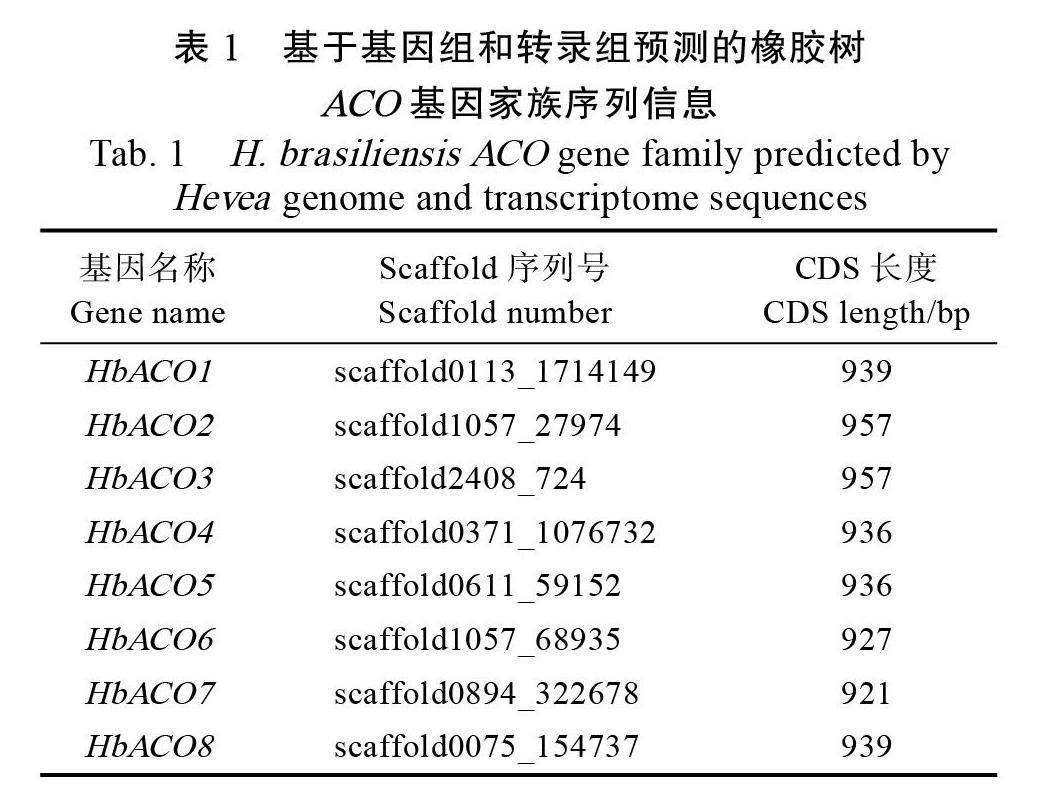
1.2.2 HbACOs家族基因克隆 利用生物信息学工具,从本课题组报道的基因组数据中筛选到8个HbACOs基因[15];用本地Blast工具搜索巴西橡胶树‘热研7-33-97转录组数据库得到了基因的全长CDS序列,将其分别命名为HbACO1~ HbACO8(表1);利用Premier 5.0软件,设计上述基因的特异性扩增引物(表2),委托北京六合华大基因科技有限公司合成。
参照相关文献[16-18],以橡胶树树皮的cDNA为模板,对8个HbACO基因进行PCR扩增。PCR扩增产物经 1%琼脂糖凝胶检测后,使用通用型DNA纯化回收试剂盒回收目标片段;将回收产物连接至Blunt克隆载体,转化大肠杆菌Trans1-T1感受态细胞后涂于含有卡那霉素(100 mg/mL)的LB平板,37 ℃培养过夜后,挑取菌落进行PCR检测;将PCR检测呈阳性的菌落进行菌液培养,送华大基因公司进行测序鉴定。根据测序鉴定后的HbACOs基因在转录组数据[15]中表达量的高低,筛选出树皮中表达量最高的HbACO基因。
1.2.3 qRT-PCR分析 检测8次树皮样品的cDNA模板浓度,按荧光定量分析试剂盒的建议调整各个cDNA样品的使用浓度,尽量保证所有分析样品中包含大致相近的cDNA量。利用Premier 5.0软件,设计橡胶树树皮表达主要HbACO基因的qRT-PCR引物,委托北京六合华大基因科技有限公司合成(表2)。根据FastStart Essential DNA Green Master试剂盒说明书进行树皮主要HbACO基因的qRT-PCR分析,所得数据采用2-ΔΔCT法进行计算。
1.2.4 原核表达载体的构建及蛋白诱导表达 使用海南壹田生物科技有限公司的Nimble Cloning原核表达系统试剂盒,根据说明书将筛选出来的主要HbACO基因克隆到表达载体pNC-ET28上,
并对构建好的重组表达载体pNC-ET28- HbACO进行测序鉴定。将pNC-ET28-HbACO和pET28a空载(对照)分别转化大肠杆菌BL21感受态细胞,挑单菌落接种于含有卡那霉素(100 mg/ mL)的LB液体培养基中,37 ℃(220 r/min)培养过夜,按1∶100的比例扩大培养菌液至OD600=0.5~0.8。最后用浓度为1 mmol/L的IPTG诱导表达3.5 h后,于4 ℃离心收集菌体[16-19]。SDS-PAGE和Western Blot实验按照分子克隆实验指南进行[20]。用ddH2O重悬菌体,在超声破碎仪上破碎菌体,离心并取上清。蛋白经SDS-PAGE电泳后,通过半干转的方法将蛋白转移到硝酸基纤维素膜上,加入一抗(HbACO特异性抗体),孵育2 h后加入二抗(羊抗小鼠IgG)孵育1 h,然后进行显色(或显影)并拍照。HbACO特异性抗体的制備是基于HbACOs基因家族氨基酸序列多重比对结果,选择高保守且预测免疫原性强的肽段(PKPDLIKGLR),委托艾比玛特(Abmart)生物医药(上海)有限公司进行肽段合成和抗体制备(货号CL027249)。
1.2.5 ACO酶活测定 用100 mmol/L Tris-HCl缓冲液(pH 7.5)重悬收集到的菌体,在超声波破碎仪上破碎菌体,离心并取上清,再用海狸公司的镍离子螯合磁珠纯化融合表达蛋白[18]。检测纯化后的融合蛋白浓度,稀释到适当浓度,取200 μL稀释后的溶液注入盛有1.8 mL酶反应液的20 mL进样瓶中。反应液成分:100 mmol/L Tris-HCl(pH 7.5),30 mmol/L抗坏血酸钠,30 mmol/L NaHCO 1.0 mmol/L ACC,0.1 mmol/L FeSO4,10%甘油(V/V)。30 ℃水浴中密闭保温35 min后,抽取顶空气体(0.2 mL),用GC-MS测定乙烯生成量[21-25]。
2 结果与分析
2.1 HbACOs基因家族的克隆及鉴定
从表3可见,克隆的8个HbACOs基因与基因组预测的编码区长度均一致,其中2个基因(HbACO2和HbACO7)的编码序列也与基因组预测的完全一致,但其余6个基因与基因组预测的有少量碱基差异,这其中有3个基因(HbACO1、HbACO4和HbACO5)存在少量氨基酸序列的差别。8个HbACOs家族基因核苷酸序列一致性为55.89%~93.06%,氨基酸一致性为45.09%~ 95.28%。分析蛋白结构域发现,均存在高度保守的2OG-FeII_Oxy超家族结构域(图1)。
图中红线标注部分为2OG-FeII_Oxy超家族结构域。
2.2 橡胶树树皮主要HbACOs基因的筛选
HbACOs基因在橡胶树不同组织中的表达情况显示(图2),HbACOs基因家族所有基因在胶乳中都几乎不表达;HbACO1、HbACO5在不同组织中的表达量普遍比较低,一些组织甚至检测不到表达;HbACO3和HbACO8主要在叶片、花中表达;HbACO2在除叶片和胶乳外的其他组织中都有较高的表达;HbACO4在种子中的表达量高,而在其他组织中表达水平都很低,属于种子特异性表达基因;HbACO7在树皮和根中表达量都较高,而在其他组织中都几乎不表达;HbACO6在除胶乳外的6种组织中都有表达,其中树皮中的表达量最高。由图3可知,树皮中HbACO7的表达量最高,其次是HbACO6,最后是HbACO2,而其他4个HbACO基因的表达量很低或未表达。因此,推测HbACO7可能是橡胶树树皮中参与乙烯合成的主效ACO基因。
2.3 HbACO7基因表达的月份变化
为了研究HbACO7的表达量是否受外界环境的影响,以割胶季节5—12月的树皮总RNA的反转录产物为模板,通过qRT-PCR的方法检测HbACO7基因在不同割胶月份间的相对表达量。如图4所示,HbACO7表达量在整个割胶季中随月份呈现先升高后降低再升高的波动变化趋势。HbACO7在8月6日(7月底遇台风天气,导致原定的7月下旬割胶无法实施)的表达量最高,其次为8月27日,再次为12月25日、6月27日、10月25日和9月25日,最低为5月24日和11月23日。
2.4 HbACO7基因的原核表达及酶活测定
2.4.1 原核表达载体的构建及诱导表达 HbACO7基因cDNA编码序列长度为921 bp,编码306个氨基酸,预测蛋白分子量为34.8 kDa。将HbACO7基因的编码区连接到pNC-ET28载体上构建原核表达载体,将构建好并经测序比对验证的重组载体pNC-ET28-HbACO7转化大肠杆菌BL21感受态细胞。SDS-PAGE电泳结果表明(图5),经IPTG诱导表达出一条略大于35 kDa的特异性蛋白条带,其大小与预测的HbACO7融合蛋白的大小(约为34.8 kDa)一致。Ni柱纯化获得的HbACO7融合蛋白与未纯化的目标蛋白大小一致。Western blot实验也显示诱导表达获得了HbACO7的融合表达蛋白(图6)。
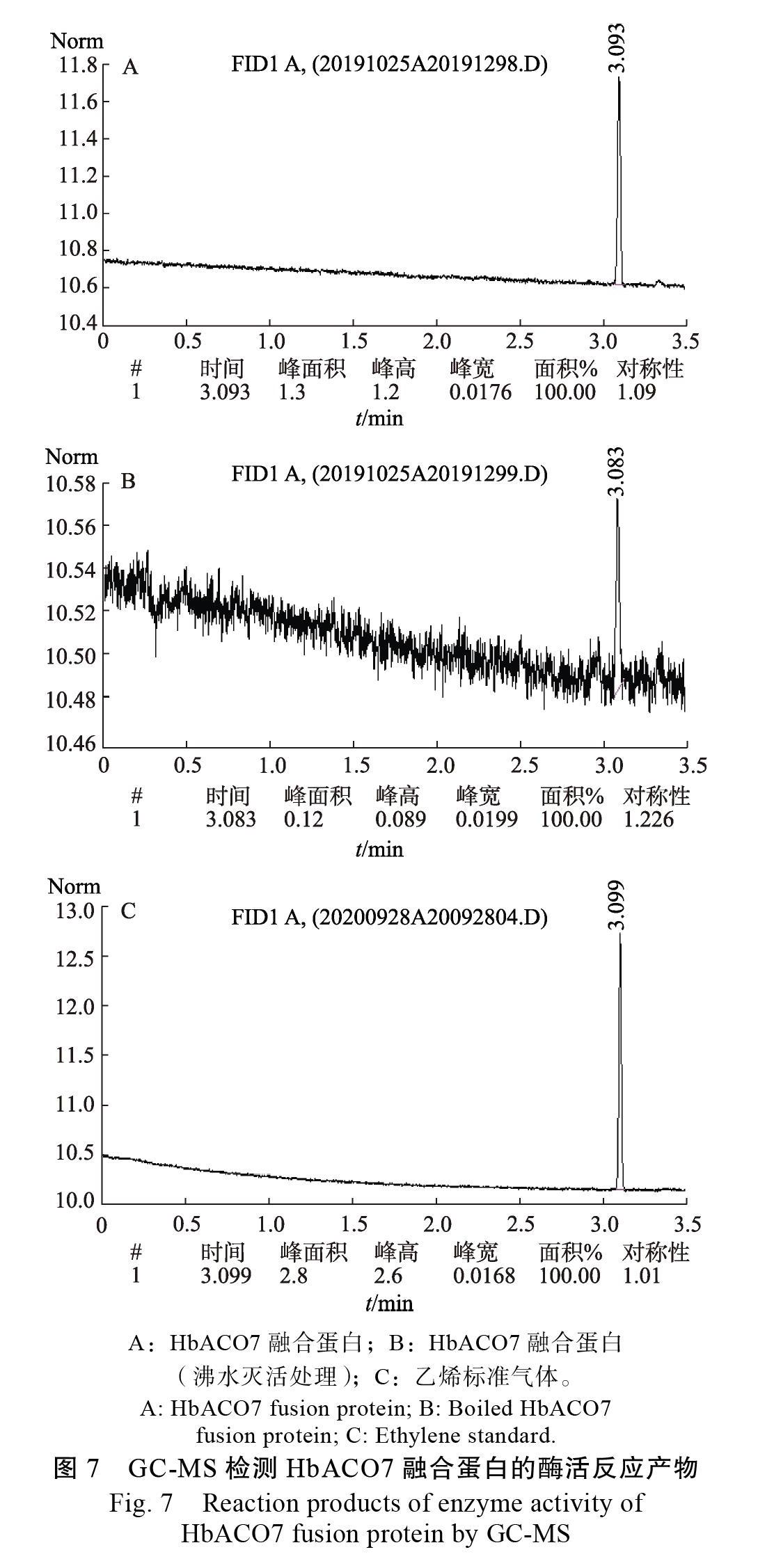
2.4.2 酶活测定 将纯化后的HbACO7融合蛋白(浓度为0.06 μg/mL)稀释20倍后进行酶活性分析。结果表明,HbACO7融合蛋白在酶活反应中能催化ACC生成乙烯。如图7A所示,产生的乙烯峰是一个明显的单峰,峰面积为1. 与乙烯标准气体产生的单峰(图7C)一致。而经高温(100 ℃)灭活的HbACO7融合蛋白产生的峰面积仅为0.12(图7B),不及未灭活HbACO7融合蛋白产生的峰面积的1/10。根据乙烯测定标准曲线,计算得到HbACO7融合蛋白的酶活性为1727.24 nL/(mgh)。
3 讨论
乙烯是一种体内含量非常微小的气态植物激素,但在植物整个生长发育过程中起着至关重要的作用,它参与了植物种子萌发、生长发育、果实成熟、组织衰老和胁迫应答等生命过程的调节[10]。橡胶树受到割胶、碰撞等机械伤害后的树皮组织立即有伤害乙烯生成,约1 d内消失,经过停滞期,诱发伤害诱导乙烯,促进产胶和排胶[13]。乙烯利作为提高天然橡胶产量的刺激剂己经被植胶者广泛使用,乙烯利刺激橡胶树割胶技术的发明及应用,对天然橡胶产业产生了重大影响[28]。研究表明用乙烯利处理橡胶树,实际上是人为外加乙烯,制造伤害反应,强度大于一般伤害,加大再生愈伤反应和割胶伤害反应,可增加胶乳产量[7, 29]。
乙烯能提高橡胶树的胶乳产量,因而对乙烯的生物合成途径的研究显得尤为关键。植物乙烯生物合成途径主要包括了3个反应:首先是甲硫氨酸在S-腺苷甲硫氨酸合成酶(SAMS)催化下变成S-腺苷甲硫氨酸(SAM),紧接着生成的SAM在ACC合成酶(ACS)的催化下生成乙烯的前体物质氨基环丙烷羧酸(ACC),最后ACC被ACO氧化产生乙烯。乙烯生物合成途径的2个关键酶ACS和ACO在成熟的果实和衰老的花器官中均受诱导表达,参与调控乙烯的生物合成[12],有关ACS和ACO基因的研究对探索乙烯生物合成途径中的分子调控具有重要意义。在生化分子水平上,对ACS基因的研究取得比较大的进展,而在ACO基因的研究上相对较少,进展缓慢[6]。对橡胶树中ACO基因功能和其在乙烯生物合成途径中作用的研究,不仅有助于了解乙烯刺激刺激胶乳产量的机制,也有助于深入了解乙烯对植物的生理效应及调控机理,对乙烯响应外界刺激反应的分子机理研究也有借鉴意义。
基于上述文献报道,推测胶乳产量可能与乙烯生物合成途径的关键ACO基因家族的表达量相关。植物ACO基因具有明显的组织特异性表达模式[30]。收集天然橡胶的主要方式是通过割胶方式切断树皮乳管,让胶乳从乳管中流出,这个过程引致机械伤害,可在树皮组织中检测到乙烯的产生[4]。结合HbACOs基因家族在胶乳中几乎不表达的结果,推测橡胶树树皮组织是产生机械伤乙烯的重要场所,生成的乙烯又能扩散到树皮乳管中促进胶乳的产生和排出。由此,我们在研究HbACOs基因时,重點关注其在树皮中的表达量。本研究发现HbACO7基因在与产胶密切相关的橡胶树茎干树皮中的表达量最高,可能为树皮中参与乙烯生物合成的HbACOs家族的主效基因,而具体在树皮何种组织中表达有待于进一步的实验研究。进一步的研究发现,HbACO7基因的表达量在割胶季节的7个月份中变化幅度较大。分析7个月中的气象数据,发现5~10月份的平均温度变化不大,而降水量变化较大,特别是8月份的台风使降水量达到最大值,而这时的HbACO7基因表达量也处于一年中的最大值。因此,推测气象条件中的降水量是影响HbACO7基因表达量高低和内源乙烯产量的重要因子。另一方面,鉴于机械伤害可以明显诱导橡胶树树皮产生伤乙烯[13-14],推测台风天气造成的橡胶树机械损伤也可能也是HbACO7基因在8月份表达量高的另一个重要因素。此外,也可能是由于台风降水等天气导致胶农减少割胶次数,而影响HbACO7基因的表达。
为了验证HbACO7基因是否编码具有生理活性的ACO酶,本研究构建了该基因的原核表达重组载体pNC-ET28-HbACO7,并成功实现了其HbACO7融合蛋白的原核表达和纯化,并对该蛋白进行了酶活测定。结果显示,HbACO7融合蛋白具有明显的ACO酶催化活性,能体外催化ACC产生乙烯。因此,我们认为橡胶树树皮中表达的主要HbACO基因HbACO7具有体内催化乙烯生物合成的生理功能。
参考文献
[1] 吴春太, 李维国, 高新生, 等. 我国橡胶树育种面临的问题与对策[J]. 江西农业学报, 2009, 21(12): 74-77.
[2] 黄宗道. 我国天然橡胶业面临的挑战和发展战略[J]. 中国工程科学, 2001, 3(2): 28-32.
[3] 安 锋, 林位夫, 谢贵水, 等. 国内外巴西橡胶树替代作物及技术研发现状[J]. 热带作物学报, 2012, 33(6): 1134-1141.
[4] 杨少琼, 黎仕剑. 机械创伤和巴西橡胶树的应激乙烯生成及其对排胶量的影响[J]. 热带作物研究, 1982, 2(4): 11-13.
[5] 刘进平. 乙烯生物合成关键酶基因研究进展[J]. 热带农业科学, 2013, 33(1): 51-57.
[6] 姚 雪, 侯和胜. 高等植物ACO基因研究进展[J]. 安徽农学通报, 2013, 19(Z1): 16-17.
[7] 位明明, 李维国, 高新生, 等. 巴西橡胶树响应乙烯利刺激的生理及其分子调控机制研究进展[J]. 生物技术通报, 2016, 32(3): 1-11.
[8] 刘 愚, 焦新之. 植物体内乙烯的生物学作用及其调节控制[J]. 植物生理学报, 1978, 4(2): 203-220.
[9] 汤福强, 刘 愚. 植物乙烯生物合成研究进展[J]. 植物生理学通讯, 1994, 30(1): 3-10.
[10] 陈银华, 黄 伟, 王海. ACC氧化酶基因研究进展[J]. 海南大学学报(自然科学版), 2006, 24(2): 194-200.
[11] 王爱勤, 王自章, 杨丽涛, 等. 乙烯生物合成途径中的两个关键酶基因的研究进展[J]. 广西农业生物科学, 2004, 23(2): 164-169.
[12] 陈新建, 刘国顺, 陈占宽, 等. 乙烯生物合成途径及其相关基因工程的研究进展[J]. 热带亚热带植物学报, 2002, 10(1): 83-98.
[13] 范思伟, 杨少琼. 乙烯利在橡胶树中的刺激增产机理及其副作用[J]. 热带作物研究, 1986, 6(1): 12-19.
[14] 范思伟, 杨少琼. 巴西橡胶的乙烯生理学[J]. 热带作物研究, 1991, 11(3): 69-77.
[15] Tang C, Yang M, Fang Y, et al. The rubber tree genome reveals new insights into rubber production and species adaptation[J]. Nature Plants, 2016, 2(6): 16073.
[16] 黄德宝. 巴西橡胶树蔗糖转运蛋白基因的克隆和表达分析[D]. 海口: 海南大学, 2009.
[17] 魏利然, 李辉亮, 郭 冬, 等. 巴西橡胶树HbMADS4的克隆及原核表达分析[J]. 热带作物学报, 2015, 36(5): 888-894.
[18] 杨光华, 刘进平. 文心兰ACC氧化酶基因OnACO1克隆与表达分析[J]. 热带作物学报, 2014, 35(4): 693-699.
[19] Xu Z C, Hyodo H, Ikoma Y, et al. Biochemical characterization and expression of recombinant ACC oxidase in Escherichia coli and endogenous ACC oxidase from kiwifruit[J]. Postharvest Biology and Technology, 1998, 14(1): 41-50.
[20] 李载平. 分子克隆实验指南[J]. 3版. 科学通报, 2002, 47(24): 1888.
[21] 胡文忠, 姜爱丽, 齐海萍, 等. 鲜切南瓜组织中乙烯产生及1-氨基环丙烷-1-羧酸(ACC)氧化酶活性的变化[J]. 中央民族大学学报(自然科学版), 2007, 16(1): 5-8.
[22] Ramadoss N, Gupta D, Vaidya B N, et al. Functional characterization of 1-aminocyclopropane-1-carboxylic acid oxidase gene in Arabidopsis thaliana and its potential in providing flood tolerance[J]. Biochemical and Biophysical Research Communications, 2018, 503(1): 365-370.
[23] 宋松泉, 叶永健. ACC氧化酶的测定方法[J]. 中山大学学报(自然科学版), 1997, 36(4): 71-74.
[24] Dupille E, Rombaldi C, Lelièvre J M, et al. Purification, properties and partial amino-acid sequence of 1-aminocy-clopropane-1-carboxylic acid oxidase from apple fruits[J]. Planta, 1993, 190(1): 65-70.
[25] Dong J G, Fernandez-Maculet J C, Yang S F. Purification and characterization of 1-aminocyclopropane-1-car-boxylate oxidase from apple fruit[J]. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(20): 9789-9793.
[26] Binnie J E, Mcmanus M T. Characterization of the 1-aminocyclopropane-1-carboxylic acid (ACC) oxidase multigene family of Malus domestica Borkh[J]. Phytochemistry, 2009, 70(3): 348-360.
[27] Chen H M, Sun J J, Li S, et al. An ACC oxidase gene essential for cucumber carpel development[J]. Molecular Plant, 2016, 9(9): 1315-1327.
[28] 許闻献, 曾 庆, 黄文成.我国橡胶树割制改革三十年见[C]//农业部农垦局热作处,我国热带作物学会割胶与生理专业委员会编. 橡胶树割胶制度改革论文集(第3集). 北京: 中国科学技术出版社, 2001.
[29] 王冬冬. 乙烯利刺激橡胶树排胶的生化机制研究[D]. 海口: 海南大学, 2016.
[30] 徐忠传. 成熟猕猴桃果实不同组织中ACC氧化酶基因的表达差异研究[J]. 中国科学技术大学学报, 2001, 31(2): 112-117.
责任编辑:黄东杰

