白背三七化学成分及代表性成分质谱裂解特征的研究进展
叶馨源,吴建明,杨 杰, ,Kantawong Fahsai,Kumsaiyai Warunee,曾 静*
·综 述·
白背三七化学成分及代表性成分质谱裂解特征的研究进展
叶馨源1,吴建明1,杨 杰1, 2,Kantawong Fahsai2,Kumsaiyai Warunee2,曾 静1*
1. 西南医科大学药学院,四川 泸州 646000 2. 清迈大学医疗技术学院,泰国 清迈 50200
白背三七是一种民间广泛使用的药食两用植物,具有清热凉血、活血、止血和止痛的功效。目前从白背三七中发现了70余种化合物,主要包括黄酮类、生物碱类、苯丙素类、萜类、甾体类、脑苷脂类等成分。通过查阅近年来国内外发表的文献资料,对白背三七化学成分及代表性成分质谱裂解特征的研究进展进行了综述,以期为白背三七化学成分结构解析的深入研究提供参考。
白背三七;黄酮类;生物碱类;苯丙素类;质谱;裂解规律;特征碎片
白背三七(L.) DC为菊科三七草属植物,又名白(百)子菜、富贵菜、大肥牛、鸡菜、菊三七、白背土三七、明月草等,生长于我国台湾省及华南、西南等地区的阴暗湿地[1-2]。白背三七的根、茎、叶均可入药,在民间广泛用于治疗支气管炎、肺结核、百日咳、眼痛、牙痛、风湿性关节炎、糖尿病、高血压及高脂血症等[3-7],并于2010年被国家原卫生部批准为新资源食品[8]。
白背三七所含化学成分是一个极其复杂的物质体系,化学成分种类众多,包括黄酮类、生物碱类、苯丙素类、萜类、甾体类、脑苷脂类、酚酸类等,含量和性质差异大,药效成分和毒性成分还有待进一步深入研究。近年来,白背三七被证实具有改善胰岛素抵抗[9]、降血糖[10]、减少肾组织纤维化、减轻心脏肥大水平、降血压[11]等药理活性。白背三七中存在吡咯里西啶类生物碱(pyrrolizidine alkaloids,PAs),多个研究小组证实PAs经过肝脏细胞代谢转化成亲电性的代谢物,可与亲核性生物大分子如DNA发生反应造成DNA功能异常,产生肝毒性[12-14]。因此,有必要对白背三七中的化学成分进行深入分析,为阐释药效成分和毒性成分奠定基础。
植物化学成分分析有多种方法,其中超高效液相色谱串联高分辨质谱法,如超高效液相色谱串联四级杆飞行时间质谱法(UHPLC-QTOF/MS)[15]和超高效液相色谱串联四极杆静电场轨道阱质谱法(UHPLC-QE/MS)以高灵敏度、高分辨率,并能提供丰富结构信息的优点,成为植物化学成分分析的主要方法之一[16-20]。采用这种方法,研究人员可以通过高分辨质谱提供的精确准分子离子峰和二级质谱信息,并结合各种质谱数据分析平台(如分子网络[21])分析出植物所含化学成分的可能结构。然而,通过二级质谱分析结构需要掌握已有成分的质谱裂解规律,并熟练应用该规律进行其他结构类似物的分析。本文全面整理了白背三七中已报道的70余种化学成分,并归纳整理了白背三七所含各类化学成分的质谱裂解规律,为相关领域科研工作者分析和掌握白背三七的化学成分提供参考。
1 黄酮类
黄酮类化合物广泛存在于自然界植物中,是一种重要的次生代谢产物,在植物生长、发育、结果等多方面起重要作用[22]。黄酮类化合物广泛分布于以白背三七为代表的菊科植物中[23-28]。白背三七中总黄酮含量显著高于同科植物红凤菜和杭白菊,其中以叶部总黄酮含量最高[29]。到目前为止,已从白背三七中分离鉴定出15种黄酮类成分[10-11,30-34],如表1和图1所示。白背三七中所含黄酮类化合物大多为黄酮醇类化合物,以2-苯基-3-羟基-色原酮(如山柰酚和槲皮素)为基本母核。母核3、7位的羟基易与葡萄糖、乙酰化葡萄糖基、半乳糖、芸香糖等形成单糖苷或双糖苷。

表1 白背三七中的黄酮类成分
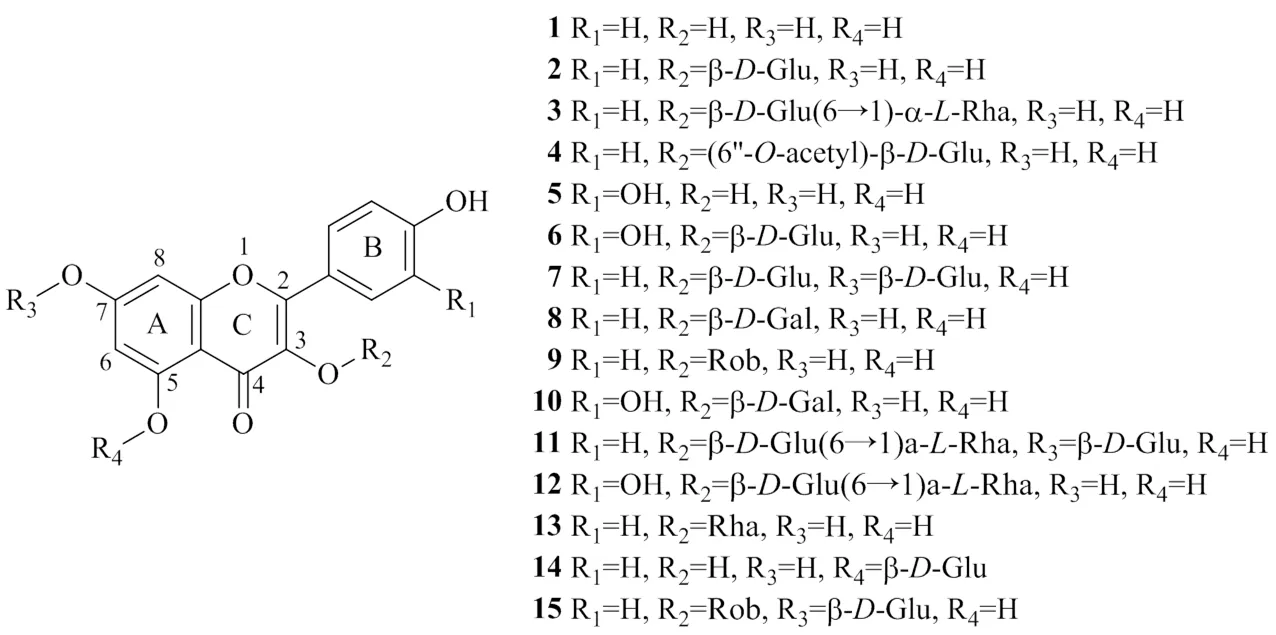
图1 白背三七中黄酮类成分的化学结构
现代质谱技术广泛应用于黄酮类化合物的结构分析[35],较多文献报道了黄酮类化合物的质谱裂解规律[36-38]。白背三七所含黄酮醇类化合物在诱导碰撞解离中易发生各种糖基的中性丢失,如丢失葡萄糖、半乳糖、鼠李糖、芸香糖,分别对应162、162、146、308的中性丢失。此外,在其他植物来源的黄酮类化合物中,还常见阿拉伯糖(132)、木糖(132)等五碳糖的中性丢失[38]。
黄酮苷丢失糖基后,形成相应的苷元离子[38]。白背三七黄酮醇类化合物主要发生C环的RDA裂解,还包括脱H2O和CO等中性丢失[39-40]。采用文献报道的命名方法,白背三七中的黄酮醇类化合物可产生1,3A、1,2A、0,2A、1,4A、0,4A等RDA裂解碎片[37,40-41]。代表性黄酮醇类化合物芦丁的裂解途径见图2[41],首先发生芸香糖的中性丢失[M-H-308]−,生成301的碎片离子,即槲皮素离子。槲皮素离子继续发生C环1、3位的RDA裂解,生成151的1,3A−离子;此外,还可发生C环1、2位,0、2位,1、4位,0、4位的RDA裂解,分别生成1,2A−(179)、0,2A−(163)、1,4A−(125)、0,4A−(107)的碎片离子。1,2A−含相邻取代的2个羰基,易脱去CO生成1,3A−,该碎片进一步脱去CO2生成0,4A−;0,2A−也含有类似结构,可中性丢失2分子CO生成0,4A−。除RDA裂解外,槲皮素分子离子还可发生中性碎片(H2O、CO、CO2)丢失,生成/283、273、257等碎片离子。

图2 芦丁的质谱裂解途径
2 生物碱类
生物碱是指存在于生物体内的含氮有机化合物,是一类重要的次生代谢产物。到目前为止,已从白背三七中分离鉴定出11种生物碱,其中包括6种PAs(16~21)、2种吡嗪类生物碱(22、23)、3种吡啶羧酸类生物碱(24~26)[10,42-43],见表2和图3。白背三七中的PAs为1,2-不饱和型,由双稠吡咯环(裂碱)和植物中的有机酸(裂酸)酯化形成。白背三七中的PAs裂碱部分由倒千里光裂碱型和奥托千里光裂碱型2种结构构成,裂碱上的羟基常被酯化形成12元大环双酯,环上取代基包括甲基、羟基、乙烯基等。

表2 白背三七中的生物碱类成分

图3 白背三七中生物碱类成分的化学结构
PAs作为白背三七生物碱的代表性成分,主要为倒千里光裂碱型12元大环双酯结构,可发生化学键的特征裂解,产生12元环特征性碎片离子,因含倒千里光裂碱型PAs,还可产生/138、120、94的特征性碎片离子[44-45]。如图4所示[46],336的全缘千里光碱分子离子,C9-O10与C13-C14化学键断裂产生220的碎片离子,该离子继续裂解产生138的碎片离子,138的碎片离子因双稠吡咯环上含有羟基,可脱去1分子水生成120的特征性碎片离子,再中性丢失2个亚甲基生成94的特征性碎片离子。白背三七中的吡啶类生物碱母核上含羧基取代,容易发生CO2(44)的中性丢失,生成80的碎片离子。白背三七中的吡嗪类生物碱,侧链含较多羟基,容易发生γ-断裂和脱水重排。

图4 全缘千里光碱的质谱裂解途径
3 苯丙素类
苯丙素类化合物是指母核含1个或几个C6-C3单元的天然有机化合物类群,在植物的生长调节和抗御病害方面起到不可缺失的作用。根据结构差异可将苯丙素类化合物分为苯丙酸类、香豆素类、木脂素类等。目前,已从白背三七中分离鉴定出17种苯丙素类成分[11,32,34,43,47-49],见表3和图5,这些大都为苯丙酸类化合物(如咖啡酸、阿魏酸、对香豆酸),可与1分子奎宁酸脱水缩合成单酯或双酯,常见二咖啡酰基取代奎宁酸酯。此外,咖啡酸奎宁酸酯还可与甲醇或乙醇脱水缩合成甲酯或乙酯。已从白背三七中分离鉴定出的香豆素类化合物种类较少,以苯骈α-吡喃酮为基本母核,多发生6、7位取代,取代基一般为羟基和甲氧基。已从白背三七中分离鉴定出的木脂素类化合物为双环氧木质素,有单糖基取代。

表3 白背三七中的苯丙素类成分

图5 白背三七中苯丙素类成分的化学结构
近年来,已有较多文献报道运用质谱法对苯丙素类化合物进行定性分析。苯丙酸类化合物酯键在碰撞诱导解离中易断裂,产生相应的苯丙酸和奎宁酸碎片离子,奎宁酸分子离子常发生脱H2O(18)、CO2(44)的中性丢失[50]。如图6所示[51],353的绿原酸分子离子酯键裂解,中性丢失咖啡酰基,产生191的奎宁酸分子离子,奎宁酸分子离子进一步中性丢失H2O,产生173的碎片离子;同时也可发生脱氧奎宁酸的中性丢失,产生179咖啡酸的分子离子,该离子中性丢失H2O和CO2分别生成161、135的碎片离子。此外,白背三七中的苯丙酸类化合物还可发生CH3、CO2、OCH2的中性丢失[52],如193阿魏酸分子离子中性丢失CO2、CH3生成149、178的碎片离子[53]。

图6 绿原酸的质谱裂解途径
综上,179、161、135的碎片离子可作为咖啡酰基的特征性碎片离子[54-56];193、175、160和163、119的碎片离子可分别作为阿魏酰基和对香豆酰基的特征性碎片离子[56-58]。此外,香豆素类化合物还可发生CO、CH3中性丢失[59]。白背三七中的木质素苷可发生C-O-C糖苷键裂解,丢失1分子葡萄糖,产生[M-H-162]−的碎片离子。
4 核苷类
核苷类化合物是指含氮碱基与糖缩合成的糖苷类化合物,是植物生命活动中不可缺少的化合物。目前,已从白背三七中分离鉴定出2种核苷类成分[33],分别为尿苷(44)和腺苷(45),糖基部分为核糖,化学结构见图7。
核苷类化合物的核糖和碱基通过-糖苷键连接在一起,-糖苷键易裂解,可中性丢失脱氧核糖(116)或核糖(132),产生相应的质子化碱基离子[60-61]。质子化的核苷离子和碱基离子是鉴别核苷的特征离子。白背三七中的腺苷在碰撞诱导解离条件下生成268的分子离子,-糖苷键易裂解,中性丢失1分子核糖(132),生成136的碱基离子,相应的245、113可作为鉴别尿苷的特征性离子[60,62]。此外,244、112、284和152、243、117可分别作为胞苷、鸟苷和胸苷的特征鉴别离子[63]。-糖苷键裂解后,质子化的碱基离子还可继续开环,产生中性丢失NH3、HCN等,如图8所示[64],腺苷分子离子发生132的中性丢失,生成腺嘌呤碱基离子,继续发生含氮六元环的开环,分别丢失NH3、NH2CN,生成/119、94的碎片离子。

图7 白背三七中核苷类成分的化学结构
5 甾体类
甾体类化合物是一类具有环戊烷骈多氢菲母核结构的化合物[65],由甲戊二羟酸途径转化而来,具有显著的生物活性,存在于很多菊科植物中。根据C17-R侧链取代基的不同,可分为C21甾类、强心苷类和植物甾醇类等多种类型。到目前为止,已从白背三七中分离鉴定出5种甾体类成分[30,33-34,43],如表4和图9所示,这些结构大都为植物甾醇类化合物,C17-侧链具有10个碳,根据侧链C22-C23位是否有双键又可进一步分为豆甾醇类和β-谷甾醇类化合物。C3-OH可与糖基脱水形成苷,已在白背三七中报道过的甾体类化合物既有以游离的形式存在,也有与糖形成苷的形式存在。此外,在白背三七中,甾体皂苷糖元基团还可与长链脂肪酸脱水成酯。

图8 腺苷的质谱裂解途径

表4 白背三七中的甾体类成分
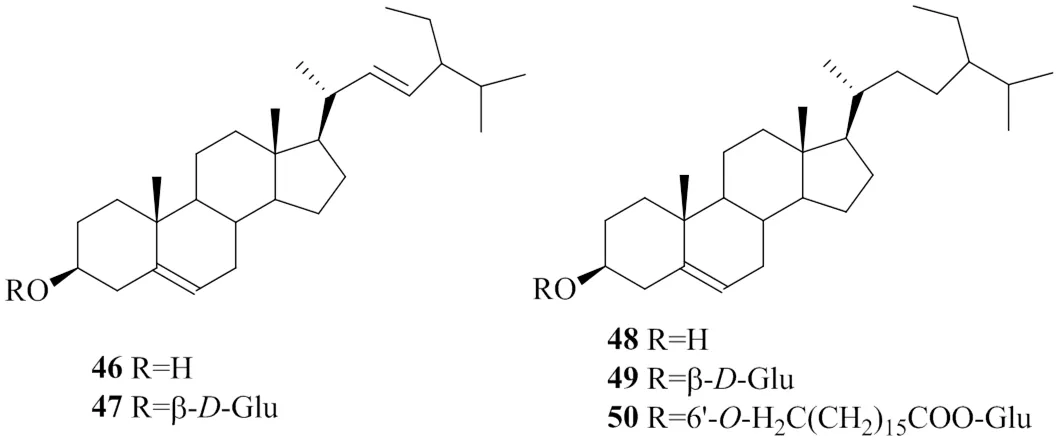
图9 白背三七中甾体类成分的化学结构
甾醇类化合物在碰撞诱导解离条件下会产生一些特征性碎片离子。白背三七中的甾醇类化合物,甾核C环易发生裂解,生成147、161等特征碎片离子。此外,因C3位羟基易脱水形成[M-H2O+H]+离子。如图10所示[66-67],白背三七中的β-谷甾醇C3-OH脱水生成397的碎片离子,甾核的C环裂解,产生161、148的碎片离子,148的离子也可裂解产生109、81的碎片离子。
6 三萜及倍半萜类
萜类化合物是指存在自然中,分子式为异戊二烯倍数的化合物及其衍生物的总称[68]。在植物生命活动中,萜类化合物具有重要的作用,如四萜类化合物叶黄素是重要的光合色素[69]。萜类化合物广泛分布于菊科植物中[70-73]。根据分子结构中异戊二烯单位的数目可分为单萜、倍半萜、二萜、二倍半萜等[68]。到目前为止,已从白背三七中分离鉴定出4种萜类成分[2,33,49],化学成分及结构如表5和图11所示,这些结构大都以五环三萜类的木栓烷型骨架为基本母核,环内无双键取代,分子之间结构差异较小。

图10 β-谷甾醇的质谱裂解途径

表5 白背三七中的萜类成分

图11 白背三七中萜类成分的化学结构
白背三七中的萜类化合物主要为木栓烷型五环三萜,环上含较多甲基,可发生CH4、CH2中性丢失。在GC-MS中木栓酮的分子离子,先发生CH2的中性丢失,生成411的碎片离子,再连续多次发生CH2中性丢失,生成341的碎片离子[74],再进一步裂解产生123、109、95、69的碎片离子[68,75,76]。白背三七中的表木栓醇因C3-OH分子离子常以411 [M+H-H2O]+形式存在,再进一步裂解产生205的特征碎片离子[77-78]。
7 脑苷脂类
脑苷脂是细胞膜的重要组成部分,是参与多种细胞活动的重要信号分子。2009年,Chen等[1,3]从白背三七中分离鉴定出2种脑苷脂类化合物(2,3,4,10)-2-(2′-羟基二十三碳酰氨基)十八烷-3,4-二醇-1--葡萄糖苷(55)、(2,3,4,10)-2-(2′-羟基二十四碳酰氨基)十八烷-3,4-二醇-1--葡萄糖苷(56),化学结构见图12,2种脑苷脂类化合物的结构相似,酰基鞘氨醇以-糖苷键结合一分子葡萄糖。2种化合物在碰撞诱导解离条件下,裂解规律相似。如图13所示,844的脑苷脂分子离子,糖苷键易裂解,可发生162的中性丢失,生成682的碎片离子,进一步发生α裂解,生成456的碎片离子,该离子含γ-H,易发生麦氏重排生成384的碎片离子。含酰胺键结构,易发生酰胺键裂解,生成478的碎片离子,该离子糖苷键断裂,生成结构中含多个羟基的碎片离子316,再依次脱水,生成298、280、262的碎片离子。
8 酸和酯类
酸和酯类化合物广泛存在于自然界的植物中,具有重要的生理功能,如水杨酸在植物的诱导开花、种子萌发等多种生理过程的调控中起重要作用[79]。目前,已从白背三七中分离鉴定出10种酸和酯类化合物[30,43,48-49],如表6和图14所示,可分为芳香酸和脂肪酸2个亚类,芳香酸类化合物主要为水杨酸、异香草酸、对羟基苯甲酸。脂肪酸类化合物大多为丁二酸与甲醇与乙醇形成的酯类结构,少见内酯结构。
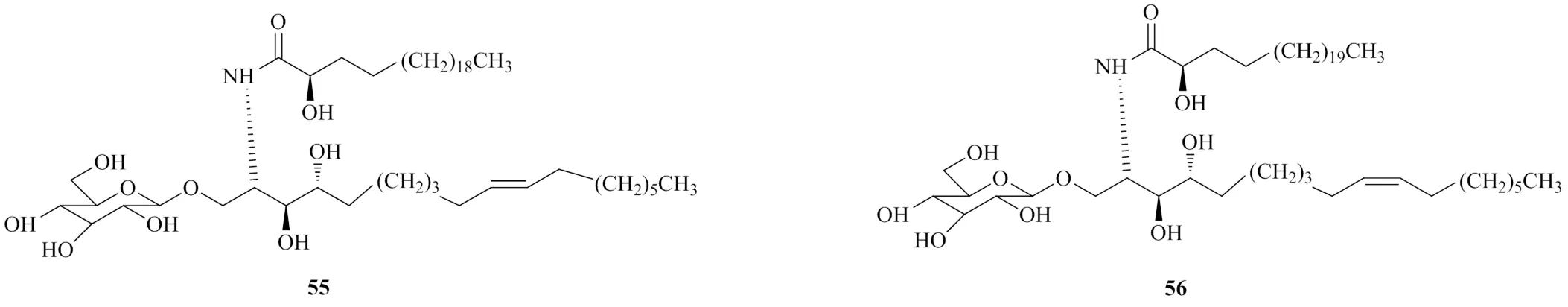
图12 白背三七中脑苷脂类成分的化学结构

图13 脑苷脂类成分的质谱裂解途径
白背三七中酸酯类化合物在诱导碰撞解离条件下,芳香族及其酯类化合物生成的分子离子峰峰强度比脂肪酸及其酯类化合物更强。羧酸及其酯类化合物易发生α-裂解,中性丢失R或OR1基团,再进一步中性丢失CO,生成[R+H]+和[OR1+H]+碎片离子,其机制如图15所示。具有γ-H的酸和酯类化合物,能发生McLafferty重排[80]。
9 烷烃类化合物及其衍生物
到目前为止,已从白背三七中分离鉴定出9种烷烃类化合物及其衍生物[2,81],见表7,为一些常见的烃类化合物及其衍生物,如亚麻酸、亚油酸等,皆为碳原子数目大于16的直链烷烃。

表6 白背三七中的酸和酯类成分

图14 白背三七中酸和酯类成分的化学结构
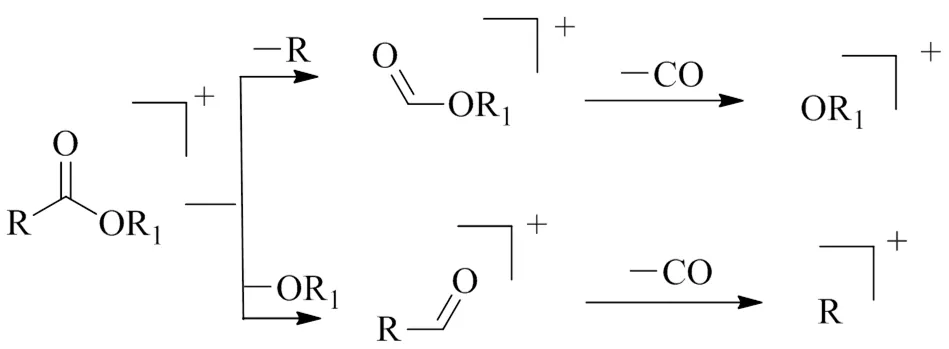
图15 酸和酯类成分的质谱裂解途径
烃类化合物在诱导碰撞解离条件下的裂解规律也较简单。直链烷烃分子离子峰强度弱,分子离子中C-C键容易发生裂解,可发生甲基、乙基、丙基和丁基等中性丢失,在质谱图中常表现为出现一系列[M+H-15]+、[M+H-29]+、[M+H-43]+、[M+H-57]+等的碎片离子峰。烯烃双键易失去π电子,形成较强的分子离子峰,基峰为双键α、β位的C-C键裂解产生的碎片离子峰,裂解规律与直链烷烃相似。

表7 白背三七中已报道的烷烃类化合物
10 其他
除了上述几大类化合物,还在白背三七中分离鉴定出2种其他种类的化合物姜油酮-4--葡萄糖苷(76)、caryolane-1,9-β-diol(77)[49],化学结构见图16。

图16 白背三七中其他类成分的化学结构
11 结语
白背三七作为一种民间广泛使用的药食两用植物,已在其中发现了黄酮类、生物碱类、苯丙素类、甾类等70余种化学成分。白背三七中的黄酮类成分大都以山柰酚和槲皮素为基本母核,常以-糖苷键形成单糖苷或双糖苷,在诱导碰撞解离条件下发生C环RDA反应,生成特征性碎片1,3A、1,2A等;生物碱类化合物主要为PAs,为白背三七的特征性生物碱,可发生12元环特征性裂解产生220、138、120、106、94的碎片离子;苯丙素类化合物大都为苯丙酸类化合物,常与奎宁酸脱水成酯,在ESI电离条件下,可发生脱氧奎宁酸的中性丢失,生成相应的苯丙酸碎片离子;已在白背三七中报过的甾体类化合物主要为豆甾醇、β-谷甾醇及其衍生物,甾核C环易裂解,生成161、148的特征性离子。根据已报道的代表性化学成分,并结合现代质谱技术对白背三七的化学成分进行深入研究,指导白背三七的开发和应用,具有重要的现实意义。
利益冲突 所有作者均声明不存在利益冲突
[1] Chen L, Wang J J, Zhang G G,. A new cerebroside from[J]., 2009, 23(14): 1330-1336.
[2] 李丽梅, 李维林, 郭巧生, 等. 白背三七化学成分研究 [J]. 时珍国医国药, 2008, 19(1): 118-119.
[3] Chen L, Li H, Song H,. A new cerebroside from[J]., 2009, 80 (8): 517-520.
[4] 冼寒梅, 周蓉, 刘雯, 等. 白子菜不同药用部位挥发油的含量测定及其气相色谱-质谱联用分析 [J]. 时珍国医国药, 2008, 19(4): 858-859.
[5] 刘微微, 刘旭, 曹学丽, 等. 白背三七多糖的结构表征及α-葡萄糖苷酶的抑制活性 [J]. 食品科学, 2013, 34(7): 115-120.
[6] 张焕新, 郑义, 殷玲, 等. 白背三七黄酮类化合物的提取及抗氧化性评价 [J]. 江苏农业学报, 2019, 35(4): 933-939.
[7] 接敏. 白背三七黄酮类化合物富集分离及生物活性研究 [D]. 南昌: 南昌大学, 2011.
[8] 王中华, 陈涛. 高效液相色谱法测定白子菜中芦丁的含量 [J]. 天津中医药, 2013, 30(2): 112-114.
[9] Dong X, Zhao S X, Xu B Q,.ameliorates hepatic insulin resistance by modulating insulin signalling, maintaining glycolipid homeostasis and reducing inflammation in type 2 diabetic mice [J]., 2019, 8(6): 928-938.
[10] Xu W, Lu Z, Wang X,.exerts hypoglycemic effects by regulating the PI3K/AKT signaling pathway and fatty acid metabolism signaling pathway [J]., 2020, 10(1): 31.
[11] Hong M H, Jin X J, Yoon J J,. Antihypertensive effects of(L.) DC in rats with renovascular hypertension [J]., 2020, 12(11): 3321.
[12] Prakash A S, Pereira T N, Reilly P E,. Pyrrolizidine alkaloids in human diet [J]., 1999, 443(1/2): 53-67.
[13] Mattocks A R. Toxicity of pyrrolizidine alkaloids [J]., 1968, 217(5130): 723-728.
[14] Moreira R, Pereira D, Valentão P,. Pyrrolizidine alkaloids: Chemistry, pharmacology, toxicology and food safety [J]., 2018, 19(6): 1668.
[15] Ganzera M, Sturm S. Recent advances on HPLC/MS in medicinal plant analysis: An update covering 2011-2016 [J]., 2018, 147: 211-233.
[16] Hu Y Y, Zhang X J, Zhang Z H,. Qualitative and quantitative analyses of quinones in multi-originspecies by ultra-performance liquid chromatography-tandem mass spectrometry combined with chemometrics [J]., 2020, 189: 113471.
[17] Li C, Yang J, Tong X,. Precursor ion scan enhanced rapid identification of the chemical constituents of Danhong Injection by liquid chromatography-tandem mass spectrometry: An integrated strategy [J]., 2019, 1602: 378-385.
[18] Li K, Luo J, Ding T,. Multielements determination and metal transfer investigation in herb medicineby inductively coupled plasma-mass spectrometry [J]., 2018, 6(8): 2005-2014.
[19] Wei W L, An Y L, Zhang Y Z,. Quantitative analysis of fourteen bufadienolides incrude drug and its Chinese patent medicines by ultra-high performance liquid chromatography coupled with tandem mass spectrometry [J]., 2020, 251: 112490.
[20] Zhang J, Xu W, Wang P,. Chemical analysis and multi-component determination in Chinese medicine preparation bupi yishen formula using ultra-high performance liquid chromatography with linear ion trap-orbitrap mass spectrometry and triple-quadrupole tandem mass spectrometry [J]., 2018, 9: 568.
[21] Wang M, Carver J J, Phelan V V,. Sharing and community curation of mass spectrometry data with Global Natural Products Social Molecular Networking [J]., 2016, 34(8): 828-837.
[22] 李元政, 胡文忠, 萨仁高娃, 等黄酮类抗氧化成分及其抗氧化机理研究进展 [A] // 中囯食品科学技术学会第十五届年会论文摘要集 [C]. 青岛: 中国食品科学技术学会, 2018: 510.
[23] 朱少晖, 方月琴. 菊科黄酮类化合物生物活性研究进展 [J]. 品牌, 2014(7): 181-182.
[24] 赵金秀, 安志英, 李壮伟, 等红花药物分析、化学成分及现代药理研究分析 [J]. 世界最新医学信息文摘, 2020, 20 (17): 193-197.
[25] 徐定平, 周鑫堂, 郜红利, 等. 千里光化学成分和药理作用研究进展 [J]. 中国药师, 2014, 17(9): 1562-1565.
[26] 吴琪珍, 张朝凤, 许翔鸿, 等. 款冬花化学成分和药理活性研究进展 [J]. 中国野生植物资源, 2015, 34(2): 33-36.
[27] 刘洪玲. 水飞蓟素的化学成分及药理作用研究进展 [J]. 中国民族民间医药, 2008, 17(7): 23-25.
[28] 韦睿斌, 庞玉新, 杨全, 等. 艾纳香黄酮类化学成分研究进展 [J]. 广东药学院学报, 2014, 30(1): 123-127.
[29] 王玉婵, 黄丽莉, 舒萌, 等. 白子菜不同器官营养与药用成分的测定与分析 [J]. 长江蔬菜, 2011(24): 14-17.
[30] 陈磊, 宋增艳, 王津江, 等. 白背三七地上部分的化学成分研究 [J]. 中草药, 2010, 41(3): 373-375.
[31] 万春鹏, 接敏, 余燕影, 等.HPLC-ESI-MS分析白背三七黄酮苷类化学成分 [A] // 中国化学会第27届学术年会第09分会场摘要集[C]. 厦门: 中国化学会, 2010: 105.
[32] Wan C, Yu Y, Zhou S,. Isolation and identification of phenolic compounds fromleaves [J]., 2011, 7(26): 101-108.
[33] 胡勇, 李维林, 林厚文, 等. 白背三七地上部分的化学成分 [J]. 中国天然药物, 2006, 4(2): 156-158.
[34] Xu B Q, Zhang Y Q. Bioactive components ofand its potential use in health, food and medicine: A mini-review [J]., 2017, 14(3): 113-127.
[35] 鲁林, 石莹, 宋凤瑞, 等. 山柰甲黄素-3,7-二--多取代黄酮苷的串联质谱研究 [J]. 化学学报, 2010, 68(17): 1735-1740.
[36] Liu M H, Tong X, Wang J X,. Rapid separation and identification of multiple constituents in traditional Chinese medicine formula Shenqi Fuzheng Injection by ultra-fast liquid chromatography combined with quadrupole- time-of-flight mass spectrometry [J]., 2013, 74: 141-155.
[37] Ye J B, Ren G, Li W Y,. Characterization and identification of prenylated flavonoids fromLam. roots by quadrupole time-of-flight and linear trap quadrupole orbitrap mass spectrometry [J]., 2019, 24(24): 4591.
[38] Liu X, Fan X, Wang X,. Structural characterization and screening of chemical markers of flavonoids inandby ultra high-performance liquid chromatography quadrupole time-of-flight tandem mass spectrometry based metabolomics approach [J]., 2019, 171: 52-64.
[39] Qu Y, Zhang C, Liu R,. Rapid characterization the chemical constituents ofand explore potential mechanism in treating osteoarthritis by ultra high-performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry combined with network pharmacology [J]., 2020, 43(16): 3333-3348.
[40] Ma Y L, Li Q M, van den Heuvel H,. Characterization of flavone and flavonol aglycones by collision-induced dissociation tandem mass spectrometry [J]., 1997, 11(12): 1357-1364.
[41] 尹智慧, 孙长海, 方洪壮. 槲皮素与桑色素ESI-MS裂解行为的比较分析 [J]. 分析测试学报, 2017, 36(2): 205-211.
[42] Roeder E, Eckert A, Wiedenfeld H. Pyrrolizidine alkaloids from[J]., 1996, 62(4): 386.
[43] 陈磊, 宋增艳, 王津江, 等. 白背三七地上部分化学成分研究 [J]. 中药材, 2010, 33(3): 373-376.
[44] Hungerford N, Carter S, Anuj S,. Analysis of pyrrolizidine alkaloids in Queensland honey: Using low temperature chromatography to resolve stereoisomers and identify botanical sources by UHPLC-MS/MS [J]., 2019, 11(12): 726.
[45] Scupinari T, Mannochio Russo H, Sabino Ferrari A B,.as a source of pyrrolizidine alkaloids and phenolic compounds: HPLC-MS/MS dereplication and monocrotaline quantification of seed and leaf extracts [J]., 2020, 31(6): 747-755.
[46] Prada F, Stashenko E E, Martínez J R. LC/MS study of the diversity and distribution of pyrrolizidine alkaloids inspecies growing in Colombia [J]., 2020, 43(23): 4322-4337.
[47] Chen J, Mangelinckx S, Ma L,. Caffeoylquinic acid derivatives isolated from the aerial parts ofand their yeast α-glucosidase and PTP1B inhibitory activity [J]., 2014, 99: 1-6.
[48] 陈剑, MANGELINCKX Sven, 吕寒, 等. 白子菜醋酸乙酯部位的化学成分研究 [J]. 中草药, 2013, 44(5): 524-527.
[49] 郑锡康, 王琴, 蒋林, 等. 百子菜化学成分的分离与鉴定 [J]. 现代食品科技, 2013, 29(5): 1003-1005.
[50] Mustapa M A, Taupik M, Effendi M H. Identification new derivative clorogenic acid fromwith LCMS method [J]., 2019, 10 (1): 341-347.
[51] Yang B, Li H, Ruan Q F,. A facile and selective approach to the qualitative and quantitative analysis of triterpenoids and phenylpropanoids by UPLC/Q-TOF-MS/MS for the quality control of[J]., 2018, 157: 44-58.
[52] Zhu M, Duan J A, Tang Y P,. Identification of chemical constituents in SiWu Decoction by UHPLC-DAD-TOF/MS [J]., 2014, 26(3): 517-537.
[53] 吴吉洋, 高方圆, 叶晓岚, 等. 创新药物川阿格雷及其拼合分子阿魏酸和川芎嗪的质谱裂解规律 [J]. 第二军医大学学报, 2012, 33(7): 755-758.
[54] Wang Y Q, Guo Z M, Jin Y,. Selective enrichment with “click oligo (ethylene glycol)” column and TOF-MS characterization of simple phenylpropanoids in the fruits of[J]., 2009, 32(17): 2958-2966.
[55] Innocenti M, la Marca G, Malvagia S,. Electrospray ionisation tandem mass spectrometric investigation of phenylpropanoids and secoiridoids from solid olive residue [J]., 2006, 20(13): 2013-2022.
[56] Xie G, Jiang Y, Huang M,. Dynamic analysis of secondary metabolites in various parts ofby liquid chromatography tandem mass spectrometry [J]., 2020, 186: 113307.
[57] Ma C, Xiao S Y, Li Z G,. Characterization of active phenolic components in the ethanolic extract ofL. leaves using high-performance liquid chromatography with diode array detection and tandem mass spectrometry [J]., 2007, 1165(1/2): 39-44.
[58] Liu Y N, Chen C H, Qiu J W,. Characterization of the chemical constituents in Hongjingtian Injection by liquid chromatography quadrupole time-of-flight mass spectrometry [J]., 2019, 33(3): e4446.
[59] Liao Z X, Zhang B B, Ding L S,. Development of an UPLC-QTOF-MS method for qualitative and quantitative analysis of[J]., 2013, 25(1): 171-180.
[60] Liu R, Zhao F, Wei J,. Determination of five nucleosides by LC-MS/MS and the application of the method to quantify6-methyladenosine level in liver messenger ribonucleic acid of an acetaminophen-induced hepatotoxicity mouse model [J]., 2019, 42(16): 2668-2678.
[61] Qu C, Yan H, Zhu S Q,. Comparative analysis of nucleosides, nucleobases, and amino acids in different parts ofby ultra high performance liquid chromatography coupled to triple quadrupole tandem mass spectrometry [J]., 2019, 42(6): 1122-1132.
[62] Pitzer M, Ozga C, Küstner-Wetekam C,. State-dependent fragmentation of protonated uracil and uridine [J]., 2019, 123(16): 3551-3557.
[63] 马阳, 侯娅, 邹立思, 等. 不同产地加工方法太子参核苷类成分Q-TRAP-LC-MS/MS分析 [J]. 中草药, 2015, 46(1): 43-47.
[64] Lu Z, Wang Q, Wang M,. Using UHPLC Q-Trap/MS as a complementary technique to in-depth mine UPLC Q-TOF/MS data for identifying modified nucleosides in urine [J]., 2017, 1051: 108-117.
[65] 法幼华. 甾体化合物的微生物转化 [J]. 微生物学通报, 1980, 7(6): 280-282.
[66] Fasya A G, Millati N, Rahmawati L M,. Isolation and bioactivity of steroids isolates from petroleum ether fraction ofsp [A] // The 8th InternationaL Conference of the Indonesian Chemical Society (ICICS) 2019 [C]. Bogor: Kenya Chemical Society, 2020: 30005.
[67] Simonetti G, Di Filippo P, Pomata D,. Characterization of seven sterols in five different types of cattle feedstuffs [J]., 2021, 340: 127926.
[68] Becker R, Dashbaldan S, Pączkowski C,. Comparison of steroids and triterpenoids in leaf cuticular waxes of selected Polish and Russian cultivars and genotypes of edible honeysuckle [J]., 2019, 30: 238-244.
[69] 汪雨茜, 李大婧, 何伟伟, 等. 高等植物叶黄素合成代谢与调控机制 [J]. 食品工业科技, 2018, 39(15): 322-328.
[70] 钱玺丞, 赵晨星, 张敉. 菊科植物二萜类成分研究进展[J]. 天然产物研究与开发, 2017, 29(8): 1415-1427.
[71] 张秋菊, 张爱华, 孙晶波, 等. 植物体中萜类物质化感作用的研究进展 [J]. 生态环境学报, 2012, 21(1): 187-193.
[72] 杨炳友, 杨春丽, 刘艳, 等. 小蓟的研究进展 [J]. 中草药, 2017, 48(23): 5039-5048.
[73] 马耀玲, 王美娇, 易智聪, 等. 柳蒿中1个新的双倍半萜 [J]. 中草药, 2017, 48(14): 2817-2819.
[74] Salih E Y A, Julkunen-Tiitto R, Lampi A M,.andcontain a broad spectrum of antimycobacterial compounds including ellagitannins, ellagic acid derivatives, triterpenes, fatty acids and fatty alcohols [J]., 2018, 227: 82-96.
[75] Qiao Y J, Zhang J J, Shang J H,. GC-MS-based identification and statistical analysis of liposoluble components in the rhizosphere soils of[J]., 2019, 9(36): 20557-20564.
[76] Falev D I, Kosyakov D S, Ul'Yanovskii N V,. Rapid simultaneous determination of pentacyclic triterpenoids by mixed-mode liquid chromatography-tandem mass spectrometry [J]., 2020, 1609: 460458.
[77] Yin D F, Zhou K, Liu J T,. Development and validation of an LC/MS/MS method for simultaneous determination of shionone and-friedelinol in rat plasma for pharmacokinetic study after oral administration ofextract [J]., 2016, 30(7): 1112-1117.
[78] Yang D Y, Wang S R, Huang X H,. Pharmacokinetic comparison of 15 active compositions in rat plasma after oral administration of raw and honey-processedextracts [J]., 2021, 44(4): 908-921.
[79] Kimbembe R E R, Li G, Fu G,. Proteomic analysis of salicylic acid regulation of grain filling of two near-isogenic rice (L.) varieties under soil drying condition [J]., 2020, 151: 659-672.
[80] Yasumoto R, Matsuda Y, Fujii A. Infrared spectroscopic observation of the McLafferty rearrangement in ionized 2-pentanone [J]., 2020, 22(34): 19230-19237.
[81] 郭巨先, 杨暹. 华南主要野生蔬菜的脂肪酸成分分析 [J]. 中国野生植物资源, 2004, 23(2): 47-50.
Research progress on chemical constituents ofand mass spectrometry-based fragmentation rules of representative components
YE Xin-yuan1, WU Jian-ming1, YANG Jie1, 2, KANTAWONG Fahsai2, KUMSAIYAI Warunee2, ZENG Jing1
1. School of Pharmacy, Southwest Medical University, Luzhou 646000, China 2. Faculty of Associated Medical Sciences, Chiang Mai University, Chiangmai 50200, Thailand
was widely used as an herb medicine or food in the folk, which had the efficacy of clearing heat and cooling blood, activating blood, hemostasis and relieving pain. In previous studies, more than 70 compounds have been reported, including flavonoids, alkaloids, phenylpropanoids, terpenoids, steroids and cerebrosides. Research progress on chemical constituents ofand mass spectrometry-based fragmentation rules of representative components were reviewed in this paper by consulting literatures published at home and abroad in recent years, in order to provide information for further structural research of.
(L.) DC; flavonoids; alkaloids; phenylpropanoids; mass spectrometry; fragmentation rules; characteristic fragments
R282.710.5
A
0253 - 2670(2021)21 - 6687 - 14
10.7501/j.issn.0253-2670.2021.21.028
2021-04-02
四川省科技计划项目(2019YFSY0042)
叶馨源(1998—),女,硕士研究生,从事天然药物化学研究。E-mail: yxinyuan0503@163.com
曾 静(1983—),男,博士,硕士生导师。E-mail: zengjing@swmu.edu.cn
[责任编辑 崔艳丽]

