不同稳定剂对槲皮素纳米晶体外溶出及大鼠体内口服药动学的影响
胡 菲,沈成英,申宝德,朱卫丰,袁海龙*
·药剂与工艺·
不同稳定剂对槲皮素纳米晶体外溶出及大鼠体内口服药动学的影响
胡 菲1, 2,沈成英2,申宝德2,朱卫丰1*,袁海龙2*
1. 江西中医药大学药学院,江西 南昌 330004 2. 空军特色医学中心药学部,北京 100142
制备不同稳定剂修饰的槲皮素纳米晶(quercetin nanocrystals,QT-NCs),探讨稳定剂种类对QT-NCs体外溶出和口服药动学的影响。分别以羟丙甲纤维素E15(HPMC-E15)、普朗尼克F127(F127)和甘草酸(glycyrrhizinic acid,GL)为稳定剂,采用介质研磨法分别制备3种QT-NCs,即QT-NCs/F127、QT-NCs/HPMC E15、QT-NCs/GL,并进行形态、晶型表征,考察其体外溶出及口服药动学。3种稳定剂修饰的QT-NCs的粒径均约为200 nm,PDI约为0.20,扫描电子显微镜显示QT-NCs均呈短棒状及不规则的颗粒状;X射线衍射结果显示QT-NCs均以结晶态存在;体外溶出结果显示,与槲皮素原料药相比,3种稳定剂修饰的QT-NCs的累积溶出度均明显提高,且30 min内累积溶出率QT-NCs/F127 (74.90%)>QT-NCs/GL(59.30%)>QT-NCs/HPMC E15(53.65%);药动学结果显示,与槲皮素原料药相比,3种稳定剂修饰的QT-NCs口服生物利用度均显著提高,且AUC0~呈如下顺序:QT-NCs/E15(78.09±6.05)mg·h/L>QT-NCs/GL (61.72±7.59)mg·h/L>QT-NCs/F127(49.94±9.30)mg·h/L。纳米晶能够显著改善槲皮素的体外溶出及口服生物利用度,稳定剂种类对QT-NCs的体外溶出和口服药动学有显著影响。
纳米晶;稳定剂;槲皮素;体外溶出;药动学;羟丙甲纤维素;普朗尼克;甘草酸
NCs被认为是由少量稳定剂(表面活性剂和/或聚合物)稳定的纯药物结晶纳米粒,平均粒径小于1000 nm,通常在200~500 nm[6]。尽管NCs处方中稳定剂的用量较少,但是其在维持NCs的稳定性中发挥重要作用。稳定剂可吸附在纳米粒表面通过静电排斥和/或空间位阻作用防止纳米粒的聚集与团聚,从而维持NCs的稳定[7-8]。在NCs的制备中,稳定剂的选择通常是基于NCs的粒径大小及物理稳定性,通常以获得粒径小、分布均一且能够维持相对较长时间的纳米粒径的NCs为准[8]。
然而,NCs处方中的一些稳定剂不仅能够维持纳米晶的稳定,还会影响药物的吸收和分布[9-10]。例如,普朗尼克与维生素E聚乙二醇琥珀酸酯可以通过抑制P-糖蛋白(P-glycoprotein,P-gp)活性而促进药物的吸收[8],羟丙甲纤维素较好的肠黏膜黏附作用则可以延长药物在胃肠道的滞留时间而增加药物的吸收的[11]。此外,不同稳定剂会影响药物的溶解及NCs的分散能力而影响难溶性药物NCs的溶出[12],进而影响药物吸收。因此,探索稳定剂种类对难溶性药物NCs体内外行为的影响,研究其影响规律及机制,对于NCs的研究与开发具有重要意义。本研究以槲皮素(quercetin,QT)为模型药物,采用介质研磨法分别制备羟丙甲纤维素E15(HPMC-E15)、普朗尼克F127(F127)和甘草酸(glycyrrhizinic acid,GL)3种稳定剂稳定的QT-NCs,即QT-NCs/HPMC E15、QT-NCs/F127、QT-NCs/GL,通过工艺优化获得相同粒径的QT-NCs,并进行理化性质表征,考察其体外溶出及在大鼠体内的口服药动学,初步探讨不同稳定剂对QT-NCs体外溶出及口服药动学的影响。
1 仪器与材料
LC-20AD型高效液相色谱仪,日本岛津公司;Winner 801型纳米激光粒度仪,济南微纳颗粒仪器股份有限公司;DF-101S型集热式恒温加热磁力搅拌器,北京恒丰长伟科技有限公司;ZRS-8G型智能溶出试验仪,天津市天大天发科技有限公司;BT- 125D型电子天平,赛多利斯科学仪器有限公司;D8 ADVANCEX-射线衍射仪,德国Bruker公司;Lab-1A-50型冻干机,北京博医康实验仪器有限公司;JSM-6510型扫描电子显微镜(SEM),日本电子公司;TGL-16G型型台式离心机,上海安亭科学仪器厂;VORTEX-5型涡旋混合仪,其林贝尔仪器公司。
槲皮素原料药,批号CY160517,陕西慈缘生物技术公司,质量分数≥95%;槲皮素对照品,批号16111201,成都普菲德生物技术公司,质量分数均≥98%;甘草酸,批号190421,北京世纪奥科生物技术有限公司,质量分数≥95.0%;山柰酚对照品,批号17092102,成都普菲德生物技术公司,质量分数均≥98%;F127购自北京凤礼精求商贸有限责任公司;HPMC-E15购自安徽山河药用辅料有限公司;磷酸,天津福晨试剂厂;色谱甲醇,Fisher Chemical公司。
SD大鼠,雄性,体质量为(200±20)g,SPF级,由北京斯贝福生物技术有限公司提供。动物许可证号SCXK(京)2018-0010。动物实验伦理经空军特色医学中心批准,批准号:空特(科研)第2021- 75-PJ01。
2 方法与结果
2.1 QT-NCs的制备
采用介质研磨法制备QT-NCs[13-14]。称取槲皮素原料药40 mg及稳定剂8 mg,置于10 mL西林瓶中,加入4 mL蒸馏水,加入搅拌子及适量直径为0.4~0.6 mm的氧化锆珠子,将西林瓶置于磁力搅拌器上,在一定的转速下搅拌研磨数小时,取出,滤过去除氧化锆珠子,即得QT-NCs混悬液。
【英国《国际核工程》网站2018年9月12日报道】 英国核时代公司(NuGen)近日宣布即将裁员60%以上。该公司是日本东芝公司(Toshiba)的全资子公司,原计划在穆尔赛德建设3台AP1000机组,但未来的工作重点将是支持东芝出售穆尔赛德项目。
2.2 粒径分析
取QT-NCs混悬液适量,加蒸馏水稀释100倍,采用纳米激光粒度仪测定平均粒径及多分散指数(polydispersity index,PDI),平行测定3次,取其平均值。
2.3 工艺优化
固定槲皮素的用量为40 mg;分别以HPMC E15、F127、甘草酸为稳定剂,固定其用量为8 mg,通过单因素实验考察研磨时间、研磨转速以及氧化锆珠子的用量对QT-NCs平均粒径和PDI的影响,结果见表1~3。
表1结果显示,研磨转速由500 r/min增至2000 r/min时,QT-NCs/HPMC E15的平均粒径和PDI均逐步降低,但是继续增大转速未能进一步降低粒径,故确定研磨速度为2000 r/min;平均粒径和PDI均随着研磨时间的延长而降低,12 h时粒径降至200 nm,因槲皮素经长时间研磨易氧化降解,故选择研磨时间12 h;研磨介质从4 mL增加至5 mL对粒径无显著影响,但能降低PDI,但进一步增加其用量,不能继续降低PDI,故选择氧化锆珠子用量为5 mL。因此,QT-NCs/HPMC E15的制备工艺参数为研磨转速2000 r/min、研磨时间12 h、氧化锆珠子用量为5 mL。

表1 研磨转速、时间及氧化锆珠子用量对QT-NCs/HPMC E15的平均粒径和PDI的影响(, n = 3)
与工艺11比较:*<0.05**<0.01
*< 0.05**< 0.01process 11

表2 研磨转速、时间及氧化锆珠子用量对QT-NCs/F127的平均粒径和PDI的影响(, n = 3)
与工艺3比较:**<0.01,表3同
**< 0.01process 3, same as Table 3

表3 研磨转速、时间及氧化锆珠子用量对QT-NCs/GL的平均粒径和PDI的影响(, n = 3)
为了得到与QT-NCs/HPMC E15相同粒径的QT-NCs/F127和QT-NCs/GL,对两者的制备工艺进行优化,结果见表2、3。结果显示,QT-NCs/F127和QT-NCs/GL的粒径和PDI均随着研磨转速的增加而降低,当转速为1500 r/min时,两者的粒径均已达到200 nm,且PDI接近0.20,故而不再继续优化工艺,因此,QT-NCs/F127和QT-NCs/GL的制备工艺参数相同,均为研磨转速1500 r/min、研磨时间2 h、氧化锆珠子用量为4 mL。
2.4 工艺确定及验证
按照“2.3”项下优化的工艺制备3批QT-NCs,并测定其平均粒径及PDI,结果见表4,显示QT- NCs/F127、QT-NCs/GL和QT-NCs/HPMC E15平均粒径均为200 nm,PDI约为0.20。
2.5 形态分析
取QT-NCs/F127、QT-NCs/GL和QT-NCs/HPMC E15适量,适当稀释后,滴于锡箔纸上,室温下自然干燥,槲皮素直接粘于导电胶上,喷金处理后,于SEM下观察其形态,结果见图1。图1-A显示槲皮素呈大小不均匀的棒状结构,粒径为5~20 µm;图1-B~D显示3种QT-NCs均呈短棒状及不规则的颗粒状,粒径均为100~300 nm。

表4 QT-NCs的平均粒径和PDI (, n = 3)

图1 槲皮素原料药 (A)、QT-NCs/HPMC E15 (B)、QT-NCs/ F127 (C)和QT-NCs/GL (D) 的SEM图
2.6 X射线衍射(XRD)分析
取QT-NCs/F127、QT-NCs/GL和QT-NCs/HPMC E15分别置于−20 ℃冰箱冻存12 h后放入冻干机12 h,取出,即得其冻干粉。分别将上述冻干粉和槲皮素原料药进行XRD分析,工作条件:Cu靶,管压40 kV,管电流25 mA,扫描速率2°/min,扫描范围(2)3°~60°,结果见图2。槲皮素在13°及27°处有明显的衍射峰,QT-NCs/F127、QT-NCs/GL和QT-NCs/HPMC E15在此处也有特征衍射峰,但衍射峰形有所减小,这可能是稳定剂的加入及研磨过程共同作用的结果[15-16]。

图2 槲皮素原料药 (A)、QT-NCs/GL (B)、QT-NCs/F127 (C)和QT-NCs/HPMC E15 (D)的XRD图
2.7 体外溶出考察
分别称取槲皮素原料药和QT-NCs冻干粉(均含槲皮素3 mg),以250 mL含0.1%聚山梨酯80的磷酸盐缓冲液(PBS,pH 7.4)为溶出介质[17],转速为100 r/min,温度为(37.0±0.5)℃,分别于投药后1、3、5、10、20、30、60 min取样1 mL,同时补充等温等体积的溶出介质,样品溶液过0.22 μm微孔滤膜后,按以下的色谱条件[18]进样分析:色谱柱为InterSustain C18柱(250 mm×4.6 mm,5 µm),流动相为甲醇-0.1%磷酸水溶液(59∶41),检测波长375 nm,体积流量1.0 mL/min,柱温30 ℃;进样量20 μL。
方法学考察结果显示,槲皮素纳米晶中的其他成分对槲皮素的测定无干扰,表明其专属性良好;精密称定槲皮素对照品2.5 mg,置于25 mL量瓶中,加甲醇溶解并稀释至刻度,得质量浓度为0.10 mg/mL的槲皮素对照品储备液,取其槲皮素对照品储备液,加甲醇依次稀释制得质量浓度分别为0.50、1.00、2.00、4.00、5.00、10.00、20.00 μg/mL的系列对照品溶液,按以上色谱条件进样测定,得回归方程=60 492-5 940.8(2=0.999 8,为槲皮素质量浓度,为峰面积),表明槲皮素在0.50~20.00 μg/mL线性关系良好;仪器的精密度、样品的稳定性及方法重复性良好,RSD均小于2%;加样回收率在97.23%~102.71%,RSD为1.94%;说明该方法可行。
按照上述色谱条件分析溶出样品,计算累积溶出度并绘制累积溶出率曲线,结果见图3。30 min时,槲皮素原料药的累积溶出率为31.22%,而QT- NCs/F127、QT-NCs/ GL、QT-NCs/HPMC E15冻干粉的累积溶出率分别为74.90%、59.30%、53.65%,3种QT-NCs的累积溶出率均显著优于槲皮素原料药,且呈现如下顺序:QT-NCs/F127>QT-NCs/GL>QT-NCs/HPMC E15。

图3 QT-NCs/HPMC E15、QT-NCs/F127、QT-NCs/GL和槲皮素原料药的体外溶出曲线(, n = 3)
2.8 大鼠体内口服药动学研究
2.8.1 色谱条件 色谱柱为InterSustain C18柱(250 mm×4.6 mm,5 µm);流动相为甲醇-0.1%磷酸水溶液(55∶45);体积流量1.0 mL/min;柱温30 ℃;检测波长375 nm;进样量20 μL。
2.8.2 血浆样品的处理[6,18]取大鼠血浆样品200 μL,置1.5 mL离心管中,依次加入50 μL 22.60 μg/mL的山柰酚内标物溶液,25%盐酸200 μL,涡旋90 s混匀,90 ℃水浴中反应15 min,冷却后加无水乙醇350 μL,涡旋90 s混匀,8000 r/min离心10 min,取上清液20 μL,按“2.8.1”项下色谱条件进样分析。
2.8.3 对照品及内标的制备 取0.10 mg/mL槲皮素对照品储备液适量,加甲醇稀释制得质量浓度40.00 μg/mL的槲皮素对照品溶液,备用。另取山柰酚对照品适量,精密称定,置于25 mL量瓶中,加甲醇溶解并稀释至刻度,得质量浓度为226.00 µg/mL的内标储备液,取适量,用甲醇稀释为质量浓度为22.60 µg/mL的内标溶液,备用。
2.8.4 专属性考察 将大鼠空白血浆、空白血浆加适量槲皮素对照品、大鼠给药后血浆样品,参照“2.8.2”项下方法处理(空白血浆内标溶液以同体积甲醇替代),按“2.8.1”项下色谱条件分析,记录色谱图。结果见图4,空白血浆中的内源性物质对槲皮素的测定无干扰,表明方法专属性良好。
2.8.5 线性关系考察 取200 μL空白血浆,精密加入不同质量浓度的槲皮素对照品溶液适量,配制成质量浓度为0.25、1.25、2.50、5.00、10.00、12.50 μg/mL的血浆对照品系列溶液,按“2.8.2”项下方法处理后,再按“2.8.1”项下色谱条件进样测定,记录峰面积。以槲皮素质量浓度()为横坐标、槲皮素的峰面积与内标山奈酚的峰面积比值()为纵坐标进行线性回归,得回归方程为=0.139 9+0.016 8,2=0.999 3。结果表明槲皮素在0.25~12.50 μg/mL线性关系良好。
2.8.6 精密度试验 配制1.25、5.00、12.50 μg/mL的低、中、高质量浓度的血浆样品,按“2.8.2”项下方法处理后,再按“2.8.1”项下色谱条件进样测定,平行测定3次,计算日内精密度,连续测定3 d,计算日间精密度,结果表明日内精密度RSD分别为3.35%、1.22%、0.57%;日间精密度RSD分别为2.59%、0.40%、0.38%;结果表明精密度良好。
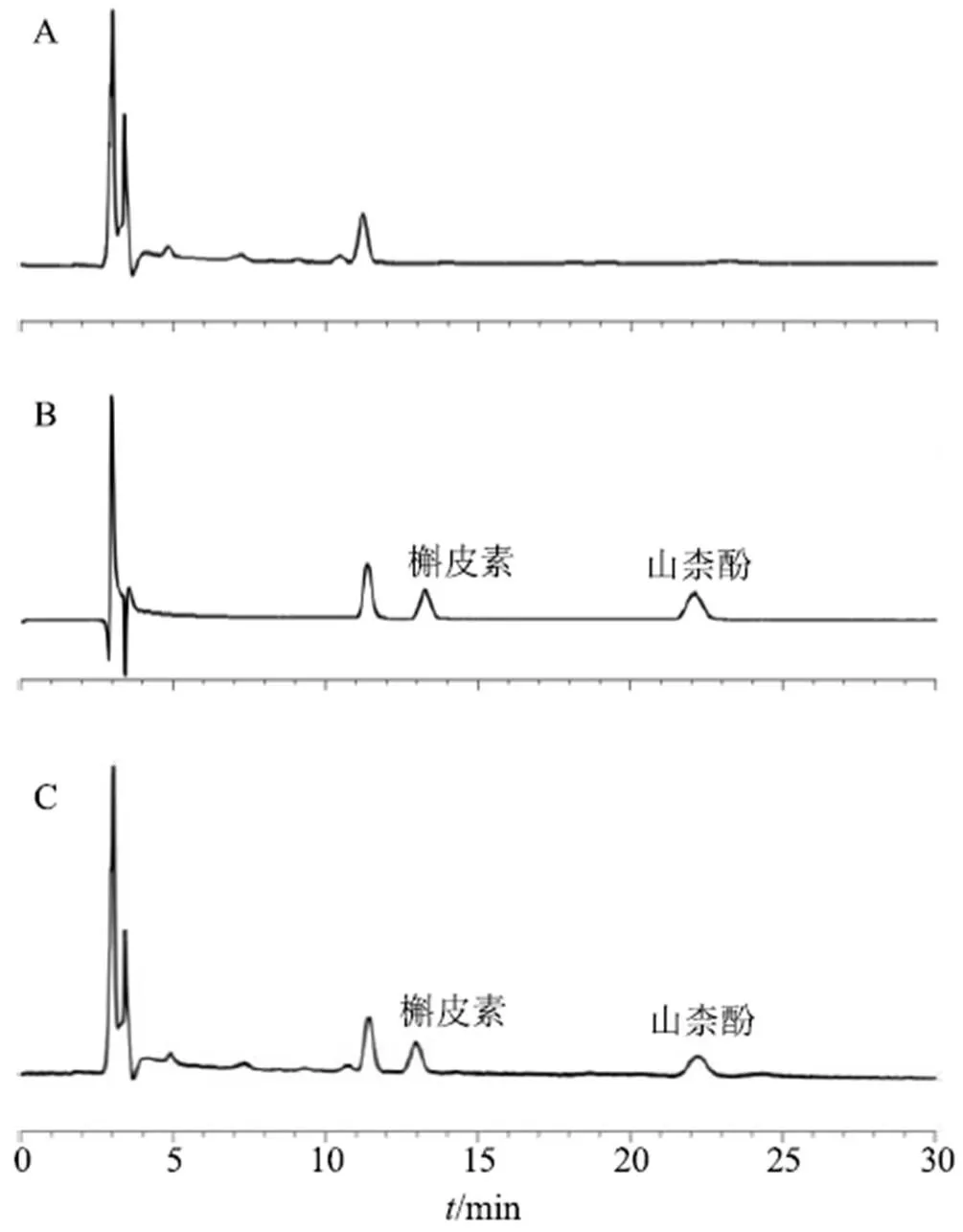
图4 空白血浆(A)、空白血浆+槲皮素对照品(B)、含药血浆(C)的专属性考察HPLC图
2.8.7 稳定性试验 配制1.25、5.00、12.50 μg/mL的低、中、高质量浓度的血浆样品,按“2.8.2”项下方法处理后,分别于室温放置0、2、4、8、12、24 h,再按“2.8.1”项下色谱条件进样测定,计算槲皮素浓度,结果显示槲皮素质量浓度的RSD分别为1.02%、1.48%、1.94%,表明血浆样品在24 h内稳定。
2.8.8 提取回收率试验 配制含1.25、5.00、12.50 μg/mL的低、中、高质量浓度的血浆样品,每个质量浓度平行制备3份,按“2.8.2”项下方法处理后,按“2.8.1”项下色谱条件分析。取与上述3种质量浓度相同的槲皮素对照品溶液,按“2.8.1”项下色谱条件分析,以槲皮素对照品溶液的峰面积为标准,计算槲皮素在相应质量浓度的血浆样品中的提取回收率。结果表明低、中、高3个质量浓度的血浆样品中槲皮素的平均提取回收率分别为96.24%、96.17%、97.15%,RSD分别为3.28%、1.04%、0.56%,符合要求。
2.8.9 药动学研究 取雄性SD大鼠24只,分为4组:QT-NCs/F127组、QT-NCs/E15组、QT-NCs/GL组和槲皮素原料药组,每组6只,实验前禁食不禁水12 h。大鼠分别ig QT-NCs/F127、QT-NCs/E15、QT-NCs/GL混悬液或槲皮素原料药混悬液,剂量100 mg/kg,然后分别于给药后0.083、0.25、0.5、1、2、4、8、12、24 h眼眶取血0.5 mL,置于1.5 mL肝素钠浸润过的离心管内,5000 r/min离心10 min分离血浆,按照“2.8.2”项下方法处理后,再按“2.8.1”项下色谱条件分析,计算槲皮素的血药浓度,绘制药-时曲线,结果见图5;采用DAS 2.0软件计算药动学参数,结果见表5。
由图5可知,大鼠口服QT-NCs/F127、QT-NCs/ E15和QT-NCs/GL混悬液后,槲皮素血药浓度均显著高于槲皮素原料药组。由表5可知,与槲皮素原料药组比较,QT-NCs/F127、QT-NCs/GL和QT-NCs/ HPMC E15 3组的AUC0~t和max均显著增加(<0.01);3组QT-NCs的AUC0~t呈现如下顺序QT- NCs/HPMC E15>QT-NCs/GL>QT-NCs/F127,而max则呈相反顺序。此外,QT-NCs/HPMC E15的MRT0~t、max以及1/2z均显著高于QT-NCs/F127 (<0.05、0.01)。

图5 QT-NCs/HPMC E15、QT-NCs/F127、QT-NCs/GL和槲皮素原料药的药-时曲线(, n = 6)

表5 QT-NCs/HPMC E15、QT-NCs/F127、QT-NCs/GL和槲皮素原料药的主要药动学参数(, n = 6)
与槲皮素原料药组比较:**<0.01;与QT-NCs/HPMC E15组比较:#<0.05##<0.01
**< 0.01raw quercetin group;#< 0.05##< 0.01QT-NCs/HPMC E15 group
3 讨论
课题组前期已经研究了粒径对QT-NCs体外溶出及口服吸收的影响[18-19]。本研究在前期研究的基础上,进一步探讨稳定剂对QT-NCs体外溶出及口服吸收的影响。根据不同稳定剂具有的生物活性[8],预实验考察了SDS、PVP K30、F127、HPMC E15及甘草酸等多种稳定剂对QT-NCs平均粒径及PDI的影响,结果显示只有F127、HPMC E15和甘草酸可以制备得到相对稳定且粒径均一QT-NCs。此外,为了排除粒径、形态、晶型等因素对研究结果的影响,本研究以粒径及PDI为评价指标,采用相同的介质研磨法制备QT-NCs/F127、QT-NCs/HPMC E15、QT-NCs/GL,并通过单因素实验优化工艺,以获得相同粒径的QT-NCs,并通过SEM及XRD确认其形态及晶型的相似性。
体外溶出结果显示,QT-NCs/HPMC E15、QT-NCs/F127和QT-NCs/GL冻干粉均显著改善了QT的累积溶出度;这主要是因为药物粒径的显著减小可以增加其比表面积及表观溶解度,同时降低其扩散层厚度,从而有利于药物溶出[6]。QT-NCs/ HPMC E15、QT-NCs/F127和QT-NCs/GL 3者累积溶出度存在差异,呈现如下顺序:QT-NCs/F127>QT-NCs/GL>QT-NCs/HPMC E15,这主要是因为稳定剂增溶能力及维持QT-NCs冻干粉再分散能力的不同导致。QT-NCs溶出度的测定使用的是其冻干粉,而在QT-NCs的冻干过程没有额外添加冻干保护剂,主要依靠稳定剂的保护作用;由于稳定剂对QT-NCs冻干保护作用不同,导致其冻干粉的再分散性不同,溶出存在差异[20]。此外,不同稳定剂对药物的增溶能力的差异也是导致QT-NCs体外溶出的不同原因。
药动学结果显示,QT-NCs/HPMC E15、QT- NCs/F127和QT-NCs/GL的口服生物利用度明显优于槲皮素原料药混悬液,槲皮素纳米化后生物利用度的提高可以归因于其溶出度的改善、纳米粒的肠道黏附及整体肠吸收[18-19]。QT-NCs/HPMC E15、QT-NCs/F127和QT-NCs/GL 3者的药动学参数存在显著差异,表明稳定剂种类可能会影响药物的口服吸收及体内驻留,这与所选稳定剂对外排转运体活性及细胞渗透性等的影响有关[8,21];HPMC E15较好黏膜黏附能力[11],可以增加QT-NCs在小肠壁的黏附,延长滞留时间,从而显著增加QT-NCs的小肠吸收;F127及甘草酸代谢产物甘草次酸均具有P-gp抑制作用[8,22],且甘草酸还可以增强细胞膜的渗透性[22],3种稳定剂对外排转运体活性及细胞渗透性作用的强弱可能是其药动学参数存在差异的主要原因。此外,QT-NCs/HPMC E15、QT-NCs/F127和QT-NCs/GL的AUC0~t呈现出与体外溶出度相反的顺序:QT-NCs/HPMC E15>QT-NCs/GL>QT- NCs/F127,这主要是因为溶出度测试使用的是冻干粉,由于未加冻干保护剂,QT-NCs冻干后粒径已经不一致;且溶出度主要受QT-NCs冻干粉的粒径、3种稳定剂的增溶能力及及其维持QT-NCs冻干粉再分散能力的影响。而药动学使用的是粒径一致QT-NCs混悬液,其吸收差异受药物溶出和稳定剂活性的双重影响,因此3种QT-NCs的溶出和AUC0~t表现出不同的顺序。
综上,纳米晶可以显著改善难溶性天然产物槲皮素体外溶出和口服生物利用度。稳定剂种类可以显著影响槲皮素的体外溶出行为与口服吸收及体内驻留。然而,本研究仅探索了3种稳定剂的对一种模型药物纳米晶的体外溶出及口服药动学的影响。未来可以研究更多稳定剂对不同难溶性药物纳米晶体内外行为的影响,以探索稳定剂种类对难溶性药物纳米晶体内外行为影响的规律。此外,还可通过药物与稳定剂的相互作用及稳定剂对外排转运体活性及细胞膜渗透性等的影响研究,探索稳定剂种类对难溶性药物纳米晶内外行为的影响机制,以更好的推动纳米晶制剂的设计与开发。
利益冲突 所有作者均声明不存在利益冲突
[1] Mohammad I S, Hu H, Yin L,. Drug nanocrystals: Fabrication methods and promising therapeutic applications [J]., 2019, 562: 187-202.
[2] Lai F, Schlich M, Pireddu R,. Nanocrystals as effective delivery systems of poorly water-soluble natural molecules [J]., 2019, 26(24): 4657-4680.
[3] 申宝德, 沈成英, 徐玲霞, 等. 难溶性中药纳米混悬剂的体内外行为研究进展 [J]. 中国中药杂志, 2018, 43(19): 3828-3833.
[4] Liu T, Yu X, Yin H,. Advanced modification of drug nanocrystals by using novel fabrication and downstream approaches for tailor-made drug delivery [J]., 2019, 26(1): 1092-1103.
[5] Gigliobianco M R, Casadidio C, Censi R,. Nanocrystals of poorly soluble drugs: Drug bioavailability and physicochemical stability [J]., 2018, 10(3): 134.
[6] Shen B, Wu N, Shen C,. Hyperoside nanocrystals for HBV treatment: Process optimization,andevaluation [J]., 2016, 42(11): 1772-1781.
[7] Yang H, Kim H, Jung S,. Pharmaceutical strategies for stabilizing drug nanocrystals [J]., 2018, 24(21): 2362-2374.
[8] Tuomela A, Hirvonen J, Peltonen L. Stabilizing agents for drug nanocrystals: Effect on bioavailability [J]., 2016, 8(2): E16.
[9] Liu Q Y, Guan J, Sun Z,. Influence of stabilizer type and concentration on the lung deposition and retention of resveratrol nanosuspension-in-microparticles [J]., 2019, 569: 118562.
[10] Liu Y, Ma Y Q, Xu J N,. Apolipoproteins adsorption and brain-targeting evaluation of baicalin nanocrystals modified by combination of Tween80 and TPGS [J]., 2017, 160: 619-627.
[11] Fu Q, Li B, Zhang D,. Comparative studies of thedissolution andpharmacokinetics for different formulation strategies (solid dispersion, micronization, and nanocrystals) for poorly water-soluble drugs: A case study for lacidipine [J]., 2015, 132: 171-176.
[12] 程佳慧, 刘喜纲, 常金花, 等. 不同稳定剂种类对齐墩果酸纳米混悬剂溶出度的影响 [J]. 中国医院药学杂志, 2020, 40(22): 2327-2331.
[13] 申宝德, 连王权, 沈成英, 等. 微型化介质研磨法制备难溶性黄酮类化合物纳米混悬剂 [J]. 中草药, 2017, 48(21): 4413-4418.
[14] 刘肖, 刘娟, 庞建云, 等. 微型化介质研磨法制备槲皮素纳米混悬剂 [J]. 中国中药杂志, 2017, 42(15): 2984-2988.
[15] Liu X, Ba D S, Shen C Y,. Nanoparticle-loaded gels for topical delivery of nitrofurazone: Effect of particle size on skin permeation and retention [J]., 2018, 45: 367-372.
[16] Shen C Y, Ba D S, Liu X,. Nanosuspensions based gel as delivery system of nitrofurazone for enhanced dermal bioavailability [J]., 2018, 43: 1-11.
[17] Qiao Y H, Cao Y P, Yu K K,. Preparation and antitumor evaluation of quercetin nanosuspensions with synergistic efficacy and regulating immunity [J]., 2020, 589: 119830.
[18] Shen B D, Shen C Y, Zhu W F,. The contribution of absorption of integral nanocrystals to enhancement of oral bioavailability of quercetin [J]., 2021, 11(4): 978-988.
[19] Shen C Y, Yang Y Q, Shen B D,. Self-discriminating fluorescent hybrid nanocrystals: Efficient and accurate tracking of translocation via oral delivery [J]., 2017, 10(1): 436-450.
[20] Yue P F, Li Y, Wan J,. Study on formability of solid nanosuspensions during nanodispersion and solidification: I. Novel role of stabilizer/drug property [J]., 2013, 454(1): 269-277.
[21] Selyutina O Y, Polyakov N E. Glycyrrhizic acid as a multifunctional drug carrier - From physicochemical properties to biomedical applications: A modern insight on the ancient drug [J]., 2019, 559: 271-279.
[22] 罗子宸, 张雯, 杨瑞, 等. 甘草“调和诸药”生物药剂学机制的研究进展 [J]. 中草药, 2021, 52(1): 267-277.
Effect of different stabilizers ondissolution and oral pharmacokinetics of quercetin nanocrystals in rats
HU Fei1, 2, SHEN Cheng-ying2, SHEN Bao-de2, ZHU Wei-feng1, YUAN Hai-long2
1. College of Pharmacy, Jiangxi University of Chinese Medicine, Nanchang 330004, China 2. Department of Pharmacy, Air Force Medical Center, PLA, Beijing 100142, China
To prepare quercetin nanocrystals (QT-NCs) modified by different stabilizers and explore the effects of different stabilizers ondissolution and oral pharmacokinetics of QT-NCs.QT-NCs stabilized by three types of stabilizers including hydroxypropyl methyl cellulose E15 (HPMC E15), pluronic F127 (F127), and glycyrrhizin acid (GL) were respectively prepared by wet media milling method, namely QT-NCs/HPMC E15, QT-NCs/F127, and QT-NCs/GL, and then characterized by morphology and crystal state. Their dissolutionand oral pharmacokinetics were also investigated.The particle size of QT-NCs modified by three types of stabilizers were about 200 nm with PDI was about 0.20. Scanning electron microscopy showed that QT-NCs were all short rods and irregular particles, while X-ray diffraction results showed that QT-NCs existed in crystalline state. Thedissolution results showed that the cumulative dissolution of QT-NCs modified by three types of stabilizers were significantly improved as compared to QT, and the cumulative dissolution rate within 30 min was in an order of QT-NCs/F127 (74.90%) > QT-NCs/GL (59.30%) > QT-NCs/HPMC E15 (53.65%). The pharmacokinetic results showed that, compared with quercetin, the oral bioavailability of QT-NCs modified with three types of stabilizers were significantly enhanced, and their AUC0—twas in the following order: QT-NCs/E15 (78.09 ± 6.05) mg∙h/L > QT-NCs/GL (61.72 ± 7.59) mg∙h/L > QT-NCs/ F127 (49.94 ± 9.30) mg∙h/L.NCs can significantly improve thedissolution and oral bioavailability of poorly soluble drugs, and the stabilizer’s types significantly affect thedissolution and oral pharmacokinetics of NCs.
nanocrystals; stabilizers; quercetin;dissolution; pharmacokinetics;hypromellose; pluronic; glycyrrhizic acid
R283.6
A
0253 - 2670(2021)21 - 6485 - 08
10.7501/j.issn.0253-2670.2021.21.005
2021-06-04
国家自然科学基金资助项目(81803741);国家自然科学基金资助项目(81873092)
胡 菲(1997—),女,硕士研究生,研究方向为中药新型给药系统研究。Tel: 17779140130 E-mail: 1256719791@qq.com
朱卫丰,教授,博士生导师,研究方向为中药经皮给药新剂型与新技术研究。Tel: (0791)87118614 E-mail: zwf0322@126.com
袁海龙,研究员,博士生导师,研究方向为中药新型给药系统研究。Tel: (010)66928505 E-mail: yhlpharm@126.com
[责任编辑 郑礼胜]

