超声内镜引导下腹腔镜切除术治疗胃肠道黏膜下肿瘤的临床研究
熊克辉 严命熔 黄小荣
(福建省福鼎市医院外一科 福鼎 355209)
胃肠道黏膜下肿瘤是一种常见的消化道病变,发病初期一般无明显症状,但随着病情进展,肿瘤体积逐渐增大,可伴有上腹部疼痛不适、出血、梗阻等症状,严重影响患者生活质量及生命健康。胃肠道黏膜下肿瘤多属于良性病变,仅有15%左右为恶性病变。现阶段,临床治疗胃肠道黏膜下肿瘤主要是采取腹腔镜切除,该术式具有创伤较小、术后疼痛较轻等特点,且有利于胃肠功能恢复,但其在应用中易受肿瘤位置特殊、体积较小等因素影响治疗效果[1]。超声内镜技术可较为清晰地展现机体内各组织的形态,并对病灶进行实时扫描,临床常用于结直肠黏膜下肿瘤、胃间质瘤等疾病[2]。本研究旨在探讨胃肠道黏膜下肿瘤患者应用超声内镜引导下腹腔镜切除术治疗的临床效果。现报道如下:
1 资料与方法
1.1 一般资料 选取我院2013年1月~2019年6月收治的50例胃肠道黏膜下肿瘤患者为研究对象,依据随机数字表法分为对照组和观察组,各25例。对照组男14例,女11例;年龄40~69岁,平均(55.26±4.17)岁;病灶直径2~4 cm,平均(2.81±0.69)cm;病灶位置:贲门9例,胃底16例;病变起源:黏膜下腔外1例,肌层及浆膜层24例。观察组男15例,女10例;年龄41~70岁,平均(55.27±4.15)岁;病灶直径2~4 cm,平均(2.88±0.65)cm;病灶位置:贲门8例,胃底17例;病变起源:黏膜下腔外2例,肌层及浆膜层23例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审核批准。纳入标准:符合《临床诊疗指南·肿瘤分册》[3]中胃肠道黏膜下肿瘤相关诊断标准,且经内镜和病理检查确诊者;单发性肿瘤者;患者及其家属均知情同意。排除标准:患有凝血功能障碍者;合并严重脑、心等重要脏器病变者;无法进行本研究治疗方式者。
1.2 治疗方法 对照组采用腹腔镜手术治疗,全麻,取仰卧位,采用四孔法建立气腹,维持腹腔气压为14 mm Hg(1 mm Hg=0.133 kPa),使用腹腔镜系统及摄像系统(生产厂家:日本奥林巴斯医疗株式会社,型号:OVT-S190)进行病灶定位,随后将周围组织游离,切除病灶。若病灶生长在腔外,切除则采用楔形方式;若病灶由贲门延伸至胃底,则采用胃肿瘤外翻切除术,暂不清扫淋巴结,采用病理检查确定病灶组织肿瘤的良恶性。观察组采用超声内镜引导下腹腔镜切除术治疗,气管插管及全麻,取仰卧位,术前,摆放好腹腔镜、胃镜仪器(生产厂家:日本奥林巴斯医疗株式会社,型号:GIF-H260Z、H290、HQ290型)及超声仪器(生产厂家:日本奥林巴斯医疗株式会社,型号:EV-290型),内镜助手站于患者头部,在气管插管咬口旁放置内镜口垫,在内镜直视下将胃镜插入,进而通过胃镜对患者上消化道进行检查,以确定病灶准确位置,并与超声内镜技术结合对病灶的浸润深度、侵犯范围进行探查,确认病灶的实际情况后,进行肿瘤定位标记,于超声内镜技术辅助下进行腹腔镜手术,对病灶进行壁外剥离、切除,采用病理检查确定病灶组织的良恶性。两组患者术后均予以常规缝合、抗感染等处理,并于术后6个月进行随访。
1.3 观察指标(1)病灶完全切除率。比较两组病灶完全切除率情况,完全切除是指病理切片显示整块切除标本水平和垂直切缘均为阴性。(2)胃肠黏膜功能。于术前及术后1个月,分别取两组患者静脉血约5 ml,置于离心装置中(3 000 r/min,10 min)离心后,分离血清,血清胃蛋白酶原Ⅰ(PGⅠ)、胃蛋白酶原Ⅱ(PGⅡ)、胃蛋白酶原比值(PGR)、胃泌素17(G-17)水平采用酶联免疫吸附试验。(3)并发症。于术后1个月内,比较两组患者切口感染、术后梗阻、胃潴留、急性穿孔等并发症发生情况。(4)随访结果:术后随访6个月,观察并统计两组复发及远处转移情况。
1.4 统计学方法 采用SPSS22.0统计学软件分析处理数据,计量资料以(±s)表示,采用t检验,计数资料用率表示,采用χ2检验,P<0.05为差异具有统计学意义。
2 结果
2.1 两组病灶完全切除情况比较 两组病灶完全切除情况经比较,差异无统计学意义(P>0.05)。见表1。
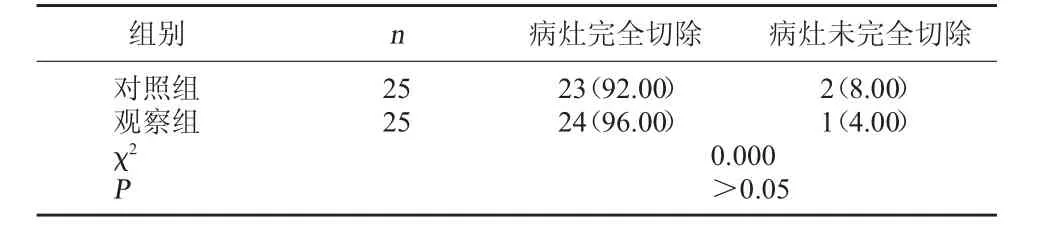
表1 两组病灶完全切除情况比较[例(%)]
2.2 两组胃肠黏膜功能比较 术后1个月两组血清PGⅠ、PGR含量均较术前提高,且观察组较对照组高;两组血清PGⅡ、G-17含量均降低,且观察组较对照组低(P<0.05)。见表2。
表2 两组胃肠黏膜功能比较(±s)
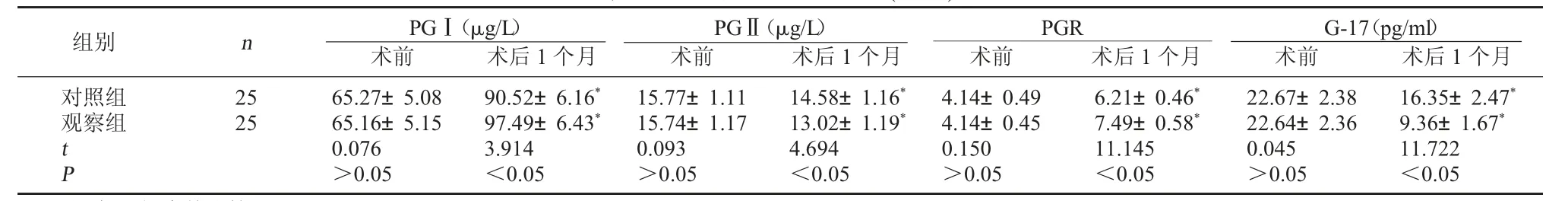
表2 两组胃肠黏膜功能比较(±s)
注:与同组术前比较,*P<0.05。
G-17(pg/ml)术前 术后1个月对照组观察组组别 n PGⅠ(μg/L)术前 术后1个月PGⅡ(μg/L)术前 术后1个月PGR术前 术后1个月25 25 tP 65.27±5.08 65.16±5.15 0.076>0.05 90.52±6.16*97.49±6.43*3.914<0.05 15.77±1.11 15.74±1.17 0.093>0.05 14.58±1.16*13.02±1.19*4.694<0.05 4.14±0.49 4.14±0.45 0.150>0.05 6.21±0.46*7.49±0.58*11.145<0.05 22.67±2.38 22.64±2.36 0.045>0.05 16.35±2.47*9.36±1.67*11.722<0.05
2.3 两组并发症发生情况比较 观察组术后1个月内并发症总发生率(8.00%)较对照组(32.00%)低(P<0.05)。见表3。
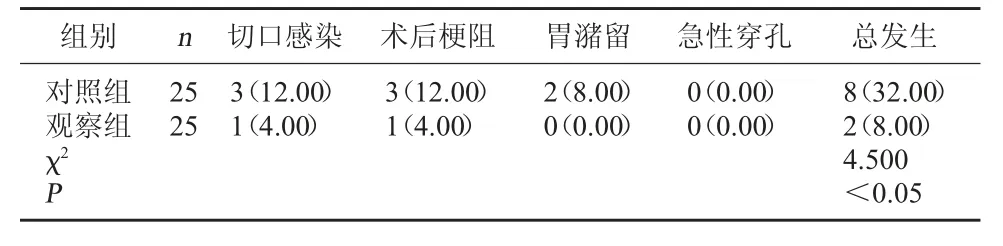
表3 两组并发症发生情况比较[例(%)]
2.4 两组复发及远处转移情况比较 术后随访6个月,两组均未发现复发及远处转移。
3 讨论
胃肠道黏膜下肿瘤主要是由遗传、不良饮食习惯等因素导致胃肠道黏膜下发生肿瘤病变的一种病症,具有发病率高、病情呈进展性等特点。腹腔镜切除术可通过腹腔镜进行病灶组织切除,控制病情进展,但其在临床应用中缺少精细触觉反馈,易导致病灶定位不准确,进而不利于患者治疗[4]。
超声内镜引导下腹腔镜切除术主要是借助超声内镜将病变的实际情况清晰地展现出来,然后通过黏膜剥离术、黏膜切除术等手段将病灶切除,减少肿瘤病灶残留,弥补腹腔镜切除术不足,可有效控制病情进展[5]。本研究结果显示,两组病灶完全切除情况比较无显著差异,术后随访6个月两组均未发现复发及远处转移,观察组术后1个月内并发症总发生率低于对照组,表明超声内镜引导下腹腔镜切除术治疗胃肠道黏膜下肿瘤可有效缓解患者的临床症状,降低并发症发生率,且病灶完全切除率高,与李玉强等[6]研究结果相符。血清PGⅠ具有水解蛋白作用,其水平升高表明患者胃肠黏膜功能改善,病情好转[7];血清PGR可作为反映机体胃黏膜功能和状态的敏感指标,水平降低表明患者胃黏膜功能损伤加重,病情加重;血清PGⅡ升高提示机体的胃黏膜功能紊乱,病情进展加快;血清G-17可反映胃黏膜分泌功能,水平越高表明患者胃黏膜分泌功能越差,病情越严重[8]。超声内镜引导下腹腔镜切除术主要是在手术过程中精确定位病灶,有利于避免切除过多正常组织,减少手术对胃黏膜功能和状态的损伤,从而促进患者尽早康复[9]。本研究结果显示,术后1个月观察组血清PGⅠ、PGR水平均高于对照组,血清PGⅡ、G-17水平均低于对照组,表明超声内镜引导下腹腔镜切除术治疗胃肠道黏膜下肿瘤可有效改善患者胃黏膜功能,控制病情进展,与张作君等[10]研究结果基本相符。综上所述,超声内镜引导下腹腔镜切除术治疗胃肠道黏膜下肿瘤可改善胃黏膜功能,提高临床疗效,且病灶完全切除率高,安全性高,值得临床推广应用。

