基于芯片三电极系统检测辣根过氧化物酶的研究
邵 波,党雯迪,闫丽君,孙云秀,施 璠,黄玉豪,王晓峰,孙 伟*
(1.海南师范大学 化学与化工学院,海口市功能材料与光电化学重点实验室,海南 海口 571158;2.清华大学 精密仪器系,北京 100084)
辣根过氧化物酶(HRP)是一种重要的工具酶,被广泛用于开发基于酶联免疫吸附实验[1]、酶联适配体检测实验[2]、抗原和抗体的生物标记物[3]以及其他基于酶催化反应[4]的生化检测方法。开发检测HRP的方法具有非常重要的意义,目前HRP检测方法主要基于光学检测和电化学检测[5]等方法,建立一种快速、准确、便捷和低成本的测试方法极其重要。
电化学分析中传统的三电极体系不能满足体积小、易携带以及快速检测等需求,因此,在基底上集成芯片三电极系统更加受到研究者的关注[6],相比较传统电极,其具有极高的稳态电流密度、极短的响应时间和很小的IR降[7]。芯片电化学传感器可以实现小型化、智能化和无线传输,使得集成三电极体系在小空间的检测领域更加重要。Zhu等人采用二维层状纳米材料修饰芯片电极,结合智能手机和无线传输,实现了对植物生长调节剂萘乙酸的快速检测[8]。Zhang等人通过乙酰胆碱酯酶修饰石墨烯手性芯片电极制备了一种高灵敏度的芯片传感器,结合无线传输技术实现了对甲胺磷的实时快速检测[9]。
本文设计了一种芯片三电极系统,以金盘电极为工作电极,金片电极为辅助电极,银/氯化银(Ag/AgCl)电极为参比电极,具有样品用量少、携带方便等优点,以邻联茴香胺(ODA)和邻苯二胺(OPD)作为底物体系建立了检测辣根过氧化物酶(HRP)的方法。图1为芯片三电极系统示意图。

图1芯片三电极系统(A)和芯片电极的使用示意图(B)Figure 1 Schematic diagram of chip three-electrode system (A)and using chip electrodes(B)
1 材料与方法
1.1 仪器与试剂
CHI 660E型电化学工作站,上海辰华仪器公司;金基底芯片三电极和Ag/AgCl浆料由清华大学精密仪器系提供。
1.0×10-3g/mL HRP 溶液,上海雪满生物科技有限公司,>250 U/mg,4 ℃冰箱保存,使用时用水逐级稀释;2.0×10-2mol/L ODA溶液,山东西亚化学科技有限公司;5.0×10-2mol/L OPD溶液,天津市大茂化学试剂厂;1.2×10-2mol/L H2O2溶液;0.1 mol/L KHPO4-Na2HPO4缓冲溶液;0.2 mol/L Britton-Robinson(B-R)缓冲溶液;0.1 mol/L HAc-NaAc缓冲溶液。所用试剂均为分析纯。
1.2 实验方法
1.2.1 芯片三电极系统的构建
先将芯片的三电极依次用硝酸(1+1)、乙醇(1+1)和蒸馏水超声清洗(5~8 min/次),得到一个洁净的电极表面,待电极表面干燥后,在作为参比电极的金片基底上,每平方毫米完全涂覆0.5±0.1 mg的Ag/AgCl浆料,得到Ag/AgCl参比电极,并与金盘电极(工作电极)、金片电极(辅助电极)构成芯片三电极系统。
1.2.2 ODA-H2O2-HRP体系的电化学检测
于10 mL比色管中依次加入2.0×10-2mol/L ODA 溶液3.0 mL、1.2×10-2mol/L H2O2溶液1.0 mL、0.1 mol/L pH为5.8 KHPO4-Na2HPO4溶液1.0 mL、不同浓度的HRP溶液100 μL、无水乙醇4 mL,用超纯水稀释至刻度后摇匀,于37 ℃水浴中反应15 min后取出。移取此反应液2.0 mL 于另一支5 mL 比色管中,加入1.0 mL pH 2.0 B-R 缓冲溶液,用超纯水稀释至5.0 mL,摇匀,将此溶液取出10 μL 移至芯片三电极电解池中,于CHI 660E型电化学工作站上记录酶催化反应产物的伏安曲线。差分脉冲伏安法(DPV)采用的起始电位为-0.05 V,终止电位为-0.25 V,电位增量为0.004 V,静止时间为2 s。CV法采用的起始电位为0 V,终止电位为-0.55 V,扫速为0.1 V/s。
1.2.3 OPD-H2O2-HRP体系的电化学检测
于10 mL 比色管中依次加入5.0×10-2mol/L OPD 溶液1.0 mL、4.0×10-3mol/L H2O2溶液2.0 mL、0.1 mol/L pH为4.8的HAc-NaAc溶液2.0 mL,不同浓度的HRP溶液200 μL、无水乙醇4 mL,用水稀释至刻度后摇匀,于30 ℃水浴中反应20 min后取出。移取此反应液3.0 mL于另一支10 mL比色管中,加入2.0 mL pH 2.0 B-R缓冲溶液,摇匀,将此溶液取出10 μL移至芯片三电极电解池中,于CHI 660E型电化学工作站上记录酶催化反应产物的伏安曲线。CV法采用的起始电位为0 V,终止电位为-0.80 V,扫速为0.1 V/s。
2 结果与讨论
2.1 芯片电极系统的电化学表征
以金盘电极(Φ=2 mm)为工作电极,金片电极为辅助电极,Ag/AgCl电极为参比电极构建了芯片三电极系统,与常规三电极系统(金盘电极为工作电极和对电极,直径Φ=2 mm)在铁氰化钾溶液中进行循环伏安扫描并进行对比,结果如图2所示,CV图相差不大,且Ipa/Ipc ≈1,所构建的芯片三电极系统具有良好的电化学行为。
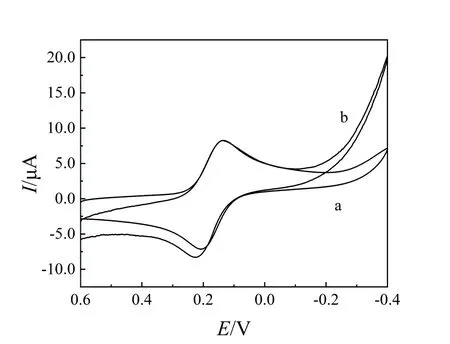
图2 常规金三电极系统(a)和金芯片三电极系统(b)在0.01 mol/L K3[Fe(CN)4]溶液中的循环伏安曲线(扫描速度0.1 V/s)Figure 2 The CV curves of traditional gold three-electrode system (a)and gold chip three-electrode system(b)in 0.01 mol/L K3[Fe(CN)6]solution at scan rate of 0.1 V/s
2.2 酶催化反应体系的电化学行为
最佳条件下ODA-H2O2-HRP反应体系典型的CV曲线如图3(A)所示,在ODA-H2O2溶液中CV扫描无明显氧化还原峰,在ODA-H2O2-HRP溶液的CV扫描中位于-0.20 V处出现一个峰,为酶催化反应产物的还原峰,但反扫时无氧化峰出现,表明产物在金电极上发生不可逆还原反应,这是HRP催化H2O2氧化ODA生成的双偶氮联苯物质[10]在金圆盘电极上的还原所致。
最佳条件下OPD-H2O2-HRP反应体系典型的CV曲线如图3(B)所示,在OPD-H2O2溶液中CV扫描无明显氧化还原峰,在OPD-H2O2-HRP溶液的CV扫描中位于-0.50 V和-0.42 V处出现一对峰,为反应产物的氧化还原峰,它是酶催化OPD生成的2,3-二氨基吩嗪电活性物质[11]在金圆盘电极上发生氧化还原反应所致。
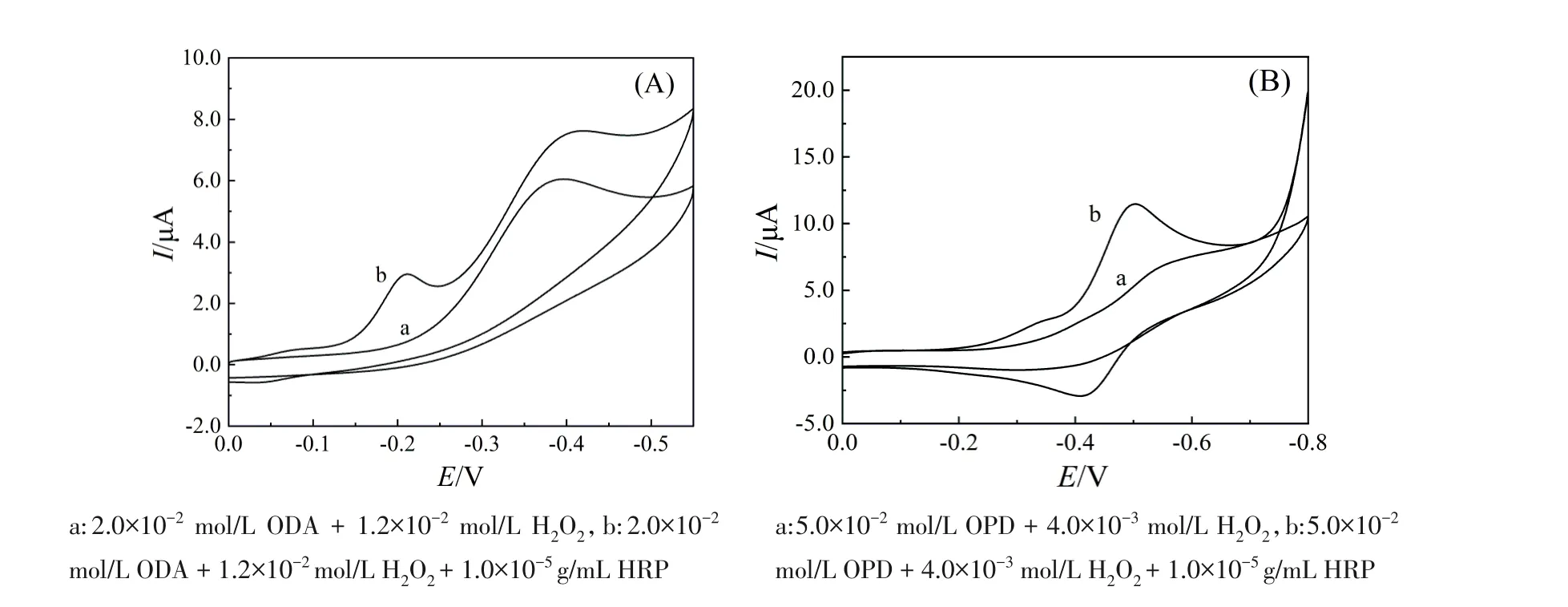
图3 ODA-H2O2-HRP反应体系(A)和OPD-H2O2-HRP反应体系(B)在0.2 mol/L pH 2.0 B-R溶液中的CV图(扫速为0.1 V/s)Figure 3 CV curves of ODA-H2O2-HRP(A)and OPD-H2O2-HRP(B)reaction system in 0.2 mol/L pH 2.0 B-R at scan rate of 0.1 V/s
2.3 酶催化反应产物的电化学行为
考察了B-R缓冲液的pH值(1.5~4.0)对HRP催化H2O2氧化ODA反应产物在芯片电极上的电化学行为的影响,循环伏安结果如图4(A)所示。随着溶液pH值的增大,还原峰发生了负移且逐渐消失,在pH=2.0时获得最大电流,因此,选取pH值为2.0的B-R作为电解质溶液进行电化学研究测试。
考察了B-R缓冲液的pH值(2.0~5.0)对HRP催化氧化OPD反应产物在微电极上的电化学行为的影响,循环伏安结果如图4(B)所示。随着溶液pH值的增大,氧化还原峰发生了负移且逐渐消失,在pH=2.0时获得最大电流,因此,选取pH值为2.0的B-R作为电解质溶液进行电化学研究测试。
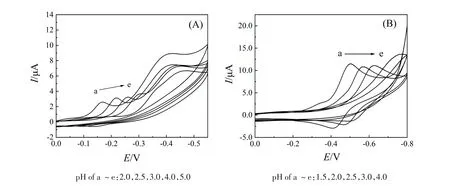
图4 ODA氧化产物(A)和OPD氧化产物(B)在芯片电极上的0.2 mol/L 不同pHB-R溶液中的循环伏安图(扫速为0.1 V/s)Figure 4 CV curves of ODA oxidation products(A)and OPD oxidation products(B)in 0.2 mol/L B-R solution with different pH on the chip electrode at scan rate of 0.1 V/s
研究了扫描速度对ODA氧化产物在金电极上电化学响应信号的影响,结果如图5(A)所示。可以观察到随着扫描速度的增加,还原峰的峰电位发生负移。在扫描速度为50~800 mV/s的范围内,还原峰电流(Ip)和扫描速度(υ)呈良好的线性关系,线性回归方程为Ipc(μA)=8.718υ+1.336(γ=0.992),证明电极界面上发生的电子转移反应是一个动力学控制响应过程。峰电位与扫描速度的对数(lnυ)之间具有线性关系,其线性方程为Ep(V)=-0.046 lnυ-0.290(γ=0.980)。
研究了扫描速度对OPD氧化产物在金盘电极上电化学响应信号的影响,结果如图5(B)所示。可以观察到随着扫描速度的增加,峰电流增加但峰电位基本不变。在扫描速度为100~1000 mV/s的范围内,氧化还原峰电流(Ip)和扫描速度(υ)呈良好的线性关系,线性回归方程为Ipc(μA)=18.719υ+6.838(γ=0.997)和Ipa(μA)=-13.214υ+0.845(γ=0.999),证明电极界面上发生的是吸附控制过程。

图5 不同扫速下ODA氧化产物(A)和OPD氧化产物(B)在圆盘电极上的循环伏安曲线Figure 5 CV curves of ODA oxidation products(A)and OPD oxidation products(B)on the disk electrode at different scan rates
2.4 测定HRP的工作曲线
采用DPV 考察了芯片三电极系统对酶催化ODA 和OPD 与H2O2反应产物的电化学还原行为。图6(A)为ODA产物的DPV曲线,当HRP的浓度在5.0×10-7~1.0×10-5g/mL范围内,峰电流和酶浓度具有良好的线性关系,其线性回归方程为I(A)=0.106C(g/mL)-4.013×10-8(γ=0.993),检测下限为1.0×10-7g/mL。图6(B)为OPD产物的DPV曲线,当HRP的浓度在1.0×10-8~10×10-4g/mL范围内,还原峰电流和酶浓度的对数值具有良好的线性关系,其线性回归方程为I(μA)=0.897 lnC(g/mL)+16.64(γ=0.991),检测下限为1.0×10-9g/mL,以上结果表明,芯片电极用于检测HRP 具有低的检测限和较宽的检测范围,呈现出良好的灵敏度。

图6 芯片电极在不同酶浓度下催化ODA(A)或OPD(B)和H2O2反应后反应产物的差分脉冲伏安图,插图是峰电流与酶浓度之间的线性关系图Figure 6 DPV curves of the reaction products of ODA(A)and OPD(B)at different concen⁃trations of enzyme,inset is relationship between the peak current and enzyme concentration
3 结论
本文设计了一种集工作电极(金盘电极)、辅助电极(金片电极)和参比电极(Ag/AgCl)于同一芯片上的三电极系统,其不仅保持了传统电极优良的导电性能,更表现出体积小、便携等优点。利用该芯片电极构建了一种微型电化学传感器,成功实现了对HRP催化H2O2氧化ODA和OPD产物的检测,从而间接测得HRP的浓度,检测结果较好。

