心肺康复运动训练对特发性肺间质纤维化患者心肺功能的影响研究
赖德清,袁亚迪,谢晓梅,杨霞
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是肺间质局限性炎症引起的慢性病变,常见于中老年人群,随着肺纤维化持续进展可导致肺功能出现不可逆损伤,严重威胁患者的生命安全。目前IPF的发病机制尚未完全明确,药物治疗患者的中位生存时间仅为2.5~3.5年,难以获得预期效果[1-3]。近年心肺康复在慢性肺疾病治疗中应用广泛并取得了一定进展,肺功能康复是其核心内容,可有效缓解患者呼吸困难症状,改善运动耐量及生活质量,现已成为呼吸病学的重要组成部分[4]。既往研究表明,IPF患者存在用力肺活量(forced vital capacity,FVC)下降和弥散功能障碍,在运动状态下尤为突出,其与肺组织损伤程度相关[5]。此外,心脏功能与肺功能存在紧密联系,仅进行心功能康复或肺康复难以达到良好的效果,因而将心、肺作为整体进行康复训练,任何脏器负荷加重均会对患者整体功能的恢复造成严重影响。心肺康复的内容包括康复评估、生命体征监测和运动训练3个部分,以逐渐增强心肺功能并提升氧摄取和利用能力为目的。贺慧博等[6]研究表明,中度IPF患者接受心肺康复训练有利于改善其肺功能、运动耐量及生活质量,但其具体作用机制仍未完全明确。本研究旨在探讨心肺康复运动训练对IPF患者心肺功能的影响,以期为临床应用提供更多的循证医学证据。
1 资料与方法
1.1 一般资料 选取都江堰市医疗中心2017年8月至2020年8月收治的IPF患者82例,均符合IPF的相关诊断标准[7],且用力肺活量占预计值百分比(percentage of forced vital capacity to predicted value,FVC%)≥50%或一氧化碳弥散量(diffusion capacity for carbon monoxide,DLCO)≥30%。排除标准:(1)合并肺部感染、心脑血管疾病、恶性肿瘤等严重基础疾病者;(2)合并肝、肾等重要脏器功能不全者;(3)合并心力衰竭、心肌梗死、脑出血等疾病且存在心肺康复运动训练禁忌证者;(4)伴有精神疾病或认知障碍者。按照随机数字表法将所有患者分为观察组和对照组,各41例。观察组中男23例,女18例;年龄47~83岁,平均(63.9±10.2)岁;病程9个月~4年,平均(2.4±0.9)年;吸烟13例(31.7%)。对照组中男26例,女15例;年龄45~87岁,平均(65.1±10.7)岁;病程7个月~5年,平均(2.2±1.0)年;吸烟17例(41.5%)。两组患者性别(χ2=0.456)、年龄(t=0.528)、病程(t=0.858)、吸烟率(χ2=0.841)比较,差异无统计学意义(P>0.05)。本研究已获得都江堰市医疗中心伦理委员会审核批准,患者对本研究知情并签署知情同意书。
1.2 方法 患者入院后均完善相应的实验室检查及心、肺影像学检查,并给予化痰、抗感染等对症支持治疗,针对急性加重者予以泼尼松或硫唑嘌呤联合氧疗(氧流量为2~4 L/min,氧浓度为30%~35%),疗程均为3个月。观察组患者在此基础上接受心肺康复运动训练,具体内容如下:干预前备好肾上腺素、除颤仪和氧等急救设备,应用2900型心肺运动试验(cardiopulmonary exercise test,CPET)测试仪(意大利COSMED公司生产)检测患者的生命体征、无氧阈并使用计算机进行实时记录,而后在专业医师的监督下定期开展心肺康复运动训练,大致分为3个阶段:热身阶段是应用意大利COSMED功率自行车,以10 W的功率踏车10 min;在训练前患者需先完成测试,即设定踏车功率为20 W,按照5~15 W进行渐次递增,并维持脚踏车转速为60 r/min,记录患者无氧阈值对应的功率,而后制定训练方案,训练阶段则依据此测试结果踏车30~40 min;最后,完成整理运动阶段,以0 W缓慢踏车5 min结束。若患者在训练阶段出现胸闷、头晕或心律失常等不适症状或血氧饱和度(blood oxygen saturation,SaO2)<85%时需立即以0 W缓慢踏车5 min结束训练,1次/d,3~5次/周,持续训练3个月。依据患者不同阶段的无氧阈改善状况评估其康复效果,以进一步制定下一步的训练方案。
1.3 观察指标 (1)肺功能指标:分别于干预前后应用SD-75型肺功能仪(日本株式会社)检测两组患者FVC%、第1秒用力呼气容积占预计值百分比(percentage of forced expiratory volume in the first second to predicted value,FEV1%)、一氧化氮弥散量占预计值百分比(percentage of diffusion capacity for carbon monoxide to predicted value,DLCO%)。(2)6 min步行距离(6 min walking distance,6MWD):分别于干预前后嘱患者穿舒适衣物休息15 min,而后于50 m的平坦空地上以尽可能快的速度往返行走,6 min后测量其6MWD。(3)Borg呼吸困难评分:采用Borg呼吸困难评分评估两组患者干预前后呼吸困难程度,患者在评估前30 min停止吸氧,若患者在测试过程中出现胸闷、头晕或心律失常等症状则立即停止测试,得分越高表明患者呼吸困难程度越严重。(4)动脉血气分析指标:分别于干预前后应用pHox全自动血气分析仪(美国NOVA公司生产)检测两组患者动脉血气分析指标,包括动脉血氧分压(partial pressure of arterial oxygen,PaO2)、动脉血二氧化碳分压(partial pressure of arterial blood carbon dioxide,PaCO2)、氧合指数(oxygenation index,OI)。(5)呼吸力学指标:分别于干预前后应用Ventrak呼吸功能监测仪(美国Novamatrix公司生产)检测两组患者吸气末跨肺压(end-inspiratory transpulmonary pressure,Ptp-ei)和呼气末跨肺压(end-expiratory transpulmonary pressure,Ptp-ee),计算跨肺驱动压(ΔPtp),ΔPtp=Ptp-ei-Ptp-ee。
1.4 统计学方法 应用SPSS 19.0统计学软件进行数据处理。计数资料以相对数表示,组间比较采用χ2检验;计量资料以(±s)表示,组间比较采用两独立样本t检验,组内比较采用配对t检验。采用Pearson相关分析探讨IPF患者干预后呼吸力学指标与6MWD、Borg呼吸困难评分的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 肺功能指标 两组患者干预前FVC%、FEV1%、DLCO%及干预后FEV1%比较,差异无统计学意义(P>0.05);观察组患者干预后FVC%、DLCO%高于对照组,差异有统计学意义(P<0.05)。两组患者干预后FVC%、FEV1%、DLCO%分别高于本组干预前,差异有统计学意义(P<0.05),见表1。
表1 两组患者干预前后肺功能指标比较(±s,%)Table 1 Comparison of pulmonary function indexes between the two groups before and after intervention
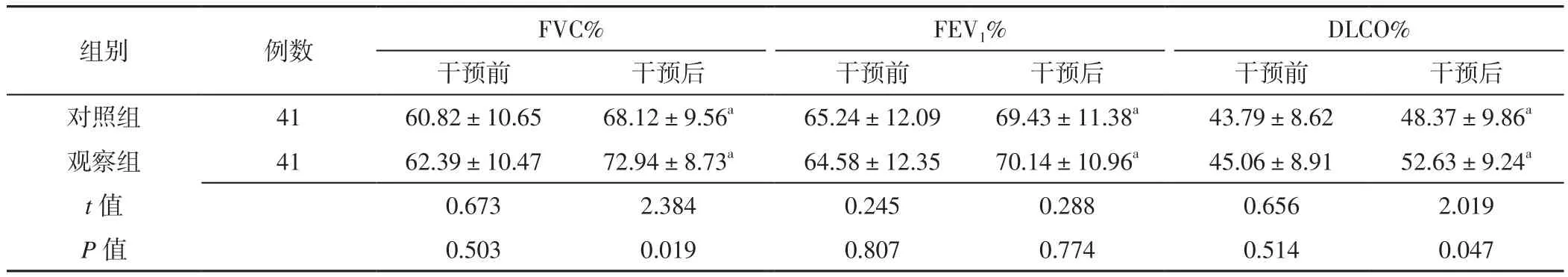
表1 两组患者干预前后肺功能指标比较(±s,%)Table 1 Comparison of pulmonary function indexes between the two groups before and after intervention
注:a表示与本组干预前比较,P<0.05;FVC%=用力肺活量占预计值百分比,FEV1%=第1秒用力呼气容积占预计值百分比,DLCO%=一氧化碳弥散量占预计值百分比
images/BZ_93_190_2712_2276_2830.png对照组 41 60.82±10.65 68.12±9.56a 65.24±12.09 69.43±11.38a 43.79±8.62 48.37±9.86a观察组 41 62.39±10.47 72.94±8.73a 64.58±12.35 70.14±10.96a 45.06±8.91 52.63±9.24a t值 0.673 2.384 0.245 0.288 0.656 2.019 P值 0.503 0.019 0.807 0.774 0.514 0.047
2.2 6MWD和Borg呼吸困难评分 两组患者干预前6MWD、Borg呼吸困难评分比较,差异无统计学意义(P>0.05);观察组患者干预后6MWD长于对照组,Borg呼吸困难评分低于对照组,差异有统计学意义(P<0.05)。两组患者干预后6MWD分别长于本组干预前,Borg呼吸困难评分分别低于本组干预前,差异有统计学意义(P<0.05),见表2。
表2 两组患者干预前后6MWD和Borg呼吸困难评分比较(±s)Table 2 Comparison of 6MWD and Borg dyspnea score between the two groups before and after intervention
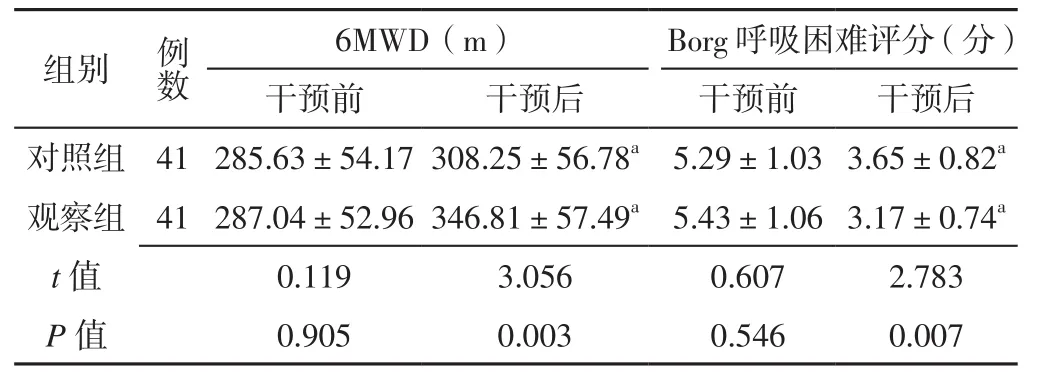
表2 两组患者干预前后6MWD和Borg呼吸困难评分比较(±s)Table 2 Comparison of 6MWD and Borg dyspnea score between the two groups before and after intervention
注:a表示与本组干预前比较,P<0.05;6MWD=6 min步行距离
6MWD(m) Borg呼吸困难评分(分)干预前 干预后 干预前 干预后对照组 41 285.63±54.17 308.25±56.78a5.29±1.03 3.65±0.82a观察组 41 287.04±52.96 346.81±57.49a5.43±1.06 3.17±0.74a t值 0.119 3.056 0.607 2.783 P值 0.905 0.003 0.546 0.007组别 例数
2.3 动脉血气分析指标 两组患者干预前PaO2、PaCO2、OI及干预后PaCO2比较,差异无统计学意义(P>0.05);观察组患者干预后PaO2、OI高于对照组,差异有统计学意义(P<0.05)。两组患者干预后PaO2、OI分别高于本组干预前,差异有统计学意义(P<0.05),见表3。
表3 两组患者干预前后动脉血气分析指标比较(±s,mm Hg)Table 3 Comparison of arterial blood gas analysis between the two groups before and after intervention
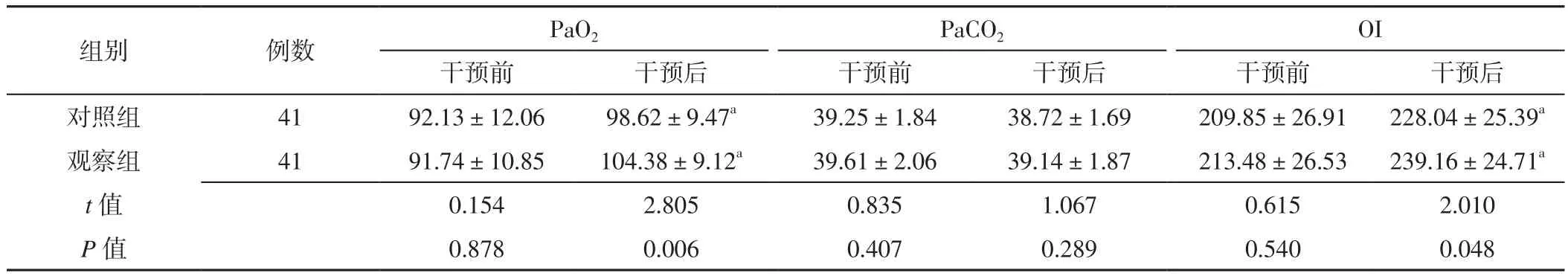
表3 两组患者干预前后动脉血气分析指标比较(±s,mm Hg)Table 3 Comparison of arterial blood gas analysis between the two groups before and after intervention
注:a表示与本组干预前比较,P<0.05;1 mm Hg=0.133 kPa;PaO2=动脉血氧分压,PaCO2=动脉血二氧化碳分压,OI=氧合指数
images/BZ_94_187_2190_2278_2308.png对照组 41 92.13±12.06 98.62±9.47a 39.25±1.84 38.72±1.69 209.85±26.91 228.04±25.39a观察组 41 91.74±10.85 104.38±9.12a 39.61±2.06 39.14±1.87 213.48±26.53 239.16±24.71a t值 0.154 2.805 0.835 1.067 0.615 2.010 P值 0.878 0.006 0.407 0.289 0.540 0.048
2.4 呼吸力学指标 两组患者干预前Ptp-ei、Ptp-ee、ΔPtp及干预后Ptp-ee比较,差异无统计学意义(P>0.05);观察组患者干预后Ptp-ei、ΔPtp低于对照组,差异有统计学意义(P<0.05)。两组患者干预后Ptp-ei、ΔPtp分别低于本组干预前,差异有统计学意义(P<0.05),见表4。
表4 两组患者干预前后呼吸力学指标比较(±s,cm H2O)Table 4 Comparison of respiratory mechanics indexes between the two groups before and after intervention
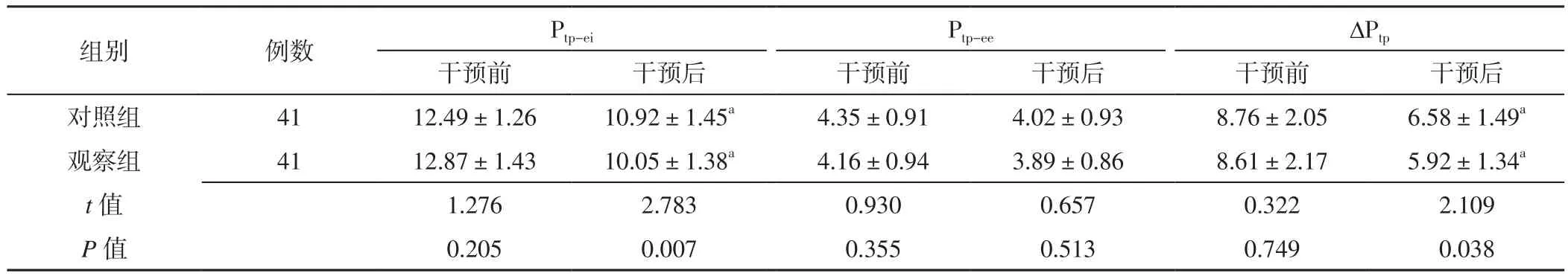
表4 两组患者干预前后呼吸力学指标比较(±s,cm H2O)Table 4 Comparison of respiratory mechanics indexes between the two groups before and after intervention
注:a表示与本组干预前比较,P<0.05;1 cm H2O=0.098 kPa;Ptp-ei=吸气末跨肺压,Ptp-ee=呼气末跨肺压,ΔPtp=跨肺驱动压
images/BZ_94_189_2771_2276_2889.png对照组 41 12.49±1.26 10.92±1.45a 4.35±0.91 4.02±0.93 8.76±2.05 6.58±1.49a观察组 41 12.87±1.43 10.05±1.38a 4.16±0.94 3.89±0.86 8.61±2.17 5.92±1.34a t值 1.276 2.783 0.930 0.657 0.322 2.109 P值 0.205 0.007 0.355 0.513 0.749 0.038
2.5 相关性分析 Pearson相关分析结果显示,IPF患者干预后Ptp-ei、ΔPtp与6MWD呈负相关,与Borg呼吸困难评分呈正相关(P<0.05);IPF患者干预后Ptp-ee与6MWD、Borg呼吸困难评分均无直线相关关系(P>0.05),见表5。
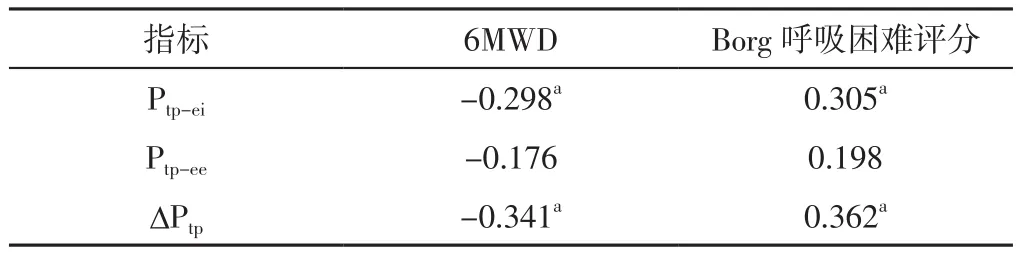
表5 IPF患者干预后呼吸力学指标与6MWD、Borg呼吸困难评分的相关性分析(r值)Table 5 Correlation analysis of respiratory mechanics indexes with 6MWD and Borg dyspnea score after intervention of IPF patients
3 讨论
IPF是由遗传、吸烟及感染等多种因素综合作用导致的一种慢性进展性病变,起病隐匿,全球患病人数约有300万,是现阶段威胁人们身体健康的重要公共卫生问题[8]。目前临床针对IPF尚缺乏特异性的治疗药物,因此非药物治疗的重要性日益突出,其中心肺康复训练的作用已获得国内外的一致认可,大致分为静态训练、动态训练及联合训练[9-10]。IPF可引发机体肺功能减退,仅依据FVC、FEV1和DLCO等肺功能指标常难以较准确地反映患者肺功能及运动耐量,而CPET测试仪是集康复评估、生命体征监测和运动训练为一体的仪器,可实时监测患者在代谢增加时的肺代偿能力和受限程度,有助于制定个体化的心肺康复运动训练方案,而心肺康复运动训练具有操作简单、安全且可重复等优势[11-12]。本研究旨在探讨心肺康复运动训练对IPF患者的干预效果,以期为临床应用提供更多的循证医学证据。
本研究观察组患者借助CPET测试仪检测无氧阈,而后采用功率递增踏车训练进行心肺康复运动训练,结果显示,观察组患者干预后FVC%、DLCO%高于对照组,与贺慧博等[6]研究结果一致,表明在常规药物治疗基础上采用心肺康复运动训练可有效改善IPF患者的肺功能。此外,IPF患者的病变不仅局限于肺间质,也多累及肺泡上皮细胞和毛细血管内皮细胞,甚至肺动脉或肺静脉,因此患者在出现肺泡顺应性降低和通气功能下降的同时,多存在肺组织弥散功能、肺换气功能障碍,因此患者多在运动时存在缺氧症状[13-15]。本研究结果显示,观察组患者干预后6MWD长于对照组,Borg呼吸困难评分高于对照组,且观察组患者干预后PaO2、OI高于对照组,表明心肺康复运动训练可有效增强IPF患者的运动耐量,减轻呼吸困难症状,还可改善患者的肺换气功能。
有研究表明,心肺康复运动训练除可锻炼肺的储备功能、提升胸腔容积外,还有利于增强患者的呼吸肌功能,预防肺泡塌陷,减小无效腔,从而促进呼吸力学指标恢复正常[16]。呼吸力学指标是近年临床评估患者呼吸功能常用的工程学观点方法,既往研究证实,ΔPtp升高提示肺组织损伤程度加重,其是患者预后不良的预测因素[17-19]。本研究结果显示,观察组患者干预后Ptp-ei、ΔPtp低于对照组,且IPF患者干预后Ptp-ei、ΔPtp与6MWD呈负相关,与Borg呼吸困难评分呈正相关,表明心肺康复运动训练可有效减少IPF患者呼吸肌做功,进而有利于提高患者的运动耐量,减轻呼吸困难症状。目前心肺康复运动训练虽已广泛应用于临床,但具体锻炼方法和运动强度仍缺少统一标准,其中动态运动训练主要包括步行、踏车及平板等[20]。踏车运动训练具有操作简单、安全、可个体化调控等优势,在目前缺少相关指南的情况下,是一种安全、有效的干预方案。
综上所述,心肺康复运动训练可有效改善IPF患者的肺通/换气功能,改善缺氧程度,减少呼吸肌做功,进而提高患者的运动耐量,减轻呼吸困难症状。但本研究纳入样本量较小,且未将心肺康复运动训练与其他康复措施进行对比分析,导致结果存在一定偏倚,后续还需进行大样本量的研究进一步探讨心肺康复运动训练与其他康复措施的对比。
作者贡献:赖德清、袁亚迪进行文章的构思与设计,论文的修订;袁亚迪进行研究的实施与可行性分析,结果分析与解释;谢晓梅、杨霞进行数据收集、整理、分析;赖德清撰写论文,负责文章的质量控制及审校,并对文章整体负责、监督管理。
本文无利益冲突。

