菌剂对苜蓿青贮发酵品质及微生物群落的影响
毛婷 牛永艳 郑群 杨涛 穆永松 祝英 季彬 王治业
(1. 甘肃省科学院生物研究所 甘肃省微生物资源开发利用重点实验室,兰州 730000;2. 甘肃华瑞农业股份有限公司,张掖 734500)
被称为饲草蛋白之王的紫花苜蓿是我国反刍动物的主要饲草来源,在我国东北、华北、西北等地区都适宜种植不同抗寒、耐盐、高产、抗病品种的紫花苜蓿。紫花苜蓿蛋白质含量高、微生物及矿物质含量丰富、氨基酸平衡,是一种优良的保健饲料[1]。在苜蓿主产区,由于雨水与热量同期,苜蓿收获季节在制备苜蓿干草过程中容易受到雨水、落叶等损失,很难晒制成优质的干草,紫花苜蓿的青贮成为解决上述问题较为理想的途径。紫花苜蓿属于豆科多年生草本植物,可溶性碳水化合物及干物质含量低,在青贮过程中难以快速降低pH,减少梭状芽胞杆菌生长、蛋白质水解和异氧发酵,提高青贮适口性[2]。因此,必需研究开发适宜于紫花苜蓿青贮的专一菌剂产品。
目前,关于菌剂产品的研究报道许多,市场上青贮的菌剂产品多样,品质层次不一。青贮菌剂主要以乳酸菌菌株为主,添加多种功能性酶,具有添加量小、安全、易操作、无污染等优势[3];青贮密封后可以快速降低pH,减少蛋白质的分解;抑制青贮发酵温度上升,减少干物质的损失;不宜发生二次发酵[4]。对于不同青贮原料开发不同青贮菌剂的研究报道有许多,俸祥仁等[5]以黑曲霉、乳酸菌及产软假丝酵母复配青贮菌剂并运用于甘蔗叶梢青贮中。Fijałkowska等[6]采用3种不同乳酸菌作用于甜菜中提高青贮有氧稳定性,降低产毒真菌的浓度。Hager等[7]以植物乳杆菌和小球菌复配菌剂,以提高辣根草和甜高粱青贮的发酵品质。目前关于苜蓿等豆科植物单独青贮的菌剂产品较少[8]。
绿汁发酵液是一种新型的乳酸菌类青贮菌剂,是将原料鲜草的汁液在厌氧条件下培养,富集原料上附着的野生乳酸菌中制备成棕色或棕黄色的液体[9]。绿汁发酵液中存在适宜于原料发酵所需的丰富的乳酸菌,Li等[10]报道了在38个苜蓿品种中分离得到84株乳酸菌隶属于7个属15个种及亚种。Chen等[11]研究了乳酸菌与纤维素酶联合使用改善苜蓿青贮发酵品质,影响瘤胃发酵对动物生产性能产生积极影响。在苜蓿绿汁发酵液中分离筛选能在低碳水化合物下生长、产酸能力强的菌株可用于开发苜蓿青贮菌剂。研究表明,产酸能力强的乳酸菌株能快速的降低青贮pH值,为其他有益菌的生长提供酸性环境[12];卢强等[13]研究发现在盐碱地苜蓿青贮的微生物中,可能存在为数不多的蓝细菌,并对盐碱地苜蓿的生长发育产生促进作用。包维臣等[14]研究发现在苜蓿青贮中添加植物乳杆菌可以使乳酸菌活菌数快速升高,并对梭菌、大肠菌群、酵母菌和霉菌等青贮有害微生物产生了抑制作用。青贮过程是微生物群落结构复杂变化的过程。不同青贮添加剂的添加对微生物群落结构有着不同的影响。
有关青贮的研究多是从不同青贮原料、青贮条件等对青贮期间或开封后微生物的影响方面进行探讨,较少将添加剂、青贮品质与微生物多样性结合进行深入探讨。本研究通过制备苜蓿绿汁发酵液分离筛选产乳酸能力强乳酸菌株并与实验室前期分离得到的菌株复配制备苜蓿青贮菌剂,研究不同的青贮菌剂对紫花苜蓿青贮的发酵品质和微生物群落多样性的影响,为青贮菌剂产品的开发提供理论依据与技术支撑。
1 材料与方法
1.1 材料
紫花苜蓿来自于甘肃张掖华瑞农业股份在有限公司种植地。青贮试验地位于张掖市民乐县,E 100°22'-101°13',N 37°56'-38°48',海 拔2 309 m。试验开展时间为2020年6月-9月,平均气温12℃-24℃,苜蓿原料有机组分如表1所示。

表1 紫花苜蓿鲜草的化学组成Table 1 Chemical composition of fresh alfalfa
1.2 方法
1.2.1 试验处理 苜蓿收割后,放置田间晾晒1-2 d,用烘干法检测水分含量为55%-60%。将晾晒水分含量为55%-60%的苜蓿切割为1-2 cm。4个处理组分别为:添加苜蓿绿汁发酵液(aFGJ组),添加进口菌剂贮生宜宝(YB组),添加复配菌剂GSSW(GSSW组)、及未添加菌剂作为对照(CK组),每个处理组9个重复。将处理后的苜蓿草装入50 L食品级塑料桶内压实封口后埋入地表下2 m贮存,样品分别于30 d、50 d、70 d取样检测青贮的发酵特性和化学成分。对70 d的青贮微生物种群进行分析。
1.2.2 苜蓿青绿汁发酵液的制备 收集花蕾期苜蓿250 g,加入等量蒸馏水,在搅拌器中研磨搅拌,然后通过2层纱布过滤得到绿汁。将绿汁液500 mL蓝盖瓶中,加入2%葡萄糖,置于厌氧培养箱37℃厌氧培养箱中恒温培养3 d得到苜蓿绿汁发酵液。采用梯度稀释法测定活菌数。
1.2.3 乳酸菌株的分离与鉴定
1.2.3.1 乳酸菌株的分离 将苜蓿绿汁发酵液做标准10倍浓度系列梯度稀释,分别取稀释度为10-3、10-4、10-5、10-6倍的菌液100 μL涂于MRS筛选 培养基上,每个稀释度做3个平行试验,培养基倒置放入37℃厌氧培养箱中培养48 h后观察菌落形态及是否产生钙溶圈。用游标卡尺测量培养基中钙溶圈直径和菌落直径,将两者的比值记为Dd,选取比值较大的菌株进一步划线纯化3代获得单菌落。
1.2.3.2 乳酸菌株的鉴定 利用微生物16S rDNA通用 引 物27F(5'-AGAGTTTGATCATGGCTCAG-3')、1492R(5'-TAGGGTTACCTTGTTACGACTT-3')对菌株16S rDNA序列进行扩增。菌落PCR条件:95℃ 5 min;95℃ 45 s,57℃退火50 s,72℃ 1 min,30循环;72℃延伸10 min。PCR产物纯化回收后送至上海生物技术有限公司测序,利用BLAST软件将测序结果与GenBank中已有序列进行比对,并建立系统发育树,确定菌株的种属。
1.2.4 青贮添加剂的特性 市售进口菌剂宜生贮宝(美国,成分:植物乳杆菌,乳酸片球菌,屎肠球菌,丙酸杆菌,枯草芽胞杆菌,黑曲霉;菌数:≧2.0×1010CFU/g)。按照说明书取0.1 g溶于200 mL水中,按规格均匀喷施于50 kg苜蓿上。产纤维素酶贝莱斯芽胞杆菌(Bacillus belais)K1和产淀粉酶枯草芽胞杆菌(Bacillus subtilis)J1保存于甘肃省工业微生物菌种保藏中心,保藏号分别为GSICC 42323和GSICC 78393。K1的羧甲基纤维素酶活性达到370 U/mL,J1的α-淀粉酶活性达到110 U/mL。将菌株K1,K2及在苜蓿绿汁发酵液中筛选到的乳酸菌按照1∶1混合,得到复合青贮菌剂GSSW。采用梯度稀释法测定活菌数,青贮添加量为105CFU/g苜蓿。
1.2.5 苜蓿青贮样品理化及发酵品质 pH值采用pH计检测;氨态氮(ammonia nitrogen,NH3-N),总氮(total nitrogen,TN)采用凯氏定氮仪[15];乳酸(lactic acid,LA)、乙酸(acetic acid,AA)及丁酸(butyric acid,BA)含量采用HPLC,KC-811离子色谱柱,柱温50℃,流动相为3 mmol/L HCLO4溶液,进样量5 μL[16];干物质(dry matter,DM)含量测定采用105℃烘干恒质量法[17];可溶性碳水化合物(water soluble carbohydrates,WSC)含量采用蒽酮-硫酸比色法[17];粗蛋白含量=总氮×6.2;酸性洗涤纤维(acid detergent fiber,ADF)、中性洗涤纤维(neutral detergent fiber,NDF)及木质素(lignin,LN)含量的测定采用纤维素测定仪。
1.2.6 青贮样品微生物多样性分析 无菌条件下取苜蓿绿汁发酵液200 mL及发酵70 d苜蓿青贮样品20 g与200 mL无菌生理盐水混合,分别在37℃振荡 2 h 制得菌悬液,无菌滤膜过滤获得微生物菌体,每个样品处理3个重复。按照Water DNA试剂盒步骤提取微生物总DNA。根据16S rDNA全长引物27F和1492R,合成带有Barcode的特异引物,进行PCR扩增并对其产物进行纯化、定量和均一化形成测序文库(SMRT Bell)采用PacBio Sequel进行测序。将测序结果与 NCBI 基因库比对,然后按照 97%相似性水平划分操作分类单元(OTU),选取最优序列作为代表性序列,基于OTU分析结果,对样品在各个分类水平上进行分类学分析,获得样品在门、纲、目、科、属、种分类学水平上的物种分布柱状图[18]。利用QIIME软件计算Alpha多样性分析研究单个样品物种丰度(richness)及物种多样性(diversity);Beta多样性(beta diversity)分析比较不同样品在物种多样性方面存在的相似程度[19]。
1.2.7 数据分析 试验数据经Excel 2007软件整理并用SPSS 20.0软件进行统计分析,结果用平均值±标准差表示。对不同处理组数据进行单因素和一般线性模型分析,P<0.05代表差异显著,P>0.05代表差异不显著。
2 结果
2.1 苜蓿绿汁发酵液中菌株的分离鉴定
根据MRS培养基上乳酸菌的菌落形态差异及钙溶圈比值大小,挑选Dd比值较大菌株共得到3株,分别为MXLZ-1、MXLZ-2、MXLZ-4,Dd比值分比为8.82、8.39、7.29。通过PCR扩增菌株16S rDNA片段,测序结果经BLAST同源性分析,选取亲缘关系最近的13个菌株序列,采用MEGA7.0构建系统发育树,如图1所示。从图中看出菌株MXLZ-1、MXLZ-2及MXLZ-4的16S rDNA序列分别与小片球菌(Pediococcus parvulus)、植物乳杆菌(Lactobacillus plantarum)及戊糖片球菌(Pediococcus pentosaceus)同源性≧99%。因此,菌株MXLZ-1、MXLZ-2及MXLZ-4分别鉴定为P. parvulus、L. plantarum及 P.pentosaceus。

图1 菌株16S rDNA基因序列系统发育树Fig.1 Phylogenetic tree of 16S rDNA gene sequence of strains
2.2 苜蓿青贮
在无菌条件下将菌株MXLZ-1、MXLZ-2、MXLZ-4分别接入100 mLMRS培养基,菌株K1、J1分别接入100 mL营养肉汁培养基培养,5种菌株发酵液按照1∶1∶1∶1∶1复配得到500 mL青贮菌剂GSSW。检测GSSW青贮菌剂菌数为1.1×108g/mL。检测苜蓿绿汁发酵液菌数为2.5×107g/mL。
2.3 苜蓿青贮营养成分变化
青贮时间及青贮添加剂对苜蓿营养品质的影响如表2所示。从表中可以看出,添加菌剂3组DM及CP含量明显高于CK组(P<0.05);随青贮时间的延长,4组DM及CP含量显著降低;YB组30 d DM含量达到最高为324 g/kg FM,GSSW组30 d CP含量达到最高为274 g/kg DM;与发酵前原料相比,YB与GSSW组CP含量显著增加。在青贮过程中WSC含量变化较大,发酵30 d、50 d时除CK组外,其余3个组WSC含量降低,70 d后WSC又有所升高,70 d时GSSW组WSC含量为67.8 g/kg DM,高于其他3个组(P<0.05)。添加菌剂GSSW组及YB组ADF、NDF值显著低于CK组,随着青贮时间的延长,添加菌剂3组ADF及NDF显著降低,而CK组无明显变化,50 d后ADF及NDF降低速度缓慢,GSSW组及YB组苜蓿青贮NDF值分别为284、260 g/kg DM,ADF分别为314、323 g/kg DM;青贮过程中除YB处理组LN值明显的降低外,其余3组无明显变化。

表2 青贮时间和青贮添加剂对苜蓿营养品质的影响Table 2 Effect of time and silage additive on the nutritional quality of alfalfa silage
2.4 苜蓿青贮发酵特性及微生物的代谢产物变化
青贮时间及青贮添加剂对苜蓿发酵品质的影响如表3所示。从表中可以看出,除CK组pH降低速度较慢外,其余3个组pH在发酵50 d后都能快速的降到5以下;在青贮70 d后GSSW组、YB组 及aFGJ组pH值 分 别 为4.20、4.25、4.80,添加GSSW、YB可有效降低青贮pH值,提高青贮品质;GSSW组青贮pH的降低速度明显高于aFGJ组。GSSW组氨氮/总氮含量明显低于其他组;CK组氨氮含量明显高于其他组。随着青贮时间的延长,GSSW组乳酸含量呈现先降低后轻微升高,而乙酸含量降低的趋势,在青贮50 d时,乳酸、乙酸含量分别为59.8、11.2 g/kg DM;YB组乳酸含量低于GSSW组而乙酸含量高于YB组;CK组在发酵30、50 d时乳酸含量无明显的增加而在70 d后显著增高(P<0.05);YB及GSSW组都未检测到丁酸含量,aFGJ组检测到丁酸含量明显低于CK组(P<0.05)。

表3 时间和添加剂对苜蓿青贮发酵品质的影响Table 3 Effect of time and silage additive on the fermentation quality of alfalfa silage
2.5 苜蓿青贮微生物群落分析
2.5.1 Alpha多样性 不同处理组青贮样品中的多样性指数分析如图2所示,Shannon稀释曲线显示曲线已经趋于平坦,其覆盖度均达到99%以上,表明样本测序量已经饱和,足够反映样本中绝大部分细菌物种的信息。

图2 多样本的香农曲线Fig.2 Multi-samples Shannon curves
2.5.2 Beta多样性分析 不同处理组青贮样品PCoA分析如图3所示。3个重复的样品点聚集在一起,表示3个样品重复性好,PC1贡献率为81.1%,PC2的贡献率为10.7%。CK组落在第一象限,GSSW组和YB组样品落在第二象限,和其他组样品的距离相对较远,GSSW组与YB组在物种上相似度较高。

图3 多样本的PCOA分析Fig.3 PCoA analysis of multi-samples
2.5.3 基于属种水平细菌微生物群落结构分析 12个样品测序后通过Barcode识别后共获得89 997条CCS 序列,每个样品至少产生7 387条CCS序列,平均产生7 500条CCS序列。图中显示丰度水平前十的物种,并将其他物种合并为Other在图中显示。不同处理组青贮样品属水平微生物群落结构如图4-A所示,不同处理组青贮样品属种类和分布比例有显著差异,4组属水平丰度较高的属均为Lactobacillis及Pediococcus;而添加3种菌剂的处理组,Lactobacillis丰度高于Pediococcus,CK组相反。不同处理组种水平微生物群落结构如图4-B所示,图中丰度大于5%的种中GSSW组微生物群落为植物乳杆菌(Lactobacillus plantarum,92.95%);YB组为植物乳杆菌(L. plantarum,85.50%)、戊糖 片 球 菌(Pediococcus pentosaceus,7.63%);aFGJ组 为 植 物 乳 杆 菌(L. plantarum,50.55%)、戊糖 片 球 菌(P. pentosaceus,29.90%)、短 乳 杆 菌(Lactobacillus brevis,8.91%);CK组为戊糖片球菌(Pediococcus pentosaceus,49.84%)、植物乳杆菌(L.plantarum,23.83%)、类肠膜魏斯氏菌(Weissella paramesenteroides,9.71%)、蒙氏肠球菌(Enterococcus mundtii,6.04%)。
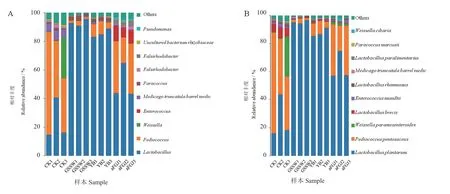
图4 样品属种水平微生物群落结构Fig.4 Microbial community structure of samples on the genus and species level
不 同 处 理 组L. plantarum,P. pentosaceus,L.brevis及E. mundtii相对丰度差异显著;添加3种菌剂的处理组L. plantarum 明显高于CK组而P.pentosaceus明显低于CK组;aFGJ组L.brevis明显高于其他3组;在CK组中E. mundtii丰度明显高于添加青贮菌剂的3组。
3 讨论
3.1 苜蓿青贮菌剂的分类
青贮菌剂主要分为发酵促进型添加剂、发酵抑制型添加剂、好氧性变质抑制剂、营养性添加剂及吸附剂[20]。其中以乳酸菌类添加剂属于发酵促进型添加剂,通过调节微生物的种类及数量从而促进其快速向低温和低损失的发酵过程转变。本实验从绿汁发酵液中通过产酸能力强的3株菌株经16S rDNA检测及系统发育树构建确定为P. pentosaceus、L. plantarum及P. parvulus,这一结果与Li等[21]等报道的绿汁发酵液中乳酸菌株包括L. plantarum、L.casei、L. brevis及Streptococcus faecalis等结果相符。绿汁发酵液通常会促生原料上附着的野生乳酸菌株,更适宜于苜蓿青贮。目前市售的青贮菌剂中除乳酸菌外还添加纤维素酶、淀粉酶等或产酶的芽胞杆菌菌株,Bai等报道[22]在苜蓿青贮中添加产生抗菌肽的B. subtilis可以改善青贮发酵品质,提高有氧稳定性。Rychen等[23]报道了在一定剂量下添加解B.belais可以改善青贮有氧稳定性。因此,在GSSW菌剂中,除了添加来自绿汁发酵液中高产酸野生乳酸菌株外还添加了实验室前期分离得到的产纤维素酶的B. belais K1及产淀粉酶的B. subtilis J1,调节苜蓿草营养成分及微生物的代谢组成。
3.2 苜蓿青贮营养及发酵品质
青贮过程是一个复杂的微生物活动和生物化学变化问题,原料成分会随着发酵不同阶段微生物的生长而成变化。随着青贮时间的延长,植物体类一系列的酶促反映都会造成蛋白质的水解。70 d时GSSW组WSC含量高于其他3个组,菌剂的添加可以促进饲草中纤维素类物质的分解释放出可被乳酸菌利用的糖,增加可发酵底物的量;青贮菌剂GSSW及YB组的添加可以提高原料中粗蛋白含量,快速降酸,减少干物质及粗蛋白的损失,这一研究结果与Li等[24]报道的内容一致。GSSW及YB组pH明显低于CK及aFGJ组,菌剂的添加可以快速降低青贮PH,这与Mariott等[25]的研究结果相同。有机酸的总量及构成可以反映青贮发酵品值,优质青贮饲料乳酸含量>50 g/kg DM,并占总有机酸60%以上;乙酸含量10-40 g/kg DM;丁酸含量越少或不含丁酸。GSSW及YB组乳酸含量明显高于CK组,菌剂的添加不仅可以使青贮早期产生较多酸,在青贮后青贮饲料中乳酸含量也高于一般青贮饲料,而丙酸乙酸含量明显降低。优质的苜蓿青贮饲料氨态氮/总氮的比例应<15%。GSSW组氨氮/总氮含量明显低于其他组,菌剂的添加可以减少蛋白质的分解,降低氨态氮/总氮含量,这一结论与Liu等[26]的研究结果一致。GSSW及YB菌剂的添加对于调整苜蓿营养成和改善发酵品质有着显著地作用。
3.3 苜蓿青贮微生物群落结构
在苜蓿青贮过程中微生物的组成与发酵产物的生产、青贮组分变化、青贮的品质优质密切的关系。研究表明青贮发酵品质与发酵过程的微生态演变密切相关[27]。4个处理组发酵70 d苜蓿青贮样品中丰度较高的属为Lactobacillis、Pediococcus、Weisella及Enterococcus,这与Tohno等[28]报道的青贮有关乳酸菌等相一致。GSSW组种水平乳酸菌株有植物乳杆菌(L. plantarum,92.95%)、戊糖片球菌(P.pentosaceus,2.36%)与GSSW菌剂中的菌株相符,说明GSSW菌剂中菌株可以在苜蓿青贮中大量繁殖,适宜于苜蓿青贮并发挥重要作用。GSSW菌剂复配时添加了芽胞杆菌属菌株,但在青贮发酵70 d后未检出,分析原因为发酵70 d已进入发酵稳定阶段,厌氧条件下不适宜芽胞杆菌属菌株生长,芽胞杆菌属菌株主要是在青贮初期好氧发酵阶段进行繁殖。
添加菌剂处理组L. plantarum 明显高于CK组而P. pentosaceus明显低于CK组;L. plantarum属于兼性异型发酵乳酸菌,相比于异型发酵乳酸菌可以更好地利用原料中的营养物质,减少营养成分的损失。GSSW组相比于其他组L. plantarum相对丰度越高,产酸速度快,乳酸含量高,pH值降低,减少蛋白质的分解,降低氨态氮含量,这一结果与GSSW组营养及发酵品质数据相对应。青贮70 d样品中,添加GSSW菌剂及进口菌剂YB组pH值分别为4.20、4.25,明显低于CK组,乳酸含量分别为44.5 g/kg DM、52.3 g/kg DM,明显高于CK组。Zhao等[29]报道L. plantarum是青贮中重要菌株,可以快速产酸,为其他乳酸菌的生长提供酸性环境。GSSW组及YB组微生物群落结构中L. plantarum均占主要优势,而在自然青贮条件下P. pentosaceus占主要优势,这一实验结果也验证了L. plantarum对青贮pH,乳酸含量影响显著。不同菌剂处理组中L. plantarum / P.pentosaceus值为GSSW组>YB组>aFGJ组,乳酸含量为GSSW组>YB组>aFGJ组,而pH及氨氮/总氮 为aFGJ组>YB组>GSSW组。L. plantarum / P.pentosaceus值与青贮乳酸含量呈正相关,与pH及氨氮/总氮呈负相关,比值越高,青贮品质越佳。E.mundtii在CK组中相对丰度明显高于添加菌剂3组,E. mundtii在发酵初期与乳酸菌竞争可溶性碳水化合物,减缓青贮的酸化,因此,CK组青贮品质低于添加菌剂3组。正是由于发酵过程中有益乳酸菌群占据优势主导地位,生成一定量的乳酸从而使pH值快速下降,才使得上述腐败菌被有效抑制,从而更好地保存发酵原料的营养物质,青贮中微生物的种类及数量对于青贮品质有着显著地影响。
4 结论
添加青贮菌剂均能增加有益菌的数量,减少有害菌数量,改善苜蓿青贮发酵品质。苜蓿青贮中L.plantarum及 P. pentosaceus的含量及比值对青贮优良发酵品质和组分变化起着重要作用。GSSW菌剂处理后青贮苜蓿品质优于与市场在售菌剂YB,可运用于苜蓿青贮。

