原发性干燥综合征相关间质性肺疾病的发生率及危险因素分析
张 科, 何雪春, 陈 超, 韩燕英
(广东省梅州市人民医院 风湿免疫科, 广东 梅州, 514000)
原发性干燥综合征(pSS)是一种自身免疫性疾病,其发病原因尚未明确,可能与免疫、遗传、感染等因素有关[1]。pSS的典型临床表现为口眼干燥、疲劳及疼痛等,并可累及多个系统。pSS患者中有30%~40%伴有全身性并发症,导致预后不良[2]。由于肺部组织中含有丰富的脉管及结缔组织,是pSS较常累及的器官; 研究[3-4]显示,淋巴细胞性间质性肺炎及淋巴瘤是pSS累及肺部的典型病理学特点, 9%~75%的pSS患者会出现肺部受累,常表现为间质性肺疾病(ILD), 而pSS-ILD患者的生活质量明显降低,病死率明显增高。既往有关pSS-ILD影响因素的研究报道尚无确切定论。因此,本研究分析原发pSS-ILD患者的发生率及危险因素,以期为pSS-ILD的早期诊断、干预提供依据,现报告如下。
1 资料与方法
1.1 一般资料
回顾性纳入2010年6月—2020年12月本院收治的278例pSS患者,按照肺部高分辨CT检查结果分为pSS-ILD组83例与pSS组195例。纳入标准: ⑴ 患者的pSS诊断符合《原发性干燥综合征2002年国际分类(诊断)标准》[5]。① 口干燥症状(3项中有1项或1项以上); ② 眼干症状(3项中有1项或1项以上); ③ 眼部体征(1项或1项以上阳性); ④ 组织学检查为小唇腺淋巴细胞灶≥1; ⑤ 唾液腺受损(1项或以上阳性); ⑥ 自身抗体为抗SSA和/或抗SSB(+)。⑵ 患者年龄≥18岁。⑶ 临床及影像学资料完整者。⑷ 患者及家属均知情同意。排除标准: ① 合并其他自身免疫性疾病、结缔组织疾病和其他肺部疾病者; ② 伴有肿瘤、感染、肝脏疾病、贫血、肾衰竭等疾病者; ③ 既往进行过胸部放疗、肺泡灌洗等治疗者; ④ 已知其他原因(如药物、职业暴露等)导致的ILD者。本研究经过医学伦理审查。
1.2 方法
所有pSS患者均进行了高分辨CT检查,影像学表现为磨玻璃影、蜂窝影、网格影等判定为pSS-ILD, 判定结果由2位呼吸科医师和2位影像科医师共同确定。
1.3 观察指标
收集2组患者的基线资料、临床症状、实验室指标。① 基线资料主要包括性别、年龄、病程、吸烟史等; ② 临床症状主要包括发热、口干、眼干、关节疼痛、雷诺现象、咳嗽、咳痰、胸闷气喘、乏力等; ③实验室指标主要包括白细胞(WBC)、血红蛋白(Hb)、血小板(PLT)、嗜中性粒细胞、血沉(ESR)、C反应蛋白CRP)、补体C3、补体C4、免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、类风湿因子、抗核抗体滴度、抗SSA抗体、抗SSB抗体等。
1.4 统计学分析
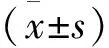
2 结 果
2.1 2组基线资料比较
经肺部高分辨CT检查, 278例pSS患者中诊断出pSS-ILD患者83例,发生率为29.86%。pSS-ILD组的年龄大于pSS组,吸烟史比例高于pSS组,差异有统计学意义(P<0.05); 2组性别构成及病程比较,差异均无统计学意义(P>0.05)。见表1。

表1 2组基线资料比较
2.2 2组临床症状比较
pSS-ILD组的咳嗽、咳痰及胸闷气喘发生率高于pSS组,差异有统计学意义(P<0.05); 2组之间其他临床症状发生率比较,差异均无统计学意义(P>0.05)。见表2。

表2 2组临床症状比较[ n(%)]
2.3 2组实验室指标比较
pSS-ILD组的WBC、嗜中性粒细胞、补体C3、补体C4水平及抗核抗体滴度、抗SSA抗体阳性率高于pSS组,差异有统计学意义(P<0.05); 2组之间其他实验室指标比较,差异均无统计学意义(P>0.05)。见表3。
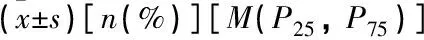
表3 2组实验室指标比较
2.4 多因素Logistic回归分析
以pSS-ILD组与pSS组之间具有统计学差异的年龄、吸烟史、咳嗽、咳痰及胸闷气喘、WBC、嗜中性粒细胞、补体C3、补体C4、抗核抗体滴度、抗SSA抗体阳性率为变量进行多因素Logistic回归分析,结果显示: 年龄、吸烟史及抗核抗体滴度是pSS患者发生ILD的独立影响因素(P<0.05)。见表4。
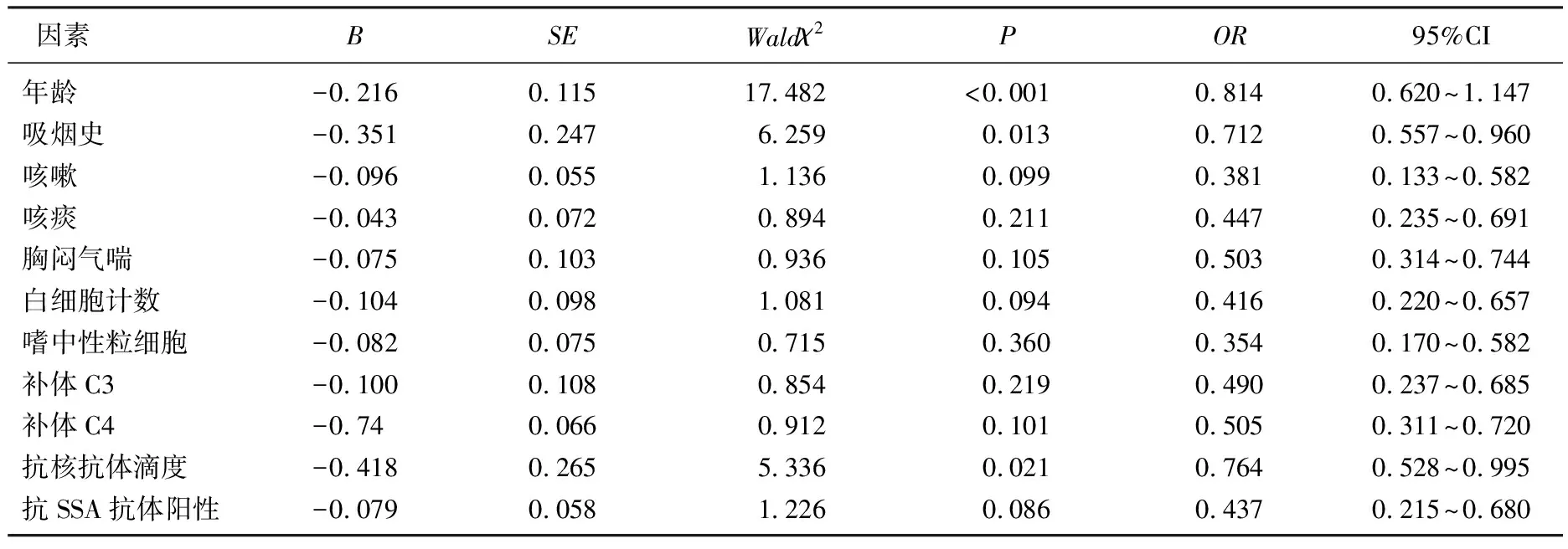
表4 pSS-ILD危险因素的多因素Logistic回归分析
3 讨 论
pSS能够通过淋巴细胞和浆细胞对靶器官进行浸润,对靶器官造成损伤。pSS患者出现肺部受累在临床上比较常见,临床表现多样化,而ILD是最为常见的肺部受累类型。一旦合并ILD, 患者的预后更差,病死率更高, 5年病死率超过15%,10年病死率增高4倍[6]。因此对pSS-ILD的发生率进行调查,对相关危险因素进行分析,具有重要的临床意义。一项基于853例pSS患者的队列研究[7]发现, 165例pSS患者合并ILD, pSS-ILD的发生率为19.34%; 黄菁梅等[8]研究显示, pSS-ILD的发生率为50%(15/30); 陈晓静等[9]对非吸烟女性pSS-ILD进行了研究,发现pSS-ILD的发生率为41.46%(34/82)。本研究调查显示, pSS-ILD的发生率为29.86%(83/278), 与相关研究存在差异,可能与样本量、样本来源及诊断方式有关。
一项研究[10]发现,与单纯pSS患者比较, pSS-ILD患者的年龄更大,吸烟比例更高; 也有研究[11]显示, pSS-ILD患者的吸烟比例明显高于单纯pSS患者; 但也有研究[12]证实吸烟比例在2组之间无明显差异。本研究中, pSS-ILD患者的年龄大于单纯pSS患者,吸烟史比例明显高于单纯pSS患者,与齐海宇等[13]的研究结果一致; 将年龄、吸烟史纳入多因素Logistic回归分析,结果显示高龄及吸烟是pSS患者发生ILD的独立危险因素,与GAO H等[7]的研究一致,分析原因可能是高龄患者机体中诱发自身免疫功能发生变化的物质更多,从而导致肺间质纤维化,而吸烟是促进肺部纤维化的重要因素。
pSS-ILD患者的临床症状多样,特异性不强。与单纯pSS患者相比, pSS-ILD患者以干咳为主要临床表现,咳嗽、胸闷等上呼吸道症状的发生率为40%~60%[14]。本研究中pSS-ILD患者的咳嗽、咳痰及胸闷气喘发生率明显高于单纯pSS患者,与黄春艳[15]研究结果相符; 但是高鑫等[16]研究表明pSS-ILD患者的口干、眼干、关节肿痛发生率更低,而本研究中2组之间无明显差异,可能与病情程度有关。以往研究[17]证实, pSS患者中的血清抗SSA抗体、抗SSB抗体、抗核抗体、类风湿因子等血清学指标升高与ILD的发生存在着密切关系。本研究中pSS-ILD患者WBC、嗜中性粒细胞、补体C3及补体C4水平,抗核抗体滴度,抗SSA抗体阳性率明显高于单纯pSS患者,与宋国婧等[18]研究结果基本一致; 但多因素Logistic回归分析显示咳嗽、咳痰及胸闷气喘、WBC、嗜中性粒细胞、补体C3及补体C4水平、抗SSA抗体阳性率并不是pSS患者发生ILD的影响因素。当pSS患者出现以上临床症状或实验室指标异常时,也应当警惕ILD的发生风险。
抗核抗体又称抗核酸抗原抗体,可特征性地出现于许多自身免疫性疾病中。高惠英等[19]研究发现, pSS-ILD患者与单纯pSS患者的抗核抗体阳性率比较无明显差异; 而王建军等[20]研究显示, pSS-ILD患者血清抗核抗体阳性率明显高于单纯pSS患者; 路武杰[21]研究发现, ILD是pSS常见的系统损害, pSS-ILD的发生与自身抗体有关; 国外研究[22]也证实, pSS-ILD的发生与抗核抗体存在密切关系。一项荟萃分析[23]显示,抗核抗体不是pSS-ILD发生的影响因素; 陈晓静等[9]研究表明,抗核抗体滴度升高(OR=0.585, 95%CI: 0.355~0.963,P=0.035)是非吸烟女性pSS患者出现ILD的独立危险因素; 蒋培培等[24]通过Logistic回归分析显示抗核抗体阳性率升高是pSS患者出现ILD的危险因素。而本研究通过多因素Logistic回归分析发现,高水平抗核抗体滴度是pSS患者发生ILD的独立危险因素,可能与样本量及纳入标准有关,还需深入研究。
综上所述,本组研究中pSS-ILD的发生率较高,高龄、吸烟及高抗核抗体滴度提示pSS患者发生ILD的风险明显增高。但本研究存在一定的局限性,部分临床资料无法获取,例如病理资料,且没有随访; 此外,ILD病理类型繁多,需要进行肺部组织活检,属于有创操作,在ILD的临床实践中并没有广泛普及。因此,今后还需要进一步深入分析。

