超声造影和剪切波弹性成像评估颈动脉斑块及其与急性冠状动脉综合征的关系
钟世根 张存程 李雪霖
近年来,外周动脉疾病已被列为冠状动脉粥样硬化性心脏病(以下简称冠心病)的等危症[1]。亚临床阶段的外周动脉粥样硬化与冠心病病变程度、范围等密切相关[2-3]。其中颈动脉位置表浅且固定,超声检测易识别且可重复性好,临床应用价值较高[4-8]。本研究应用实时剪切波弹性成像(shear wave elastography,SWE)和超声造影检测冠心病患者颈动脉粥样硬化斑块,评估斑块性质及类型,并分析斑块与急性冠状动脉综合征(acute coronary syndrome,ACS)的关系,以期为临床早期预测冠状动脉病变提供依据。
资料与方法
一、研究对象
选取2019年1月至2020年12月于我院心血管内科及老年科住院行多导联心电图、心肌酶谱、心脏彩超、冠状动脉造影/CTA检查明确为冠心病患者88例,男51例,女37例,年龄69~91岁,平均(78.3±7.9)岁。其中稳定性冠心病43例为SCHD组,非ST抬高型ACS(近3个月内发生过包括非ST抬高型心肌梗死、不稳定性心绞痛)45例为ACS组。ACS组有吸烟史26例,高血压病史31例;SCHD组有吸烟史20例,高血压病史29例。排除严重肝肾疾病、严重心力衰竭、恶性心律失常、恶性肿瘤、1个月内有外伤或手术史、脑卒中、高热、妊娠、急性感染、风湿病等。本研究经我院医学伦理委员会批准,入选者均知情同意。
二、仪器与方法
1.常规超声和SWE检查:使用法国声科Aixplorer彩色多普勒超声诊断仪,SL15-4线阵探头,频率4~15 MHz。嘱患者充分暴露颈部,行常规颈动脉超声检查,记录二维声像图和彩色血流频谱,观察颈动脉是否存在斑块,本研究将局限性内-中膜厚度≥1.5 mm定义为斑块,记录斑块大小、形态及内部回声。按照斑块声学特征分为三类:低回声斑块、高回声斑块、混合回声斑块[9]。选取目标斑块(多发斑块选取视觉上回声最低的斑块)进行检测,取斑块长轴切面,调节仪器以获得视觉清晰图像为标准。启动SWE模式获得二维灰阶与剪切波的实时对比成像状态,选取杨氏模量量程为0~180 kPa,待图像稳定后冻结并保存图像,启动定量工具Q-Box Trace,描记斑块轮廓,测量3次取平均值,得到斑块的杨氏模量平均值、最大值和最小值。
2.超声造影检查:使用Philips iU 22彩色多普勒超声诊断仪,L9-5线阵探头,频率8~12 MHz;机械指数0.28~0.32;配备QLAB分析软件。完成目标斑块弹性测量后进行超声造影检查。检查前于患者肘正中静脉置入20 G静脉留置针备用;检查时嘱患者尽量平静呼吸,避免大幅度呼吸运动和吞咽运动,减少颈动脉周围组织运动对颈动脉斑块位置的干扰。造影剂选用示卓安(活性成分为全氟丁烷微球,GE医疗公司,每瓶16μl),造影前用2 ml随附注射用水复溶后静脉注射(0.12μl/kg),随后用5~10 ml生理盐水冲管。应用QLAB分析软件进行定量分析,选取整个斑块为颈动脉斑块的感兴趣区(ROI),斑块正上方管腔为管腔的ROI,手动描记斑块及管腔的ROI轮廓,记录斑块面积(A)、灌注情况,软件自动生成的时间-强度曲线(TIC),应用动态血管模型技术对输出的TIC进行再处理,得到动态血管模型曲线,记录斑块最大增强强度(Imax)、达峰时间(TTP),并计算斑块相对管腔的最大增强密度(Dmax)。斑块造影是否增强以超声定量分析指标为准,测量3次取平均值为最终结果。
3.一般资料收集:入选者均详细采集病史,行全面的体格检查及肝肾功能、血脂、血糖、胸片、心电图、超声心动图等辅助检查,并收集相关数据。
三、统计学处理
应用SPSS 19.0统计软件,计量资料以±s表示,行独立样本t检验;计数资料以例或率表示,行χ2检验。二分类Logistic回归分析颈动脉斑块与ACS的关系。P<0.05为差异有统计学意义。
结 果
一、两组一般资料比较
两组间性别比、吸烟史比较差异均有统计学意义(均P<0.05),年龄、高血压病史、糖化血红蛋白、血脂、高敏C反应蛋白及肌钙蛋白Ⅰ水平比较差异均无统计学意义。见表1。

表1 两组一般资料比较
二、两组常规超声检查结果比较
常规超声显示,ACS组中低回声斑块检出率和混合回声斑块检出率均高于SCHD组,差异均有统计学意义(均P<0.05);两组高回声斑块检出率比较,差异无统计学意义。见表2。
表2 两组斑块检出率比较(±s) %
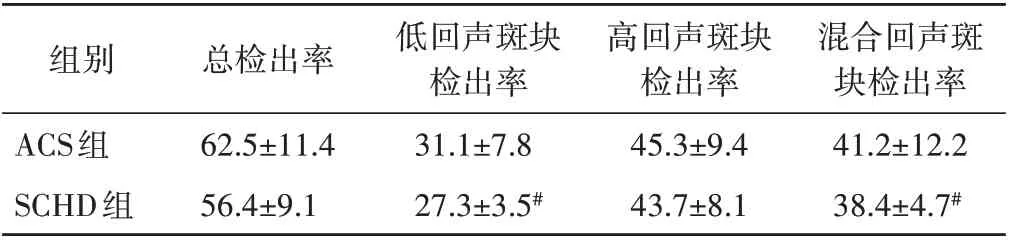
表2 两组斑块检出率比较(±s) %
与ACS组比较,#P<0.05
组别ACS组SCHD组混合回声斑块检出率41.2±12.2 38.4±4.7#总检出率62.5±11.4 56.4±9.1低回声斑块检出率31.1±7.8 27.3±3.5#高回声斑块检出率45.3±9.4 43.7±8.1
三、两组超声造影检查结果比较
造影增强显示,ACS组TTP较SCHD组更短,全部斑块Dmax高于SCHD组,差异均有统计学意义(均P<0.05)。见表3和图1。

图1 产后1 d超声心动图左室长轴切面示肿瘤呈椭圆形,回声均匀,边界清晰,占据绝大部分左室

图1 两组颈动脉斑块和管腔超声造影图、二维超声图及TIC图
表3 两组超声造影参数比较(±s)
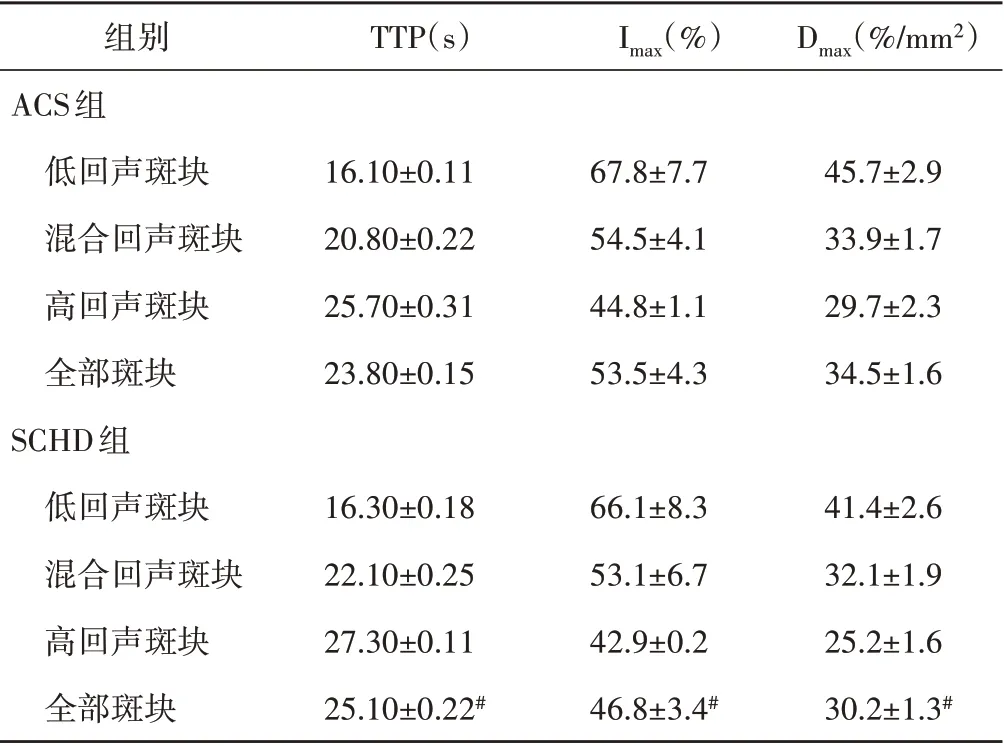
表3 两组超声造影参数比较(±s)
与ACS组比较,#P<0.05。TTP:达峰时间;Imax:最大增强强度;Dmax:最大增强密度
组别ACS组低回声斑块混合回声斑块高回声斑块全部斑块SCHD组低回声斑块混合回声斑块高回声斑块全部斑块TTP(s)Imax(%)Dmax(%/mm2)16.10±0.11 20.80±0.22 25.70±0.31 23.80±0.15 67.8±7.7 54.5±4.1 44.8±1.1 53.5±4.3 45.7±2.9 33.9±1.7 29.7±2.3 34.5±1.6 41.4±2.6 32.1±1.9 25.2±1.6 30.2±1.3#16.30±0.18 22.10±0.25 27.30±0.11 25.10±0.22#66.1±8.3 53.1±6.7 42.9±0.2 46.8±3.4#
四、两组SWE检查结果比较
SWE图像显示:低回声斑块表现为浅而均匀的蓝绿色,高回声斑块和混合回声斑块表现为红色或红蓝相间的混杂图形(图2)。两组杨氏模量最大值、最小值及平均值比较,差异均有统计学意义(均P<0.05)。见表4。

图2 孕38周产前超声胎儿四腔心切面示肿瘤呈椭圆形,回声均匀,边界清晰

图2 颈动脉斑块SWE图
表4 两组杨氏模量值比较(±s) kPa

表4 两组杨氏模量值比较(±s) kPa
与ACS组比较,#P<0.05
组别ACS组SCHD组杨氏模量平均值44.1±11.8 51.9±9.7#杨氏模量最小值21.4±2.1 27.1±2.9#杨氏模量最大值52.9±12.3 60.5±10.8#
五、Logistic回归分析
Logistic回归分析显示,斑块造影增强的Dmax是ACS发生的独立危险因素(O R=2.853,95%可信区间0.161~7.091,P<0.05)。见表5。
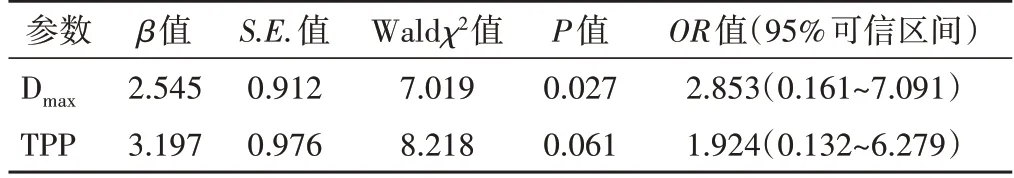
表5 二分类变量Logistic回归分析结果
讨 论
冠心病是危害人类健康的主要疾病,尽早预测冠状动脉粥样硬化对于冠心病的防治有重要的临床意义[10]。颈动脉是动脉粥样硬化的好发部位之一,其位置表浅,可避开骨性组织遮挡,易显示及探测,可作为评估全身大中型动脉硬化的“窗口”[11]。颈动脉斑块的稳定性能间接反映冠心病患者冠状动脉病变特点[12]。研究[13]表明,斑块的不稳定性与其内部新生血管的产生密切相关系。新生血管数量密度影响斑块稳定性[14]。若斑块内新生血管发育不成熟,则易出现红细胞及炎症因子的渗漏,引起斑块内出血,诱发炎症和新生血管形成的循环。斑块内出血中的红细胞膜提供了游离胆固醇,并导致脂质坏死核心的体积不断增大,进一步促进斑块的不稳定性[15]。超声造影技术对颈动脉斑块的评估与组织形态学具有很好的相关性,研究[16-17]显示斑块的不稳定性与其内部新生血管的产生密切相关。本研究发现ACS组与SCHD组Imax、Dmax及TTP比较,差异均有统计学意义(均P<0.05),说明ACS组斑块内存在新生血管的比例更大,新生血管数量更多,斑块更具易损性,更易发生ACS事件。
斑块的新生血管数量密度并非斑块稳定性的唯一因素,斑块硬度对其的稳定性的也存在一定影响,SWE技术能定量评估斑块的杨氏模量值,量化斑块性质,通过硬度反映斑块成分,从而间接反映斑块病理结构[18-19]。杨氏模量值越低,斑块内脂质成分所占比例越大,其易损性越高,即斑块的不稳定性更高,发生ACS的风险越大[20]。研究[21]显示即使在血液流动的情况下,SWE对量化颈动脉斑块模型的杨氏模量值也具有很好的再现性。本研究中,ACS组杨氏模量最大值、最小值及平均值均低于SCHD组,差异均有统计学意义(均P<0.05),表明ACS组斑块易损性更高。该结果与超声造影诊断结果相符合。
Logistic回归分析显示,颈动脉粥样硬化斑块Dmax是ACS发生的独立危险因素(O R=2.853,95%可信区间0.161~7.091,P=0.027),提示颈动脉斑块的稳定性与冠状动脉病变的严重程度显著相关。将斑块硬度特性研究与斑块内新生血管血池显像相结合,可提高评估颈动脉斑块稳定性的诊断价值。
本研究的局限性:多数患者未接受外科手术获取病理学资料以明确斑块组织成分;同时,由于样本量有限,缺乏长期随访,对于斑块易损性和稳定性研究尚需进一步探讨。
综上所述,应用超声造影和SWE技术能定量评估斑块内部新生血管和斑块硬度,且其与ACS密切相关,为冠心病缺血事件的早期风险预测提供新的诊断思路。

