基于新型血小板指数评分构建预测膀胱癌患者术后复发的列线图模型
张欣雨,王智宇,赵文元,马保录,陶 涛
(1.青海省交通医院泌尿外科,青海西宁 810008;2.郑州大学第一附属医院泌尿外科,河南郑州 450000;3.青海大学附属医院泌尿外科,青海西宁 810008)
膀胱癌(Bladder cancer,BC)根据临床进展和预后不同可分为非肌层浸润性膀胱癌(non muscle invasive bladder cancer,NMIBC)和肌层浸润性膀胱癌(muscle invasive bladder cancer,MIBC)两种亚型,其中75%患者被诊断为NMIBC[1]。经尿道膀胱肿瘤切除术是NMIBC患者标准一线治疗方法。然而,NMIBC治疗后5年复发率和5年进展率分别在50%~70%和10%~30%之间[2]。因此,首次治疗后建议定期检查,必要时切除复发肿瘤和后续治疗[3]。但是NMIBC在所有癌症患者中拥有最高终生治疗成本,显著加重肿瘤治疗总医疗成本[4]。根据肿瘤复发风险对NMIBC患者进行早期风险分层,可以为术后补充治疗及制定个体化随策略提供理论依据。欧洲癌症研究和治疗组织(European Organization for Research and Treatment of Cancer,EORTC)制定了评分系统对NMIBC患者预后进行风险分层,但EORTC评分系统具有一定的局限性[5]。
几项研究证实,血小板计数(platelet count,PLT)、血小板分布宽度(mean platelet volume,PDW)和平均血小板体积(platelet distribution width,MPV)与不同类型肿瘤[6-7](包括BC[8])的预后相关,可能为预后风险分层及评估提供有价值的临床信息。但是,由于缺乏有效的统计学方法,尚未有研究将PLT、PDW和MPV进行整合。因此,本研究构建并验证包括PPM血小板指数评分(PLT-PDW-MPV platelet index score,PPM-PIS)在内的其他肿瘤特征的列线图(nomogram)模型,以预测NMIBC患者术后复发的个体化风险。
1 资料与方法
1.1 一般资料选取2013年1月至2020年2月在我院行治疗的NMIBC患者。纳入标准:①年龄>18岁;②符合NMIBC诊断标准及经尿道膀胱肿瘤切除术适应证[9];③原发性NMIBC,无远处转移;④临床数据完整。排除标准:①使用已知会影响血小板活化及功能药物患者;②继发性恶性肿瘤患者;③术前未进行新辅助化疗、放疗患者;④严重心、肝、肾等疾病,自身免疫性疾病,急性感染、炎症或血液病患者;⑤既往脾切除术、急性心肌梗死、脑卒中患者;⑥12个月内有激素治疗史或近1个月有输血史患者。最终纳入270例NMIBC患者。本研究患者均签署知情同意书且获得医院伦理委员会批准通过。
1.2 研究方法
1.2.1数据收集 收集患者年龄、性别、体质指数(body mass index,BMI)、吸烟史、肿瘤数目、肿瘤直径、肿瘤分级、T分期、原位癌、淋巴血管侵犯、白蛋白(albumin,ALB)、淋巴细胞(lymphocyte,LYM)、PLT、PDW、MPV。吸烟史定义为既往或目前每日吸烟3支或以上,吸烟史1年或以上。预后营养指数(prognostic nutritional index,PnI)=LYM(×109/L)×5+ALB(g/L)[10]。
1.2.2随访管理 所有患者均接受前2年每3个月、后3年每6个月及以后每年一次的体格检查、血液检查、尿常规、生化检查及膀胱镜检查。如果怀疑复发或转移,进行放射学评估,如静脉肾盂造影、计算机断层扫描和磁共振成像。复发被认为是膀胱或前列腺尿道内的第1次肿瘤复发,与肿瘤分期无关,且均经组织病理学证实。无复发生存时间定义为从术后到临床诊断复发的时间或者末次随访。
2 结 果
2.1 290例NMIBC患者临床资料具体见表1。
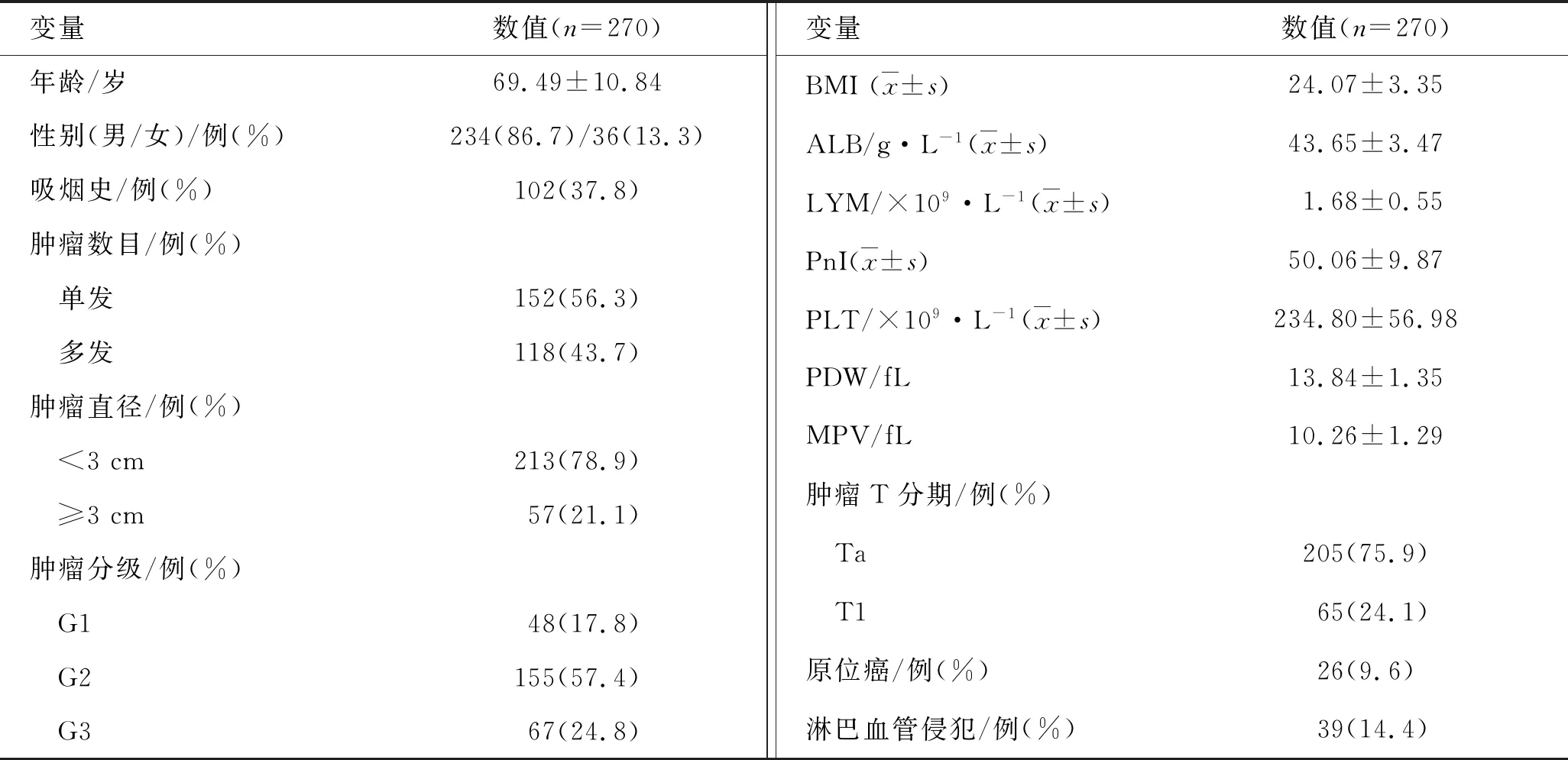
表1 290例NMIBC患者的临床资料
2.2 相关连续性变量ROC曲线分析年龄、BMI、PLT、PDW、MPV、PnI的AUC分别为0.691、0.582、0.780、0.731、0.718、0.720;最佳截断值分别为57岁、22.87、266×109/L、14.7 fL、11.7 fL、50.47(表2、图1)。
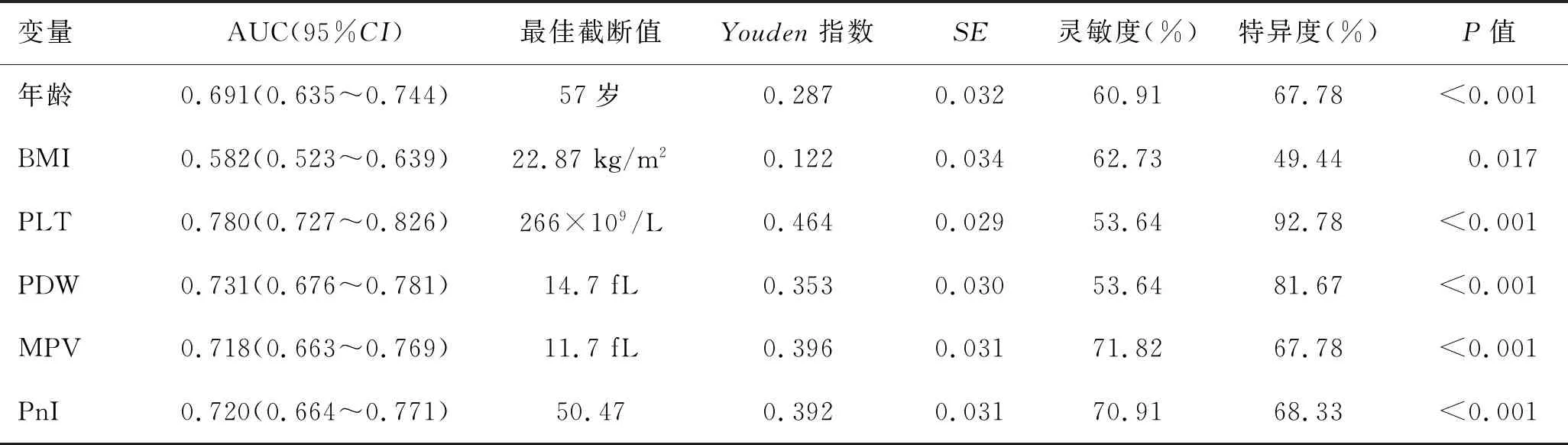
表2 相关连续性变量ROC曲线分析结果
2.3 不同PLT、PDW、MPV分组的生存曲线分析270例NMIBC患者随访时间10.7~85.7个月,中位随访时间61.8个月。2年复发率6.7%,3年复发率22.6%,5年复发率48.1%。PLT>266×109/L(n=110)、PDW>14.7 fL(n=87)、MPV≤11.7 fL(n=96)患者的无复发生存率低于PLT≤266×109/L、PDW≤14.7 fL、MPV>11.7 fL患者(P<0.05)。见图2。
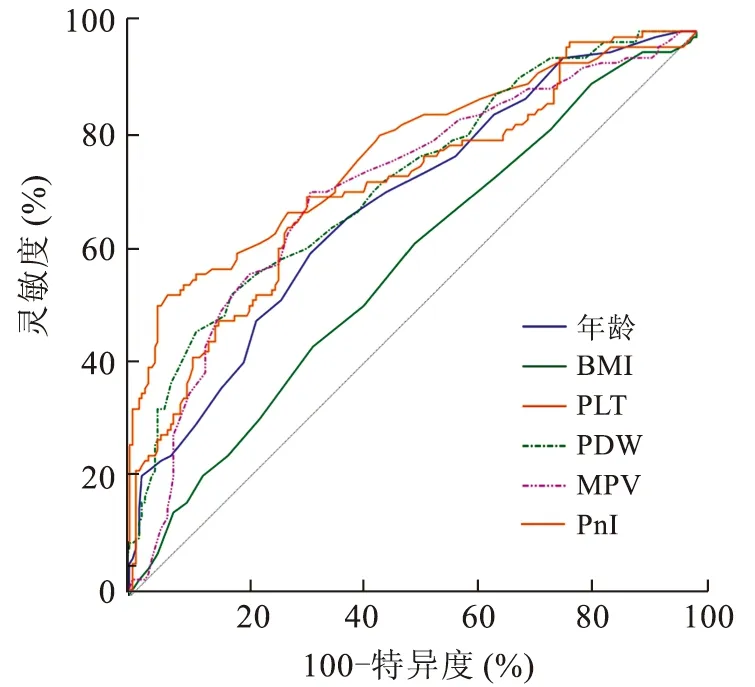
BMI:体质指数;PLT:血小板计数;PDW:血小板分布宽度;MPV:平均血小板体积;PnI:预后营养指数。图1 相关连续性变量ROC曲线
2.4 PPM-PIS构建及生存曲线分析根据PLT、PDW、MPV最佳截断值构建PPM-PIS,评分标准见表3。不同PPM-PIS分值的无复发生存率存在统计学差异(P<0.05,图3)。
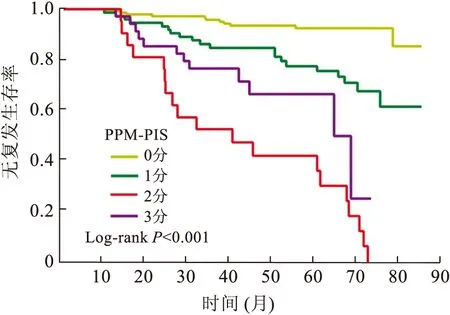
图3 不同PPM-PIS分值生存曲线分析
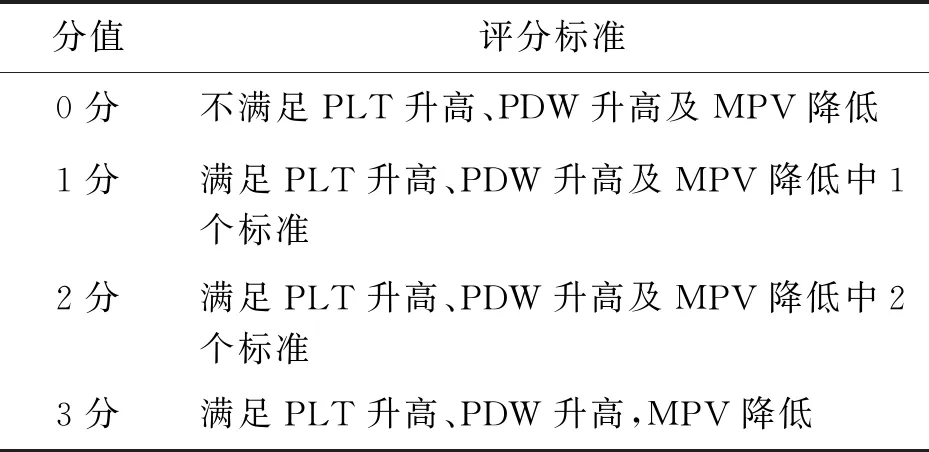
表3 PPM-PIS构建的评分标准
2.5 不同PPM-PIS分值临床资料特点不同PPM-PIS分值的吸烟史、肿瘤数目、肿瘤直径、肿瘤分级、T分期、原位癌及淋巴血管侵犯比例、PnI差异具有统计学意义(P<0.05,表4)。
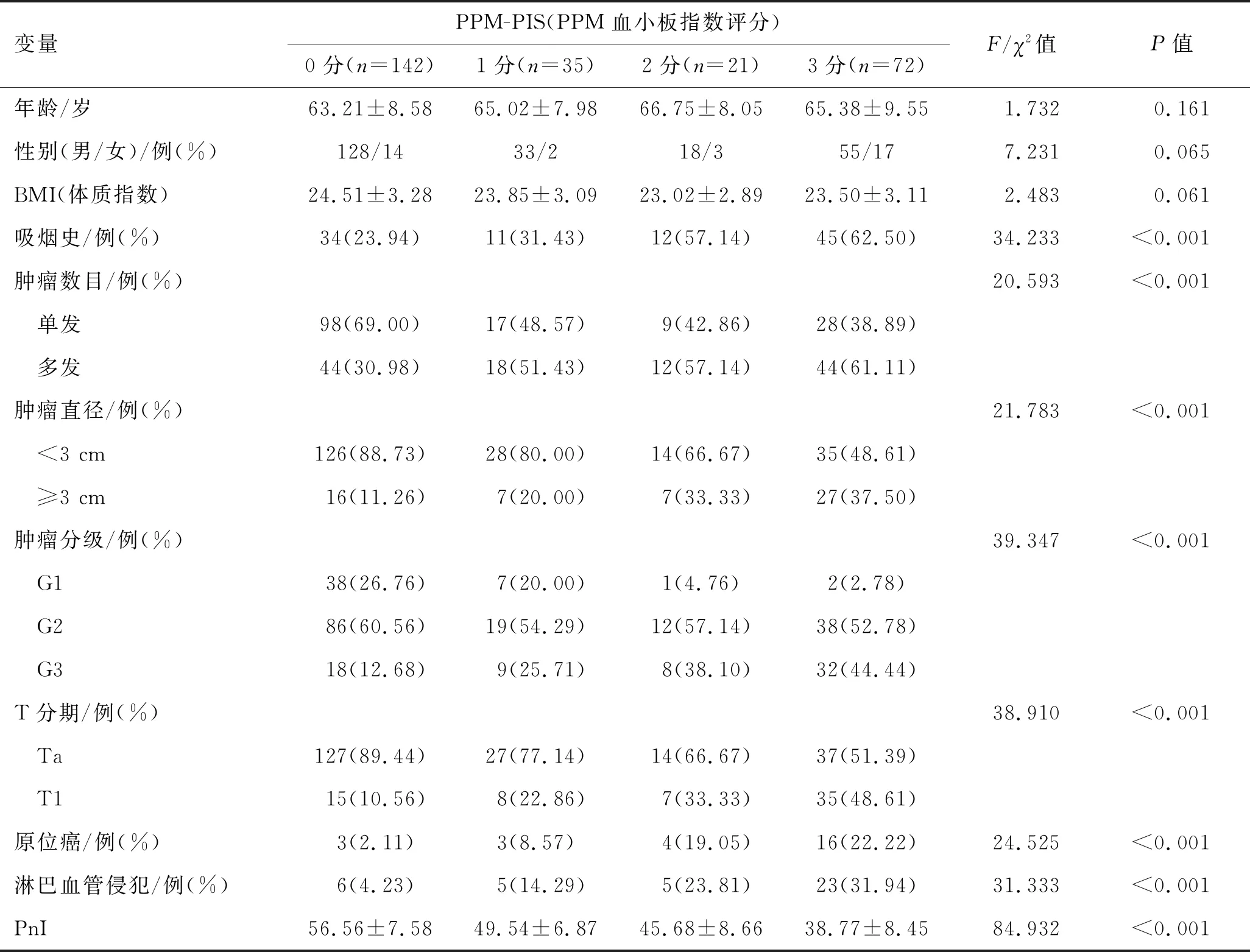
表4 不同PPM-PIS分值临床资料比较
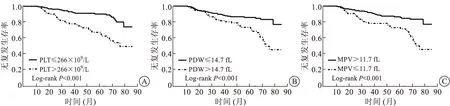
A:PLT(血小板计数);B:PDW(血小板分布宽度);C:MPV(平均血小板体积)。图2 不同PLT、PDW、MPV分组的生存曲线
2.6 NMIBC患者复发的Cox比例风险模型分析单因素Cox比例风险模型分析结果显示年龄(>57岁)、吸烟史(是)、肿瘤数目(多发)、肿瘤直径(≥3 cm)、肿瘤分级(G2、G3)、T分期(T1)、原位癌(是)、淋巴血管侵犯(是)、PnI(≤50.47)、PPM-PIS是促进NMIBC患者复发的危险因素(P<0.05)。
多因素Cox比例风险模型分析结果显示肿瘤直径(≥3 cm)、T分期(T1)、淋巴血管侵犯(是)、PnI(≤50.47)和PPM-PIS独立增加NMIBC患者复发风险(P<0.05,表5)。
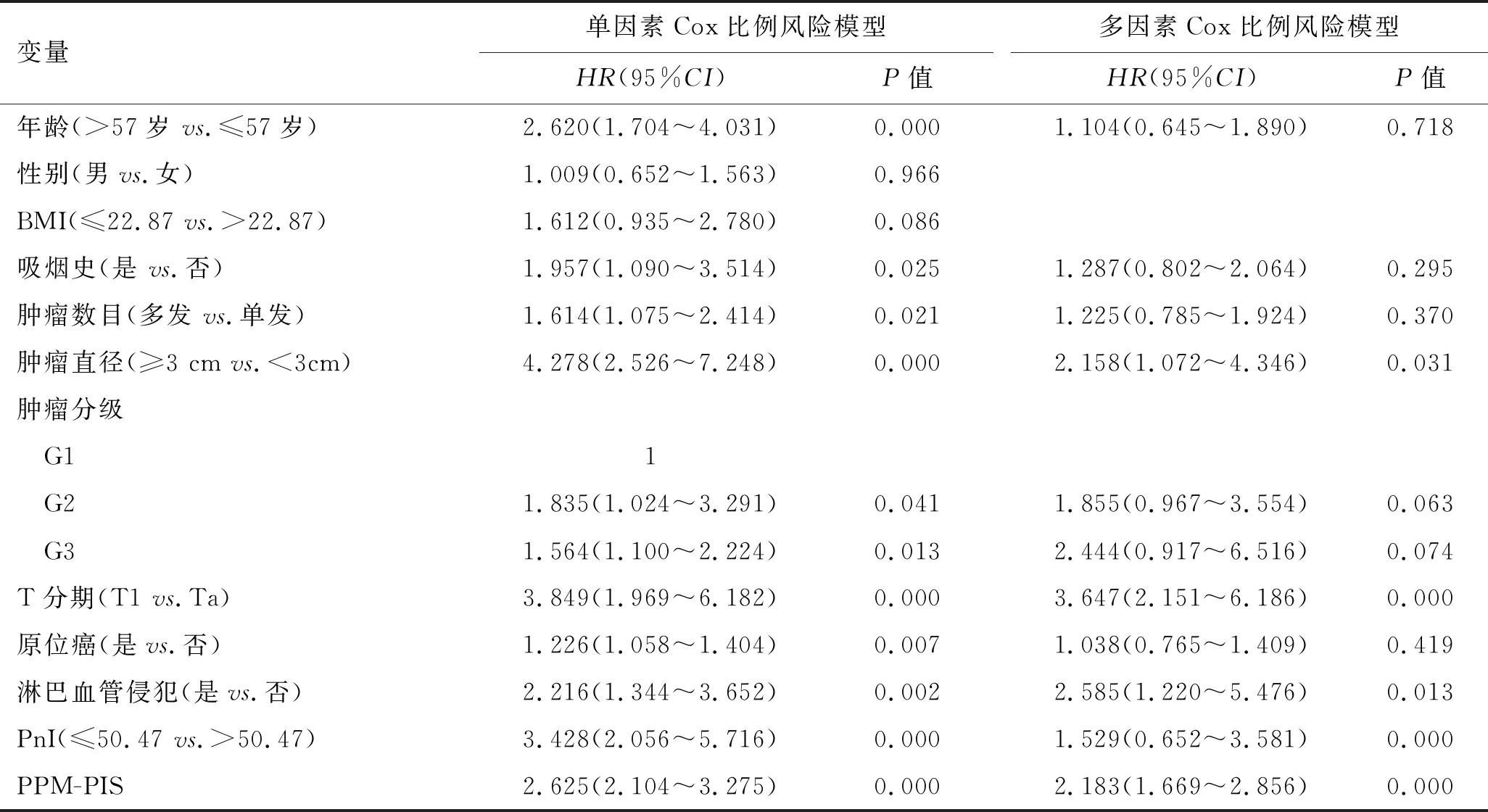
表5 NMIBC患者复发的Cox比例风险模型分析结果
2.7 NMIBC患者无复发生存率的nomogram模型构建及外部验证分析将肿瘤直径、T分期、淋巴血管侵犯、PnI和PPM-PIS作为预测NMIBC患者术后无复发生存率的nomogram模型预测指标(图4)。内部验证结果显示,nomogram模型预测NMIBC患者2年、3年、5年无复发生存率的C-index为0.815(95%CI:0.765~0.878)、0.734(95%CI:0.711~0.816)、0.755(95%CI:0.706~0.811,图5)。
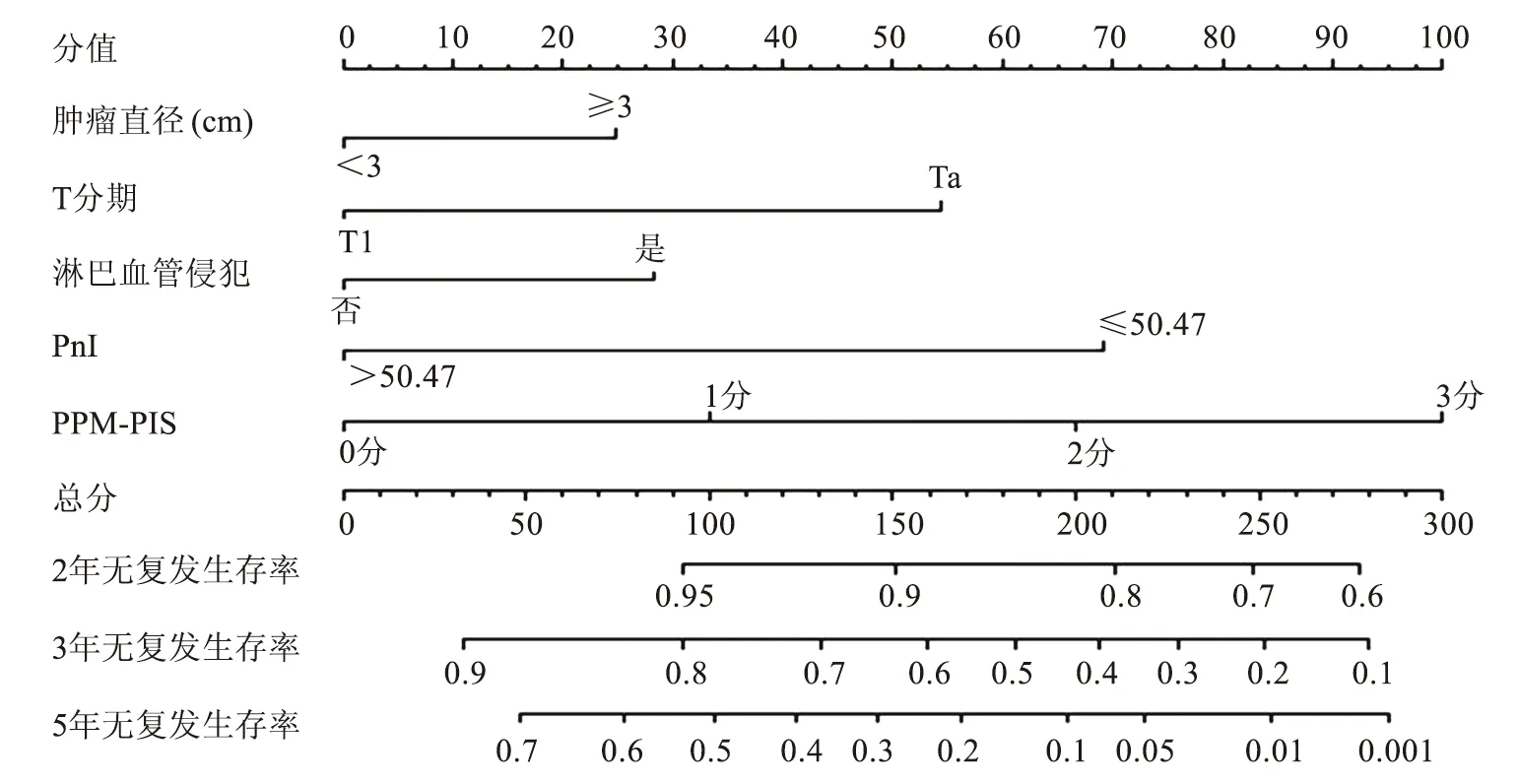
PnI:预后营养指数;PPM-PIS:PPM血小板指数评分。图4 预测NMIBC患者术后无复发生存率的列线图(nomogram)模型
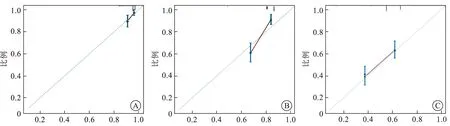
A:2年;B:3年;C:5年。图5 预测NMIBC患者术后2~5年无复发生存率的列线图(nomogram)模型校正图
2.8 nomogram模型的临床获益分析采用决策曲线分析来评估本研究构建的预测NMIBC患者术后无复发生存率nomogram模型临床获益。在决策曲线分析中,构建3种临床模型:PPM-PIS、肿瘤直径+T分期+淋巴血管侵犯+PnI及nomogram模型。在无复发生存时间的四分位时间点对3种临床模型进行临床获益评价。在40.5、61.8、70.6个月时间点,nomogram模型的临床获益显著优于PPM-PIS和肿瘤直径+T分期+淋巴血管侵犯+PnI。在40.5个月时间点,PPM-PIS和肿瘤直径+T分期+淋巴血管侵犯+PnI临床获益相当,而61.8个月及70.6个月时间点,肿瘤直径+T分期+淋巴血管侵犯+PnI临床获益高于PPM-PIS(图6)。
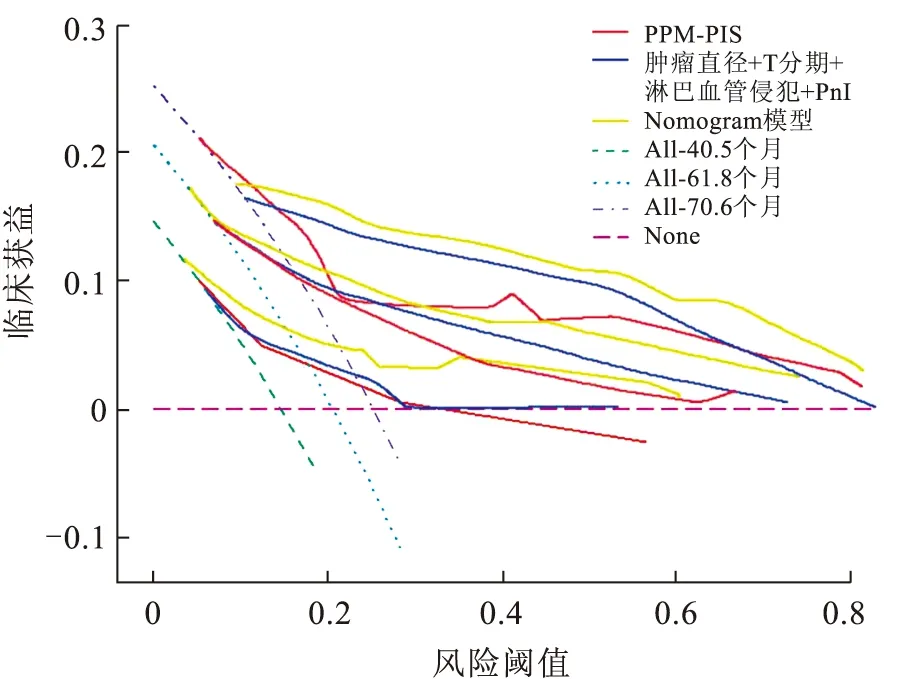
图6 不同模型不同时间点的决策曲线
3 讨 论
3.1 nomogram模型预测的效果这项研究对290例NMIBC患者肿瘤相关因素和预后进行研究。观察到PLT和PDW水平升高以及MPV降低患者复发率较高。随后整合这些血小板指数,成功构建PPM-PIS并证实能独立预测NMIBC患者复发。为进一步整合本研究在预测NMIBC患者复发的独立变量,构建预测NMIBC患者术后无复发生存率nomogram模型。内部验证及决策曲线分析结果证实该nomograms可以准确预测NMIBC患者术后无复发生存率,能有效区分高复发风险的NMIBC患者,指导临床医师完善术后补充治疗及个体化随策略。
3.2 PLT、MPV与癌症的关系在许多癌症中,PLT和PDW水平升高及MPV水平降低与不良预后相关,包括结直肠癌[1-2]、非小细胞癌[11]、颅底脊索瘤[7],在BC中也被证实与预后相关[9]。正如本研究结果显示PLT>266×109/L、PDW>14.7 fL、MPV≤11.7 fL患者的无复发生存率低于PLT≤266×109/L、PDW≤14.7 fL、MPV>11.7 fL患者。与上述临床研究报道结果相似。PLT水平升高可促进CD40配体产生,促进炎症反应[12]。而炎症反应通过诱导活性氧和随后DnA损伤参与肿瘤发生及进展,通过分泌各种细胞因子促进肿瘤细胞生长和血管生成,增强肿瘤细胞粘附力,并诱导肿瘤微转移[13]。此外,PLT分泌的血小板衍生生长因子(platelet-derived growth factor,PDGF)家族通过与各自受体结合在细胞增殖和侵袭中起着至关重要的作用[14],最近两项研究均证实BC中PDGF-β表达增高与肿瘤生物学行为有关[15]。此外,血小板分泌的血管内皮生长因子(vascular endothelial growth factor,VEGF)能促进肿瘤血管生成[16],与原发性BC患者复发相关[17]。PDW和MPV作为血小板活化指标,其水平异常可能与巨核细胞功能障碍和骨髓造血系统异常有关。PDW是血小板体积平均值的变异系数。与正常个体相比,PDW值越高表明体积差异不稳定。
MPV是血小板活化早期指数。MPV降低可能是炎症状态下大血小板消耗增加的结果[18]。研究也表明低水平MPV与高度炎症性疾病相关,并在抗炎治疗过程中逆转[18]。但是,PLT和PDW水平升高以及MPV降低在NMIBC中的促癌机制目前尚未完全清楚。未来需要更多临床或基础实验来阐述NMIBC中PLT、PDW和MPV水平变化的分子机制。
PLT是由血小板产生率和血小板消耗率之间平衡决定的。正常PLT可以在有效代偿机制下掩盖高凝状态和促炎癌症表型存在[19]。本研究对PLT、PDW和MPV进行整合,构建PPM-PIS评分。该评分结合3个血小板指数的病理生理学机制及临床优点,充分反映NMIBC患者高凝状态和促炎癌症表型。我们发现PPM-PIS与肿瘤数目、肿瘤直径、肿瘤分级、T分期、原位癌及淋巴血管侵犯相关。进一步分析证实PPM-PIS评分能独立预测NMIBC患者复发并独立于肿瘤直径、T分期、淋巴血管侵犯、PnI。
3.3 本研究的优势及局限性本研究将肿瘤直径、T分期、淋巴血管侵犯、PnI和PPM-PIS进一步整合,构建出预测NMIBC患者术后无复发生存率的nomogram模型。内部验证结果显示,nomogram模型预测NMIBC患者2、3、5年无复发生存率的C-index为0.815(95%CI:0.765~0.878)、0.734(95%CI:0.711~0.816)、0.755(95%CI:0.706~0.811)。决策曲线分析显示在40.5、61.8及70.6个月时间点,nomogram模型临床获益显著优于PPM-PIS和肿瘤直径+T分期+淋巴血管侵犯+PnI。需要指出本研究构建nomogram模型中纳入PnI,而基于PnI构建的nomogram模型预测NMIBC患者术后1、3、5年无复发生存率的C-index为0.785、0.734、0.704[20]。相比而言,本研究构建nomogram模型的预测效能显著优于张杜平[20]等学者所购建的。
虽然本研究成功构建一个可以有效准确预测NMIBC患者术后2、3、5年无复发生存率的nomogram。但是本研究具有一定的局限性。首先,本研究属于单中心回顾性研究,存在不可避免地选择偏差;其次,纳入患者数量有限,仅采用内部数据集进行验证;最后,PLT、PDW和MPV的最佳阈值在临床中并未得到有效解决,可能因研究机构不同而不同,导致潜在的临床有效性有限。
综上所述,本研究基于PLT、PDW和MPV整合出PPM-PSI,并成功构建一种新型nomogram模型来预测NMIBC患者术后复发风险。该nomogram模型能更好地指导临床实践,以区分早期可能受益于手术治疗的患者,并为术后补充治疗及制定个体化随策略提供理论依据。