表儿茶素对急性肺损伤小鼠抗氧化应激和抗炎作用研究*
李泽林,代红丽,沈晓静,2,付晓萍,冯 励,王雪峰,普岳红,范江平
(1.云南农业大学 食品科学技术学院,云南 昆明 650201;2.云南农业大学 理学院,云南 昆明 650201)
表儿茶素(epicatechin,EC)属于天然植物黄烷醇类化合物,广泛存在于葡萄、蓝莓、茅莓、可可、茶树、茶叶、苹果和丽江山荆子等食物及药食同源植物中,具有抗肿瘤、抗氧化、抗炎、改善糖尿病和神经退行性病变、预防心血管疾病和免疫调节等作用[1-3],其中以抗氧化和抗炎活性研究为主。阮洪生等[4]在EC 对脂多糖诱导的小鼠单核巨噬细胞RAW264.7的抗炎作用研究中发现:EC 通过减少分泌炎性细胞因子的量和抑制分裂原激活的蛋白激酶(mitogen activated protein kinases,MAPK)信号通路中磷酸化的P38 分裂原激活的蛋白激酶(P38)、细胞外信号调节激酶(ERK)和c-jun N 端激酶(JNK)蛋白的磷酸化发挥抗炎症作用。WANG 等[5]也对脂多糖诱导的小鼠单核巨噬细胞RAW264.7研究发现:EC 浓度为5、25 和50 μmol/L 时,可呈剂量依赖性抑制包括一氧化氮(NO)和前列腺素E2 (PGE2)在内的促炎介质的产生。AHN 等[6]发现表儿茶素是红毛丹提取物中主要的抗氧化活性物质。刘永玲等[7]对八月瓜叶、果皮和果肉中酚类含量及其抗氧化能力分析时发现:八月瓜果皮中主要的活性物质是EC,并且具有较强的体外抗氧化活性和ABTS+自由基清除能力。然而,关于EC 体内的抗炎和抗氧化研究报道则较少。
急性肺损伤(acute lung injury,ALI)是一种常见的急性呼吸窘迫综合征,具有较高的发病率和致死率[8]。ALI的发病机制非常复杂,目前研究发现在机体遭受严重创伤、感染、休克和内毒素等肺内、外因素干扰时会造成肺损伤,肺损伤的发生会降低过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSHPx)和超氧化物歧化酶(superoxide dismutase,SOD)等酶的活性,使体内的抗氧化失衡[9],而氧化应激及炎症反应失控将会进一步导致肺损伤的发展[10-11]。此外,肺损伤会加重炎性细胞的浸润,释放白细胞介素-6 (interleukin-6,IL-6)、肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)和白细胞介素-1β (IL-1β)等促炎症因子,同时激活丝裂原活化蛋白激酶(MAPK)信号通路和核因子-κB (nuclear factor-κB,NF-κB)等通路[12-14]。最近,研究发现天然黄酮类物质的干预可以提高体内抗氧化酶的活性以及通过调节炎症因子的含量和抑制相关炎症通路的激活改善模型鼠的ALI。左文朴[15]发现天青葵黄酮F 呈剂量依赖性改善大鼠ALI 炎症因子含量以及阻断炎症相关的蛋白通路激活,并从免疫、炎症、细胞凋亡和自噬等方面阐明了天青葵黄酮F 对大鼠ALI的影响。ZHI等[16]发现富集黄酮的黄芩根提取物可以有效缓解流感病毒引起的ALI。
本研究通过气管滴注法[17]滴注脂多糖(lipopolysaccharide,LPS)建立ALI 模型,探索EC 对其诱导的ALI 小鼠氧化应激和炎症的调节作用,以期为EC的充分应用与深度开发提供理论依据。
1 材料与方法
1.1 材料
SPF 级雄性BALB/c 小鼠36 只,体质量20~30 g/只,4~5 周龄,2019 年6 月5 日购于昆明医科大学[许可证编号SCXK (滇) k2015—0002],普通饲料饲喂。
EC (纯度>98%,货号:SE8100—20 mg)、LPS(货号:L8880—10 mg)、CAT 试剂盒(货号:BC0 200)、GSH-Px 试剂盒(货号:BC1190)、丙二醛试剂盒(MDA,货号:BC0020)、SOD 试剂盒(货号:BC0175)、蛋白质羰基含量检测试剂盒(货号:BC1275)和NO 含量检测试剂盒均购自北京索莱宝科技有限公司;IL-1β (货号:KE10 003)、IL-6 (货号:KE10007)、TNF-α (货号:KE10 002)酶联免疫吸附测定试剂盒、p38 MAPK (货号:14064-1-AP—50 μL)、p44/42 (ERK1/2,货号:4370T)、JNK (货 号:4668T)、β-actin (货号:66009-1-Ig—100 μL)一抗、HRP-Goat Anti-Rabbit IgG (H+L)和HRP-Goat Anti-Mouse IgG(H+L)二抗(货号:SA00001-2—100 μL、SA000 01-2—100 μL)购自美国Proteintech 公司;Phospho-p44/42 (ERK1/2,货 号:4370T)、Phospho-SAPK/JNK (货号:4668T)和Phospho-p38 MAPK(货号:4511T)一抗购自美国Cell Signaling Technology 公司;预制胶购自美国BIAO-RAD 公司。
1.2 仪器与设备
DHG-9203AD 恒温干燥箱:上海览浩仪器设备有限公司;Nikon Eclipse E100 正置光学显微镜:日本尼康公司;Multiskan FC 酶标仪:美国ThermoFisher 公司;1658001 电泳仪、转膜仪和ChemiDoc™ Touch 化学发光仪:美国Bio-RAD公司。
1.3 方法
1.3.1小鼠ALI 模型的建立
小鼠适应性饲养7 d 后随机分为空白对照组(CK,n=6)、脂多糖(LPS,10 mg/kg,n=6)模型组和脂多糖+表儿茶素(LPS+EC,n=6)预处理组。其中LPS+EC 预处理组连续腹腔注射给药EC (40 mg/kg),CK 组和LPS 组给等量生理盐水。连续给药3 d,且最后一次给药前4 h 断食、断水后,腹腔注射水合氯醛麻醉小鼠,手术滴注LPS,建模处理6 h后用乙醚迷晕小鼠,眼球取血后立即颈椎脱臼处死小鼠,每组随机抽取6 只小鼠右肺用于肺组织湿/干质量比值(W/D)测定,采集另外一半肺组织的支气管肺泡灌洗液(BALF),其余6 只则进行Western-blot 等相关指标测定。
1.3.2小鼠肺湿干质量比的测定
除去右肺上叶组织的水分和部分血液后放入已称好质量的EP 管中称量其湿质量;再将其置于60 ℃的恒温烘箱中干燥72 h,烘干至恒重,称量其干质量。计算小鼠肺组织湿/干质量比值(W/D)。
1.3.3抗氧化和炎症因子的测定
按照CAT、GSH-Px、MDA、SOD、蛋白质羰基含量检测试剂盒、NO 含量检测试剂盒、IL-1β、IL-6 以及TNF-α 酶联免疫吸附测定试剂盒说明书分别进行CAT、GSH-Px、MDA、SOD、蛋白质羰基含量、NO 含量、IL-1β、IL-6 和TNFα 等相关指标的测定。
1.3.4磷酸化蛋白表达的测定
提取肺部蛋白,BCA 测定其蛋白含量后用BIAO-RAD 预制胶在300 V 条件下电泳20 min,转膜10 min;5%脱脂牛奶封闭2 h,滴加ERK(1∶1 000)、P38 (1∶1 000)、JNK (1∶2 000)、p-P38 (1∶1 000)、p-ERK (1∶1 000)、p-JNK (1∶2 000)一抗,4 ℃孵育48 h;用含0.1% Tween 20的TBS 冲洗后,滴加二抗(1∶5 000)室温下孵育2 h,再用0.1% TBST 冲洗后化学发光成像,用图像分析软件Image J 分析其蛋白表达。
1.3.5数据处理与分析
采用SPSS 19.0 软件进行数据分析,采用Image J 软件进行蛋白条带灰度值换算,所有试验均重复3 次,结果以“平均值±标准差”表示。
2 结果与分析
2.1 EC 对小鼠肺组织湿干质量比的影响
肺细胞和毛细血管遭到破坏其通透性增加,大量的细胞内液和毛细血管血释放进入到肺泡间质和肺泡腔内,甚至进入到支气管中造成水肿。如表1 所示:与空白对照组相比,LPS 模型组W/D 值显著上升(P<0.05),其上升率为39.46%,而LPS+EC 预处理组则减缓其比值的上升,其减缓比率为20.12%。说明LPS 可诱导小鼠产生肺部水肿并使小鼠肺组织产生炎症,而EC 预处理可抑制小鼠肺组织毛细血管通透性的改变,降低其肺组织的水肿程度。

表1 EC 对小鼠肺组织湿干质量比(W/D)的影响Tab.1 Effect of EC on the wet/dry weight ratio (W/D) of lung tissue in mice
2.2 EC 对LPS 致小鼠肺部氧化损伤的影响
由表2 可知:模型组小鼠中MDA 含量显著增加(P<0.05),EC 预处理能够显著抑制小鼠肺内MDA的产生(P<0.05)。与模型组相比,EC 预处理使肺组织抗氧化酶(SOD、CAT和GSHPx)活性均显著(P<0.05)降低;同时,EC 极显著(P<0.01)地抑制蛋白质羰基的产生,一定程度维持了正常的蛋白质功能。这说明EC能维持小鼠肺内抗氧化系统稳定,维持蛋白正常功能,同时降低脂质过氧化,缓解LPS 导致的小鼠ALI。
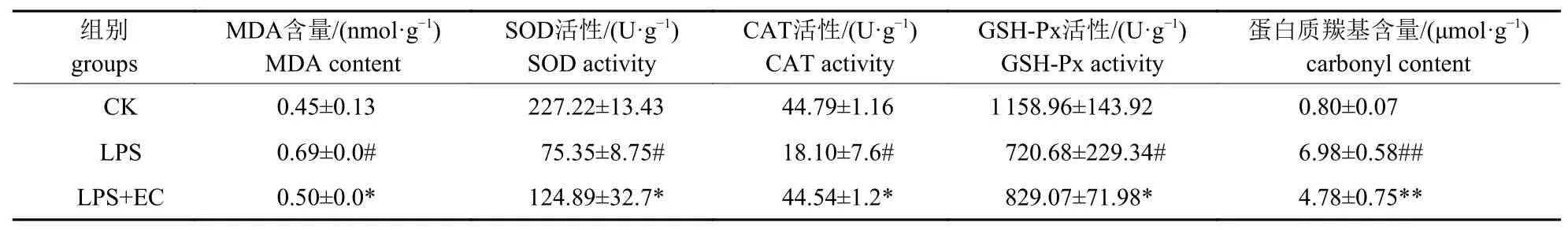
表2 EC 对LPS 致小鼠肺部氧化损伤的影响Tab.2 Effect of EC on LPS-induced oxidative damage in lungs of mice
2.3 EC 对小鼠肺组织NO 含量的影响
由表3 可知:LPS的刺激使肺组织内NO的含量极显著增加(P<0.01),而EC 预处理可以极显著(P<0.01)抑制LPS 诱导的NO 产生,抑制率达36.20%。这说明EC 能有效抑制LPS 诱导ALI小鼠肺组织内NO 含量的增加。

表3 EC 对小鼠肺组织NO 含量的影响Tab.3 Effect of EC on the NO content of lung tissue in mice
2.4 EC 对小鼠血清、BALF 和肺组织中炎症因子的影响
当肺部发生损伤时其内部抗炎和促炎的动态平衡将遭到破坏,抗炎症介质的分泌因药物作用而被抑制造成促炎症介质大量堆积。如图1所示:与空白组相比,LPS的刺激使小鼠血清、BALF 和肺组织中的促炎症因子TNF-α、IL-1β和IL-6 含量显著增加,但LPS+EC 组与LPS 组相比促炎症因子的含量均呈不同程度降低,说明EC 预处理能有效维持急性肺损伤小鼠血液及肺内抗炎和促炎的动态平衡。
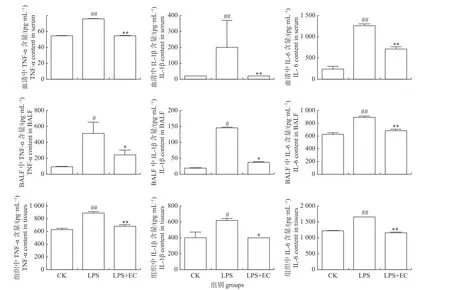
图1 EC 对小鼠血清、BALF 和肺组织匀浆炎症因子的影响Fig.1 Effect of EC on the inflammatory factors in serum,BALF and tissues
2.5 EC 对小鼠肺组织中磷酸化P38、ERK 和JNK蛋白的影响
如图2 所示:与空白组相比,LPS 模型组p-JNK/JNK (P<0.05)、p-ERK/ERK (P<0.01)和p-P38/P38 (P<0.01)的比值显著升高,但在LPS+EC 组中三者的比值则显著降低。这说明EC 预处理能降低LPS 诱导后MAPK 信号通路中关键的3 个蛋白的磷酸化水平升高,EC的预处理减缓LPS诱导的肺损伤炎症的加重进程。
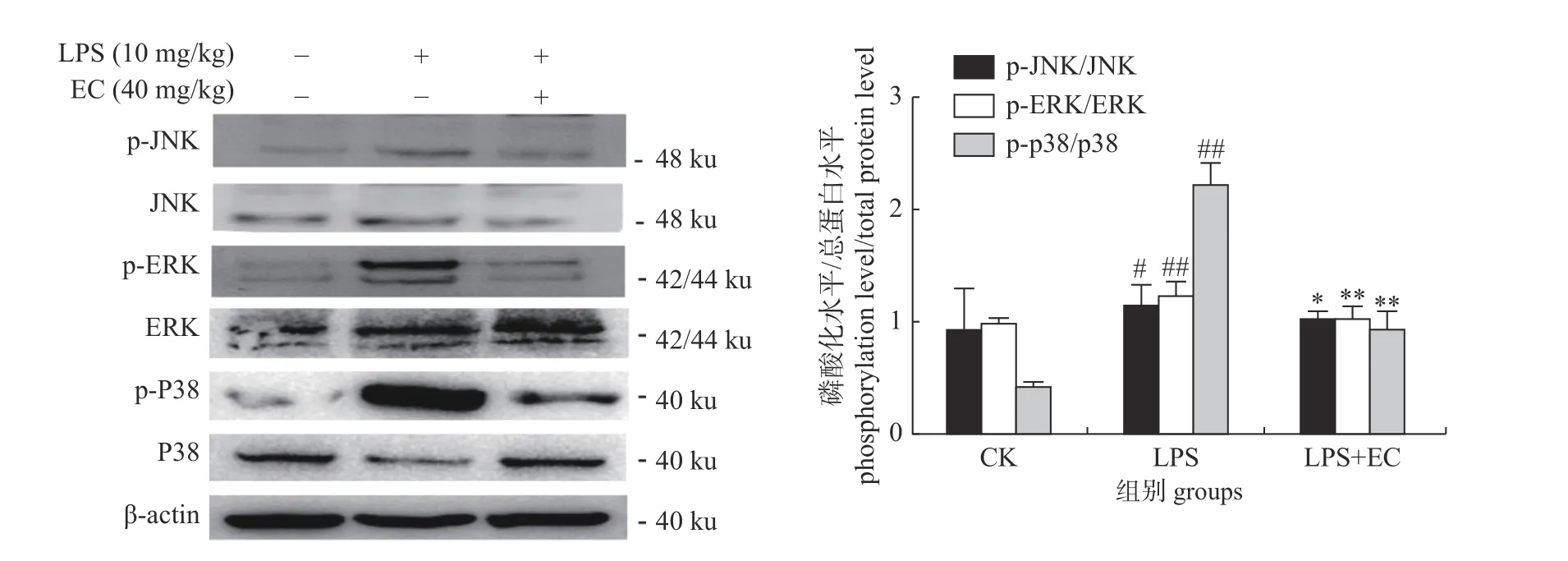
图2 EC 对小鼠肺组织P38、ERK 和JNK 磷酸化水平的影响Fig.2 Effect of EC on the phosphorylated level of P38,ERK and JNK in mice lung tissues
3 讨论
急性肺损伤是一种严重的弥漫性肺病,目前较为有效的方法是机械通气,但容易造成肺组织二次伤害[18]。炎症反应和肺内皮屏障的损伤导致血管内炎性细胞流入肺间质及肺泡,产生肺组织水肿,同时促炎细胞因子大量流入肺间质,形成炎症级联效应恶化ALI[19-20]。有研究报道气管滴注LPS 诱导的ALI 小鼠模型可以很好地模拟临床上肺炎导致的肺损伤[21]。因此,本研究使用气管内滴注LPS 诱导小鼠建造ALI 模型以探讨EC的抗炎和氧化应激的保护作用。通过W/D 检测以及评估表明本试验的ALI 模型可行,且EC 预处理可显著抑制经LPS 诱导导致的肺水肿以及损伤。
在LPS 刺激后内源性抗氧化物活性的降低会导致氧化自由基及其消除分子之间调控失衡,促使抗氧化防御能力下降,从而诱导脂质过氧化反应,造成体内MDA 累积[22]。SOD 在清除氧自由基方面发挥着重要作用,SOD的活性可间接反映肺组织内的抗氧化活性[23]。氧化酶催化过程中的氧化还原反应会产生许多细胞毒性物质过氧化氢,在ALI 过程中也会释放过氧化氢对细胞产生破坏,但是CAT 可以催化过氧化氢分解保护细胞免受过氧化氢的危害,GSH-Px 同样可以使有毒的过氧化物还原成无毒的羟基化合物保护细胞膜的结构和功能的完整性[24]。蛋白质羰基是生物体损伤特征指标之一,通过测量羰基类物质可以估计肺组织蛋白质的氧化损伤程度[25]。所以MDA 含量、SOD、CAT 和GSH-Px 活性以及蛋白质羰基的含量是氧化应激水平的良好指标。本研究表明:与LPS 模型组相比,EC预处理可以有效提高SOD、CAT 和GSH-Px 活性并有效抑制MDA 和蛋白质羰基的产生。
活性氧(reactive oxygen species,ROS)包含羟基自由基、过氧化氢氧自由基和超氧物,是自由基存在的主要形式[26]。ROS的产生可以促进中性粒细胞和巨噬细胞释放NO 并在肺组织内积累,对肺组织造成持续损伤[27-28]。本研究表明:EC 预处理抑制了肺组织内由LPS 刺激引起的NO 产生。过量的NO 积累又对中性粒细胞和巨噬细胞等细胞进行刺激从而释放TNF-α、IL-1β 和IL-6 等促炎症因子[29]。LPS 刺激后肺巨噬细胞大量合成并释放NO,不仅杀伤病原体,同时对周围正常细胞也造成损害,进一步恶化ALI。由LPS 刺激而释放的促炎症因子大多都是小分子蛋白,其作用于细胞表面与细胞膜表面受体结合后能形成复合体,这些复合体会激活下游与炎症相关的蛋白激酶,如MAPK 信号通路及P38、ERK 和JNK 信号通路等,参与机体的炎症反应[30]。黄酮类化合物能有效地调节ALI 模型小鼠的炎症因子含量以及阻断相关的炎症通路的激活来缓解其肺部损伤。CHEN 等[31]研究发现:苔藓叶总黄酮通过下调小鼠血清中NO、TNF-α、IL-1β 和IL-6的含量以及阻断MAPK 和NF-κB 信号通路的激活减轻LPS的ALI。本研究中,EC 预处理组在LPS 诱导后同样能下调小鼠血清、BALF和肺组织中TNF-α、IL-1β 和IL-6 三种炎症因子的含量,并且抑制小鼠肺组织内MAPK 信号通路中P38、ERK 和JNK 蛋白的磷酸化表达,证明EC 能通过调节炎症因子及相关通路改善其ALI。
4 结论
EC 预处理能显著地抑制LPS 诱导的肺组织氧化应激反应,下调相关因子的含量,缓解LPS诱导的小鼠肺水肿和损伤,抑制MAPK 信号通路中P38、ERK 和JNK的磷酸化水平,缓解小鼠的ALI。

