植物炭黑对采食玉米赤霉烯酮污染饲粮的大鼠生长性能和生殖系统的影响
刘淑杰 邓 波 吴 杰 徐子伟 马倩倩
(浙江省农业科学院畜牧兽医研究所,杭州 310021)
玉米赤霉烯酮(zearalenone,ZEN)是由镰刀菌属真菌产生的一种真菌毒素,又称F-2毒素,为一种二羟基苯甲酸内酯类植物雌激素,具有强烈的生殖毒性、细胞毒性、免疫毒性和致癌毒性等[1]。ZEN最初从患有赤霉病的玉米中分离获得,是玉米、大麦、燕麦、高粱和小米等中最常见、威胁力最大的污染霉菌毒素之一,会给动物及人类健康造成严重的安全隐患,并给畜牧业造成巨大的经济损失。ZEN化学结构与内源性雌激素有高度的相似性,具有强烈的雌激素效应,其通过食物链被人或动物摄入体内,可竞争性与内源性雌激素受体结合,并迅速激活雌激素的反应元件,造成人或动物繁殖机能异常,生殖系统受到不同程度损伤,甚至导致死亡[2]。研究显示,ZEN能够引起雌性动物生殖激素分泌紊乱,促进卵巢颗粒细胞凋亡[3],抑制卵母细胞成熟,导致子宫内膜增生[4]、乳腺增大和排卵不规律等,甚至造成假性怀孕及死胎等[5]。ZEN可导致雄性动物精子质量和活力下降以及睾丸萎缩等[6]。另外,ZEN还会损害肝脏和肾脏等组织,导致免疫功能下降[7]。
在世界范围内,ZEN污染非常广泛和普遍,其化学性质稳定,难以在谷物加工过程中被降解,因此,研究安全、高效的脱毒方法势在必行。在饲料行业中,常采用霉菌毒素吸附剂(如活性炭、沸石和蒙脱石等)的方法进行脱毒,尽管市场上销售的吸附剂种类繁多,但是对ZEN吸附性能差异较大,产品质量不稳定[8]。植物炭黑是一种在我国使用量较大的天然食品色素,由植物不完全燃烧产生,无毒,且具有不参与人体代谢等优点。植物炭黑另一显著特性是微孔结构多,比表面积大,对有毒有害物质、病原微生物(沙门氏菌、金黄色葡萄球菌、霍乱毒素和大肠杆菌等)或重金属等都具有很强的吸附力,是一种非常有前景、安全的霉菌毒素吸附剂[9-10]。然而,植物炭黑尚未应用于畜禽生产中,直至2020年1月14日,国家农业农村部公告第258号文件颁布,批准由福建省顺昌碳娃娃生物科技有限公司和福建省百草霜生物科技有限公司联合申请的植物炭黑作为新饲料添加剂,这为植物炭黑用于畜牧领域的研究及应用拉开了序幕。鉴于此,本试验首次开展植物炭黑对饲喂ZEN污染饲粮的大鼠生长抑制、肝脏和生殖系统损伤的缓解效果研究,并确定植物炭黑适宜添加剂量,为将植物炭黑应用于饲料行业和畜禽生产提供依据。
1 材料与方法
1.1 试验材料
ZEN[美国化学文摘社(CAS)编号17924-92-4]购自加拿大TripleBond公司,植物炭黑由福建省百草霜生物科技有限公司提供。碱性磷酸酶(ALP)、谷丙转氨酶(GPT)、谷草转氨酶(GOT)、尿素氮(UN)、促卵泡素(FSH)、雌二醇(E2)、促黄体素(LH)和催乳素(PRL)检测试剂盒(编号分别为A059-2-2、C009-2-1、C010-2-1、C013-2-1、H101-1-2、H102-1-2、H206-1-2和H905)购自南京建成生物工程研究所。
1.2 试验设计
试验采用完全随机设计,选用64只体重约为150 g的5~6周龄无特定病原体(SPF)级雌性SD大鼠(购自浙江省医学科学院),随机分为4个组,每组16个重复,每个重复1只。4个组分别为:1)空白对照组,饲喂基础饲粮;2)负对照组,饲喂基础饲粮+25 mg/kg ZEN;3)低剂量植物炭黑组,饲喂基础饲粮+25 mg/kg ZEN+1.0 g/kg植物炭黑;4)高剂量植物炭黑组,饲喂基础饲粮+25 mg/kg ZEN+1.5 g/kg植物炭黑。试验预试期7 d,正试期28 d。
1.3 饲养管理
大鼠单笼饲养,笼底垫上碎木屑,每隔2 d更换1次垫料,饲养环境温度为(23±2) ℃、相对湿度为40%~70%,光照周期为12 h明亮和12 h黑暗,氨气浓度≤14 mg/mL,大鼠自由采食和饮水。
1.4 测定指标和方法
1.4.1 生长性能
在正试期第1、14和28天08:00,对所有试验大鼠空腹称重,每天记录每只大鼠的给料量和剩料量,计算试验各阶段大鼠平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。
1.4.2 血清生化指标及激素水平
分别于正试期第14和28天,对所有试验大鼠于眼眶下静脉采血,在4 ℃条件下放置12 h,于3 000 r/min离心15 min,收集血清,-80 ℃保存备用。采用全自动生化分析仪检测血清ALP、GPT和GOT活性以及UN浓度,采用酶联免疫吸附试验(ELISA)法测定血清FSH、E2、LH和PRL浓度。
1.4.3 卵巢病理学检测
分别于正试期第14和28天,每组随机取8只大鼠,将大鼠安乐死,迅速剖开腹腔,取出右侧卵巢,然后将卵巢放入10%中性甲醛溶液中,样品经石蜡包埋后切片,再经苏木精-伊红(HE)染色,在显微镜下观察大鼠卵巢组织形态结构,用于组织病理学分析。
1.5 数据统计分析
试验数据采用SPSS 21.0软件进行单因素方差分析(one-way ANOVA),采用Duncan氏法进行多重比较,试验结果以“平均值±标准差”表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 植物炭黑对采食ZEN污染饲粮大鼠生长性能的影响
由表1可知,第1~14天,与空白对照组相比,负对照组大鼠ADG显著降低(P<0.05),降低了26.06%;F/G显著升高(P<0.05),升高了33.08%。与负对照组相比,低剂量植物炭黑组大鼠ADG和F/G差异不显著(P>0.05),而ADG显著低于空白对照组(P<0.05),降低了21.28%。与空白对照组和负对照组相比,高剂量植物炭黑组大鼠ADG和F/G差异不显著(P>0.05)。第15~28天,与空白对照组相比,负对照组大鼠F/G极显著升高(P<0.01),升高了28.21%;与空白对照组和负对照组相比,低剂量植物炭黑组大鼠F/G差异不显著(P>0.05);与负对照组相比,高剂量植物炭黑组大鼠F/G显著降低(P<0.05),降低了15.90%,而与空白对照组相比差异不显著(P>0.05);各组间ADG差异不显著(P>0.05)。从全期(第1~28天)来看,与空白对照组相比,负对照组大鼠ADG极显著降低(P<0.01),降低了28.45%;F/G极显著升高(P<0.01),升高了40.73%。与负对照组相比,低剂量植物炭黑组大鼠ADG和F/G差异不显著(P>0.05),而ADG显著低于空白对照组(P<0.05),降低了20.69%。与负对照组相比,高剂量植物炭黑组大鼠F/G显著降低(P<0.05),降低了20.89%,ADG差异不显著(P>0.05);而与空白对照组相比,ADG和F/G差异均不显著(P>0.05)。试验期间,各组间ADFI差异均不显著(P>0.05)。
2.2 植物炭黑对采食ZEN污染饲粮大鼠血清生化指标的影响
由表2可知,第14和28天,与空白对照组相比,负对照组大鼠血清ALP活性极显著升高(P<0.01),分别升高了37.67%和44.17%;而低剂量植物炭黑组大鼠血清ALP活性与其他各组之间差异均不显著(P>0.05)。第14天,高剂量植物炭黑组大鼠血清ALP活性极显著低于负对照组(P<0.01),降低了22.48%,而与空白对照组和低剂量植物炭黑组之间差异不显著(P>0.05)。第28天,高剂量植物炭黑组大鼠血清ALP活性与其他各组之间差异均不显著(P>0.05)。第14天,各组间大鼠血清GPT活性差异均不显著(P>0.05)。第28天,与空白对照组相比,负对照组大鼠血清GPT活性显著升高(P<0.05),升高了42.55%;高剂量植物炭黑组大鼠血清GPT活性显著低于负对照组(P<0.05),降低了24.48%,而与空白对照组和低剂量植物炭黑组之间差异不显著(P>0.05);低剂量植物炭黑组大鼠血清GPT活性与其他各组之间差异均不显著(P>0.05)。第14天,各组间大鼠血清GOT活性差异均不显著(P>0.05)。第28天,负对照组大鼠血清GOT活性极显著高于空白对照组(P<0.01),升高了37.75%;高剂量植物炭黑组大鼠血清GOT活性显著低于负对照组(P<0.05),降低了20.27%,而与空白对照组和低剂量植物炭黑组之间差异不显著(P>0.05);低剂量植物炭黑组大鼠血清GOT活性与其他各组之间差异均不显著(P>0.05)。第14和28天,各组间大鼠血清UN浓度差异均不显著(P>0.05)。
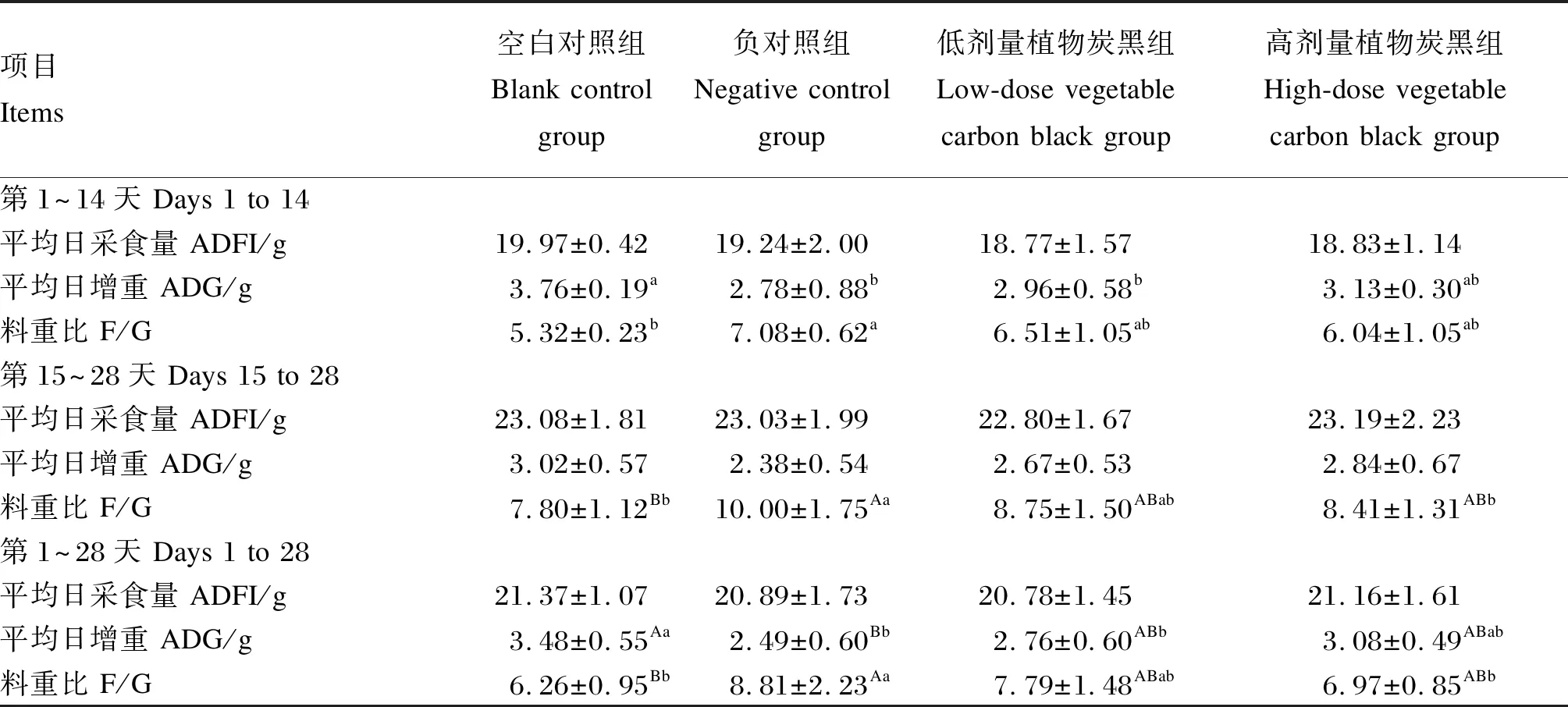
表1 植物炭黑对采食ZEN污染饲粮大鼠生长性能的影响
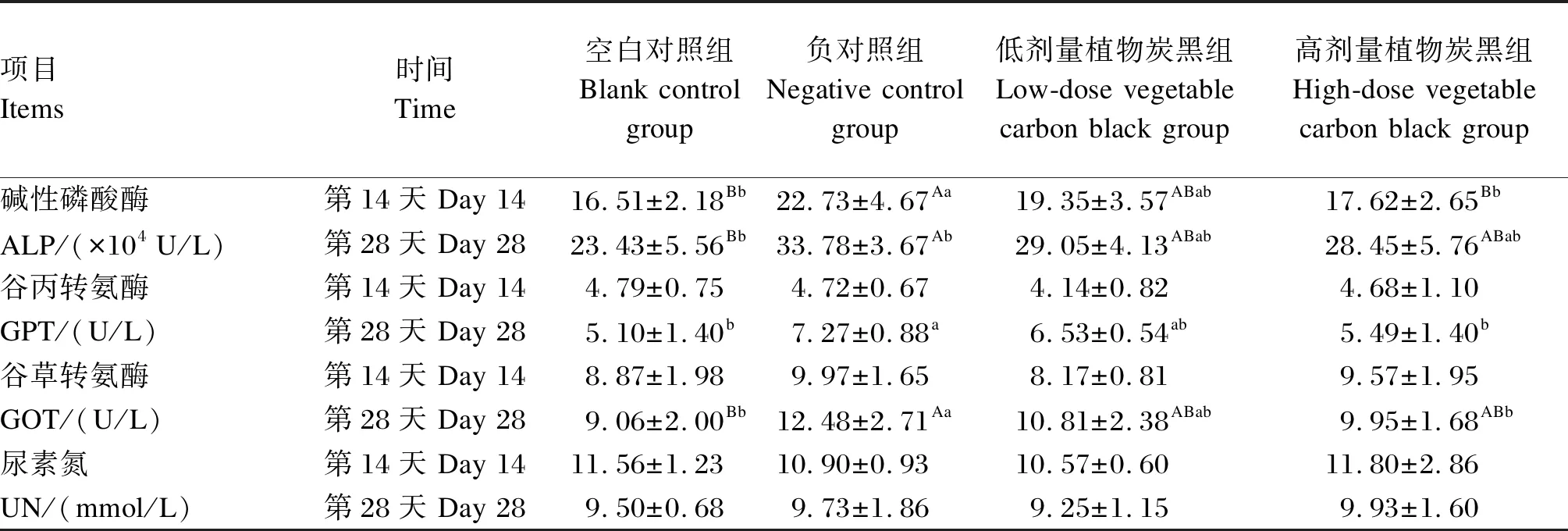
表2 植物炭黑对采食ZEN污染饲粮大鼠血清生化指标的影响
2.3 植物炭黑对采食ZEN污染饲粮大鼠卵巢组织形态的影响
由图1可知,HE染色结果显示,第14和28天,空白对照组大鼠卵巢结构清晰,皮质部和髓质部可见,皮质部内有较多不同发育程度的原始卵泡、初级卵泡和初级卵母细胞,髓质部的血管清晰可见。第14天,负对照组大鼠卵巢结构存在,但皮质部可见萎缩,原始卵泡、初级卵泡和初级卵母细胞明显较空白对照组减少,髓质部的血管少见,且第28天卵巢髓质部萎缩和血管充血更为明显。第14和28天,低剂量植物炭黑组和高剂量物炭黑组大鼠卵巢组织形态较负对照组明显改善。

图1 植物炭黑对采食ZEN污染饲粮大鼠卵巢组织形态的影响
2.4 植物炭黑对采食ZEN污染饲粮大鼠血清生殖激素水平的影响
由表3可知,第14天,负对照组和低剂量植物炭黑组大鼠血清FSH浓度极显著高于空白对照组(P<0.01),分别升高了20.40%和26.53%;高剂量植物炭黑组大鼠血清FSH浓度极显著低于负对照组(P<0.01),降低了28.94%,而与空白对照组相比差异不显著(P<0.05)。第28天,负对照组大鼠血清FSH浓度显著高于空白对照组(P<0.05),升高了19.86%;高剂量植物炭黑组大鼠血清FSH浓度显著低于负对照组(P<0.05),降低了19.38%,而与空白对照组和低剂量植物炭黑组之间差异不显著(P>0.05)。第14天,负对照组和低剂量植物炭黑组大鼠血清E2浓度极显著低于空白对照组(P<0.01),分别降低了19.30%和15.17%;高剂量植物炭黑组大鼠血清E2浓度极显著高于负对照组(P<0.01),升高了29.98%,而与空白对照组相比差异不显著(P>0.05)。第28天,负对照组大鼠血清E2浓度极显著低于空白对照组(P<0.01),降低了17.59%;高剂量植物炭黑组大鼠血清E2浓度极显著高于负对照组(P<0.01),升高了31.50%,且显著高于空白对照组和低剂量植物炭黑组(P<0.05)。第14天,负对照组大鼠血清LH浓度极显著低于空白对照组(P<0.01),降低了46.74%;低剂量植物炭黑组和高剂量植物炭黑组大鼠血清LH浓度极显著高于负对照组(P<0.01),分别升高了35.20%和71.94%;而高剂量植物炭黑组与空白对照组相比差异不显著(P>0.05)。第28天,负对照组、低剂量植物炭黑组和高剂量植物炭黑组大鼠血清LH浓度显著低于空白对照组(P<0.05),分别降低了25.63%、26.71%和23.10%,且负对照组、低剂量植物炭黑组和高剂量植物炭黑组大鼠血清LH浓度之间差异不显著(P>0.05)。第14和28天,各组间大鼠血清PRL浓度差异均不显著(P>0.05)。
3 讨 论
3.1 植物炭黑对采食ZEN污染饲粮大鼠生长性能的影响
关于ZEN对动物生产性能的影响报道结果并不一致。研究显示,给鸡灌服ZEN的剂量高于5 mg/kg时可降低蛋鸡的生产性能[11]。给妊娠期母鼠(大鼠)饲喂含有20 mg/kg ZEN的饲粮可显著降低母鼠体重和ADG,并显著降低ADFI[12]。饲粮添加0.5~1.5 mg/kg ZEN对断奶仔猪ADG、ADFI和F/G均无影响,但是随ZEN添加剂量的提高F/G呈一次线性降低的趋势[13]。而Gajecka等[14]报道,长期给予低剂量的ZEN能够增加小母猪体增重。这些研究说明ZEN对生长性能的影响与给予ZEN的剂量、给予持续时间、动物品种和动物所处的生理阶段都密切相关,不过总得来说,高剂量ZEN能够降低动物生产性能。在本研究中,饲粮中添加25 mg/kg ZEN极显著降低了大鼠试验全期ADG,极显著提高了F/G;显著降低了大鼠第1~14天的ADG,显著提高了F/G;以及极显著提高了第15~28天的F/G。这说明给予高剂量的ZEN显著降低了大鼠的生长性能,这也进一步证实了上述的观点,而且这种影响对试验前半期更为显著。

表3 植物炭黑对采食ZEN污染饲粮大鼠血清生殖激素水平的影响
在本研究中,饲粮添加植物炭黑能够在一定程度上缓解ZEN所致的大鼠生长性能的降低。与负对照组相比,饲粮添加高剂量植物炭黑分别提高了试验各阶段的ADG,显著降低了第15~28天和第1~28天的F/G,并与空白对照组相比差异不显著。由于尚未有植物炭黑在畜禽方面的研究报道,所以未能进行相关研究比较。研究显示,在含有3 mg/kg ZEN的饲粮中添加0.2%沸石吸附剂对断奶仔猪的生长性能无显著影响[15]。向低于饲料卫生标准ZEN水平的饲粮中添加凹凸棒石吸附剂,对蛋鸡的生产性能无显著影响,但具有一定程度的改善作用[16]。姚宝强等[17]研究表明,饲粮中含有1 mg/kg ZEN可显著提高断奶仔猪ADG,但对ADFI和F/G无影响,而饲粮中添加吸附剂(主要为高性能钙蒙脱石、蛋白石-C和石英)对生长性能无影响。在本试验中,在ZEN污染的饲粮中添加低剂量植物炭黑对大鼠生长性能无显著改善作用,而添加高剂量植物炭黑可有效吸附ZEN,降低机体内发挥毒性作用的ZEN剂量,从而提高大鼠ADG,显著降低F/G,缓解ZEN对大鼠生长的抑制作用。
3.2 植物炭黑对采食ZEN污染饲粮大鼠肝脏功能的影响
肝脏是ZEN代谢的主要场所,ZEN主要代谢生成α-玉米赤霉烯醇(α-ZOL)或β-玉米赤霉烯醇(β-ZOL),α-ZOL比ZEN具有更强的雌激素活性,对肝细胞具有强烈的毒性作用[18]。血液中ALP、GPT和GOT活性变化被认为是衡量肝脏健康的重要指标,当肝脏受损时,肝细胞通透性增加,细胞内ALP、GPT和GOT释放进入血液,导致血液中酶的活性升高。研究显示,饲喂含有1.6 mg/kg ZEN的饲粮可显著提高初情期前的母猪血液GOT活性[19];饲喂含有1.0 mg/kg ZEN的饲粮能够显著提高断奶仔猪血液GOT活性[20];每周给予大鼠腹腔2 mg/kg BW剂量的ZEN可提高血清GPT和ALP活性[21]。本研究结果显示,ZEN极显著提高了大鼠第14和28天血清ALP活性,显著或极显著提高了第28天血清GPT和GOT活性,说明ZEN对肝脏产生毒性作用,造成了肝细胞的损伤。姚宝强[22]研究表明,在饲粮中添加霉菌毒素吸附剂能够显著降低由ZEN引起的仔猪血清ALP、GPT和GOT活性升高。王欢欢等[23]研究表明,饲粮中添加0.3 mg/kg壳聚糖硒未能显著降低由ZEN引起的断奶仔猪血清GPT和GOT活性升高,但是有降低趋势。李守杰等[24]报道,在ZEN污染饲粮中添加膨润土对断奶仔猪血清GPT和GOT活性升高无显著影响。本研究结果表明,在ZEN污染的饲粮中添加低剂量植物炭黑对大鼠血清ALP、GPT和GOT活性无显著影响,但具有一定的改善趋势,添加高剂量植物炭黑极显著降低了第14天血清ALP活性,显著降低了第28天血清GPT和GOT活性,并与空白对照组相比差异不显著,这说明植物炭黑能够缓解由ZEN引发的血清酶活性的改变,并且存在剂量效应,饲粮添加高剂量植物炭黑降低了机体对ZEN的吸收和代谢,阻抑了ZEN对肝脏的损伤,从而保护了肝脏功能。
3.3 植物炭黑对采食ZEN污染饲粮大鼠生殖系统的影响
ZEN具有强烈的生殖毒性,动物的生殖系统是其作用的主要靶器官。研究显示,ZEN可导致动物卵巢功能和结构改变,诱导卵巢黄体空泡化,并显著减少各阶段的卵泡数量[12]。饲喂1.0 mg/kg ZEN污染饲粮可导致断奶仔猪卵巢炎症,血管壁增生并充血,血管中大量红细胞和白细胞充盈,卵巢皮层原始卵泡增多[25]。研究发现,ZEN对卵巢的作用存在剂量效应,1.1 mg/kg ZEN能刺激卵泡发育,随着剂量的增大(2.0、3.2 mg/kg)卵巢出现大量闭锁卵泡[26]。本研究结果显示,采食25 mg/kg ZEN污染饲粮的大鼠卵巢皮质部可见萎缩,原始卵泡、初级卵泡和初级卵母细胞明显较对空白对照组减少,髓质部的血管少见,且第28天卵巢髓质部萎缩和血管充血更为明显,此结果与高鑫[12]报道相一致。而在ZEN污染饲粮中添加低剂量或高剂量植物炭黑可明显改善卵巢组织形态结构,说明植物炭黑降低了ZEN对大鼠卵巢的毒性作用,对维持卵巢的结构和功能具有较良好的作用。
ZEN与内源雌激素具有高度的相似性,可引起动物生殖激素分泌紊乱,造成雌性动物繁殖障碍。研究显示,饲粮中含有20 mg/kg ZEN时可显著提高大鼠血清FSH浓度,降低血清E2浓度[12]。给蛋鸡灌服5、50和200 mg/kg ZEN能显著提高血清孕酮(P4)浓度,降低血清LH浓度[19]。饲喂含有0.8和1.6 mg/kg ZEN的饲粮可显著降低小鼠血清LH浓度,且1.6 mg/kg ZEN可显著降低血清E2浓度,说明ZEN对生殖激素水平影响同样存在着剂量效应[15]。本研究结果显示,ZEN显著或极显著提高了大鼠第14和28天血清FSH浓度,显著或极显著降低了第14和28天血清E2和LH浓度。E2是一种甾体雌激素,可促进子宫内膜生长和生殖系统发育,FSH和LH具有促进卵泡发育和黄体产生的作用,试验结果说明ZEN阻碍了生殖器官的发育和功能发挥,破坏了机体对生殖系统的调节能力,干扰了大鼠生殖激素的正常分泌。研究显示,在饲粮中添加1 mg/kg ZEN可显著降低青年母猪血清E2浓度,而添加不同种类霉菌毒素吸附剂(包括酵母细胞壁类、硅铝酸盐类、改性硅铝酸盐类和复合型吸附剂)后血清E2浓度未能显著改善,但在一定程度上得到恢复[8]。在ZEN污染的饲粮中添加200和500 mg/kg水飞蓟素缓解了由ZEN引起的大鼠血清E2和FSH浓度的降低[12]。本研究结果显示,在ZEN污染的饲粮中添加低剂量植物炭黑可极显著提高大鼠第14天血清LH浓度,而对第14天血清FSH、E2和PRL浓度以及第28天血清生殖激素水平无显著影响;而添加高剂量植物炭黑可极显著降低大鼠第14天血清FSH浓度,显著降低第28天血清FSH浓度,极显著提高第14天血清E2、LH浓度和第28天血清E2浓度,这说明高剂量植物炭黑改善了大鼠体内激素分泌水平。雌激素对下丘脑和垂体发挥着负反馈调节功能,当动物摄入具有类雌激素作用的ZEN后可降低垂体分泌促性腺激素水平,导致LH和FSH水平进一步降低[27]。而在饲粮中添加高剂量植物炭黑可吸附ZEN,使得大鼠雌激素、下丘脑和垂体之间保持相对的平衡,从而维持机体正常的激素水平和繁殖功能,因此推荐植物炭黑适宜添加剂量为1.5 g/kg。
4 结 论
植物炭黑能够提高采食ZEN污染饲粮大鼠的ADG,显著降低F/G,显著降低血清ALP、GPT和GOT活性,调节血清FSH、LH和E2等生殖激素的正常分泌,从而改善大鼠生长性能,缓解ZEN对肝脏和卵巢的损伤,维持正常繁殖功能。推荐植物炭黑适宜添加剂量为1.5 g/kg。

