复合植物提取物对湘东黑山羊胃肠道游离氨基酸含量及其转运载体相对表达量的影响
徐琪翔 曹文豪 罗双贵 谢静静 吕小康 朱晋佳 吴祎程 周传社* 谭支良
(1.中国科学院亚热带农业生态研究所,中国科学院亚热带农业生态过程重点实验室,畜禽养殖污染控制与资源化技术国家工程实验室,动物营养生理与代谢过程湖南省重点实验室,长沙 410125;2.中国科学院大学,北京 100049;3.湖南先伟实业有限公司,长沙 410016)
植物提取物由于含有酚、萜、酸、酮和醚等活性物质,具有抗氧化、增强免疫力和提高生长性能等生理功能[1-2]。有研究发现,植物提取物能通过对钠离子-葡萄糖协同转运体2(sodium-glucose cotransporter 2,SGLT2)的抑制作用来减少肾脏对葡萄糖的重吸收,保护胰岛β细胞,从而降低机体的葡萄糖水平[3],说明植物提取物对动物机体相关基因具有调控作用。本试验所用复合植物提取物主要组成物质为杜仲、迷迭香、枇杷叶和柿子提取物,其中杜仲叶中主要活性物质为绿原酸、京尼平苷酸和黄酮类等,具有消炎、抗氧化和抗菌的功能[3-4];迷迭香主要活性物质为迷迭香酸和鼠尾草酸等,具有改善血脂、保护肝脏和提高免疫力的作用[5];枇杷叶和柿子叶主要活性物质为熊果酸和齐墩果酸,具有降低肠道炎症反应、调控肠道菌群和抗氧化作用[6-7]。
氨基酸是动物机体内最重要的2类含氮小分子物质之一,是蛋白质和多肽合成的基础物质,也是动物机体内代谢过程中重要的信号传递物质[8]。胃肠道是动物营养物质消化吸收的重要部位,氨基酸在胃肠道氨基酸感应和转运的作用下吸收后经血液运输到肝脏、肌肉和肾脏等部位进行代谢[9]。但当前对植物提取物在动物胃肠道氨基酸及其转运载体的影响方面研究较少,因此深入研究植物提取物对胃肠道游离氨基酸含量以及氨基酸感应和转运系统的影响,对动物机体胃肠道氨基酸的感应和转运以及植物提取物功能的研究具有重要意义。因此,本试验通过在湘东黑山羊饲粮中添加0.15%复合植物(杜仲叶、迷迭香叶和枇杷叶和柿子)提取物,研究其对湘东黑山羊瘤胃、回肠和盲肠游离氨基酸含量及其关键转运载体基因相对表达量的影响,旨在为植物提取物在反刍家畜养殖应用提供理论依据和数据支持。
1 材料与方法
1.1 试验设计
本试验所用复合植物提取物添加剂由湖南某实业有限公司提供,为淡黄色粉末物质,组成原料为枇杷叶和柿子提取物(400~600 g/kg)、迷迭香叶粉(300~400 g/kg)和杜仲叶提取物(100~200 g/kg);有效成分含量为:酚酸类20%~30%,二萜类25%~40%,黄酮类5%~10%,五环三萜类25%~40%。试验采用单因素随机分组方法,选取3~4月龄、体重相近[(9.82±0.83) kg]且体况良好的雌性湘东黑山羊20头,随机分为2组,每组10头。对照组饲喂基础饲粮,试验组饲喂在基础饲粮中添加0.15%的复合植物提取物的试验饲粮。将复合植物提取物与精料混合后进行饲喂,每日饲喂2次。基础饲粮组成及营养水平见表1。
1.2 饲养管理
试验羔羊采用单栏饲喂,精粗料按1∶1饲喂,整个试验期共56 d,其中预试期14 d,正试期42 d。每日饲喂2次(06:30、18:30),保证日剩料为投料量的5%~10%,记录采食量,自由饮水。

表1 基础饲粮组成及营养水平(干物质基础)
1.3 样品采集与处理
正式试验结束后,山羊禁食24 h,禁水12 h,对山羊进行屠宰,采集瘤胃液,用4层纱布过滤后于-80 ℃保存;将山羊各胃室分离,生理盐水冲洗干净,用载玻片剥离瘤胃黏膜2 g左右于-80 ℃保存。将山羊小肠和大肠各段分离,采集回肠和盲肠食糜于-80 ℃保存;除去肠系膜和脂肪,剪开用生理盐水冲洗干净,用载玻片剥离回肠中部和盲肠黏膜2 g左右于-80 ℃保存。
1.4 瘤胃、回肠和盲肠游离氨基酸含量测定
准确称量回肠和盲肠食糜2 g,加入5 mL蒸馏水,于4 ℃冰箱过夜后吸取上清液2 mL,同时取2 mL瘤胃液3 000 r/min离心5 min后,吸取上清液1 mL于离心管中,加入1 mL 8%磺基水杨酸溶液,混匀后10 000 r/min离心10 min,取上清液,0.22 μm滤膜过滤后用氨基酸分析仪(日立L8900)测定游离氨基酸的含量。
1.5 瘤胃、回肠和盲肠氨基酸转运载体测定
1.5.1 瘤胃、回肠和盲肠总RNA的提取及反转录

1.5.2 引物设计
引物序列及参数信息引用Wu等[10],具体信息见表2。甘油醛-3-磷酸脱氢酶为内参基因。

表2 引物序列及参数
1.5.3 实时荧光定量PCR
1.6 数据处理与分析
使用Excel 2010软件对试验数据进行初步处理,使用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),以P<0.05和P<0.01分别表示差异显著和差异极显著,结果以平均值±标准差表示。
2 结果分析
2.1 瘤胃游离氨基酸含量及氨基酸转运载体相对表达量
由表3可知,与对照组相比,饲粮添加复合植物提取物极显著增加了山羊瘤胃中天冬氨酸(Asp)、谷氨酸(Glu)、甘氨酸(Gly)、丙氨酸(Ala)和脯氨酸(Pro)含量(P<0.01),显著增加了苏氨酸(Thr)的含量(P<0.05),对瘤胃其他游离氨基酸含量变化没有显著影响(P>0.05)。

表3 复合植物提取物对瘤胃液游离氨基酸含量的影响
由表4可知,与对照组相比,试验组山羊瘤胃黏膜钙敏感受体(CASR)基因相对表达量上调了68.6%(P<0.01),复合植物提取物对其他氨基酸转运载体的相对表达量没有显著影响(P>0.05)。

表4 复合植物提取物对瘤胃黏膜氨基酸转运载体相对表达量的影响
2.2 回肠游离氨基酸含量及氨基酸转运载体相对表达量
由表5可知,相对于对照组,试验组回肠游离Gly、Ala和精氨酸(Arg)含量极显著增加(P<0.01),缬氨酸(Val)含量显著增加(P<0.05),其他游离氨基酸含量均没有显著变化(P>0.05)。

表5 复合植物提取物对回肠食糜中游离氨基酸含量的影响
由表6可知,与对照组相比,添加复合植物提取物后,试验组回肠黏膜溶质载体家族1成员1(SLC1A1)、溶质载体家族1成员3(SLC1A3)基因相对表达量分别上调了162.6%和27.1%(P<0.01),溶质载体家族38成员2(SLC38A2)基因相对表达量上调了34.3%(P<0.05),对其他氨基酸转运载体的相对表达量并没有显著影响(P>0.05)。
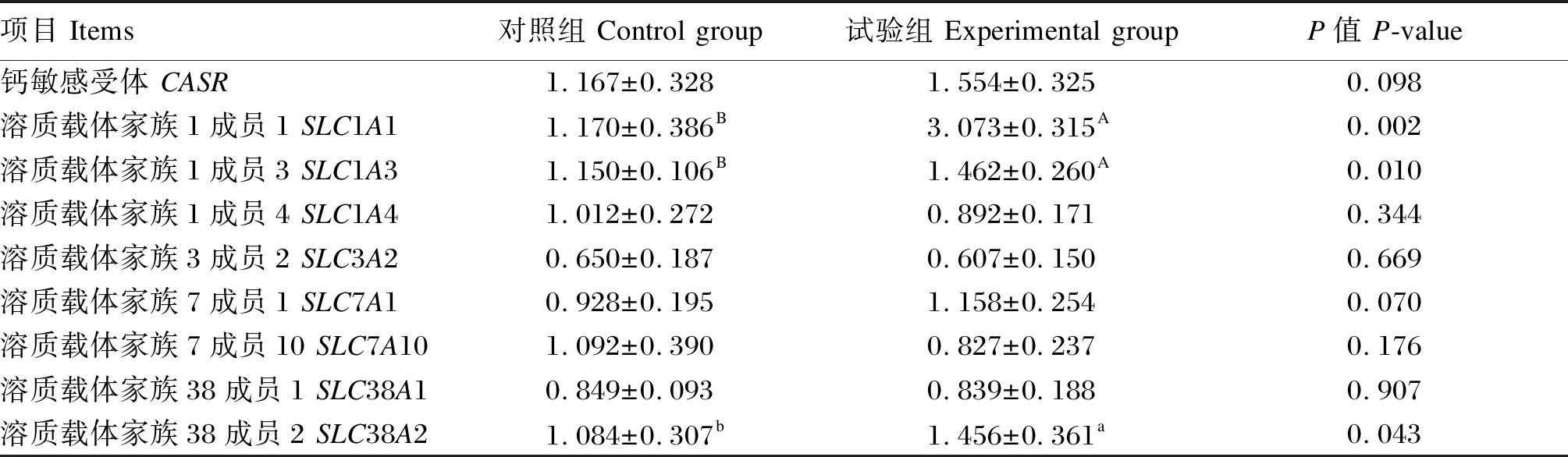
表6 复合植物提取物对回肠黏膜氨基酸转运载体相对表达量的影响
2.3 盲肠游离氨基酸含量及氨基酸转运载体相对表达量
由表7可知,试验组盲肠Thr、Glu、Gly、酪氨酸(Tyr)和苯丙氨酸(Phe)的含量极显著低于对照组(P<0.01),丝氨酸(Ser)、Ala、缬氨酸(Val)、赖氨酸(Lys)的含量显著降低(P<0.05),2组之间其他游离氨基酸含量没有显著变化(P>0.05)。

表7 复合植物提取物对盲肠食糜中游离氨基酸含量的影响
由表8可知,与对照组相比,试验组盲肠黏膜SLC1A1基因相对表达表达量下调了43.6%和(P<0.01),溶质载体家族3成员2(SLC3A2)、溶质载体家族7成员1(SLC7A1)和SLC38A2相对表达量分别上调了21.6%、29.2%和34.3%(P<0.05),其他氨基酸转运载体的相对表达量并没有显著变化(P>0.05)。
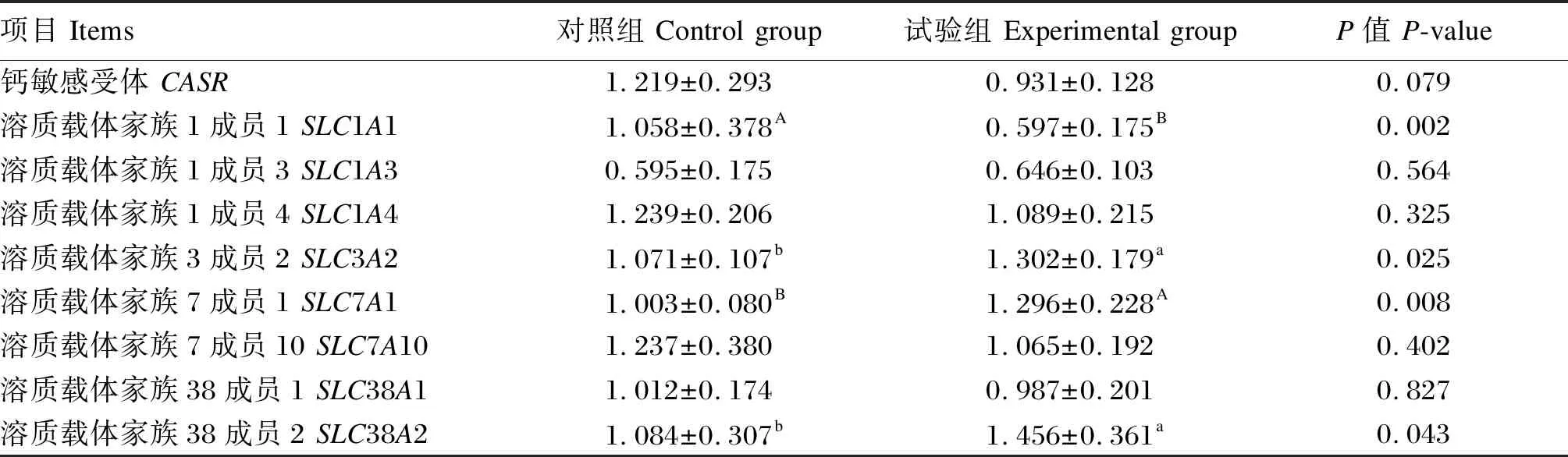
表8 复合植物提取物对盲肠黏膜氨基酸转运载体相对表达量的影响
3 讨 论
3.1 复合植物提取物对湘东黑山羊瘤胃游离氨基酸含量及黏膜氨基酸转运载体相对表达量的影响
饲粮中瘤胃可降解蛋白(RDP)在瘤胃微生物分泌的酶的作用下迅速被分解为多肽和氨基酸,氨基酸在瘤胃的去路主要有合成微生物蛋白、脱氨基产生氨和有机酸以及脱羧基产生伯胺类物质[11],因此,瘤胃微生物和饲粮中氨基酸是影响瘤胃内游离氨基酸的重要因素[12]。在以往的研究中认为反刍动物与单胃动物一样,氨基酸在小肠内被吸收,但是随着研究的深入,有研究指出瘤胃和瓣胃能够参与氨基酸的吸收[13-15],闰磊[16]通过试验发现,反刍动物前胃中有相关氨基酸转运载体的表达,同时周英昊[17]研究发现瘤胃内存在碱性氨基酸转运载体的表达,但是瘤胃和瓣胃对氨基酸吸收的机制尚缺乏具体研究。氨基酸是动物机体营养、代谢和免疫的组成物质,对动物机体的生理活动有着很重要的作用[12]。Asp是动物机体的非必需氨基酸,在机体内能够从转氨基途径以及草酰乙酸生成,是动物机体内Lys、蛋氨酸(Met)等氨基酸的合成前体物[18];Glu在动物机体内蛋白质代谢过程中占有重要的地位,也是动物机体内发生转氨基反应的主要氨基酸[19];Pro在动物机体内主要以Glu磷酸化后的底物合成[20];Gly和Ala也是动物机体的非必需氨基酸,Gly主要是以Ser为底物合成[21],而Ala主要是从丙酮酸的中间代谢产物而来。本试验结果表明,复合植物提取物能够显著提高瘤胃游离Asp、Thr、Glu、Gly、Ala和Pro的含量,这有可能是复合植物提取物能够促进瘤胃微生物分泌更多的酶,增加RDP在瘤胃中的降解;同时由于Asp和Glu等氨基酸合成前体物的增加,导致其他氨基酸以及微生物蛋白在微生物的作用下合成的数量增加[22]。也有可能是复合植物提取物上调了CASR基因相对表达量从而促进瘤胃分泌胃泌素[23];胃泌素具有促进瘤胃的运动和瘤胃黏膜上皮细胞的增殖,降低瘤胃的排空速度的功能[24],增加饲粮在瘤胃中停留的时间,从而饲粮蛋白质分解产生的氨基酸和瘤胃微生物合成微生物蛋白增加。CASR主要通过磷脂酶C(phospholipase,PLC)信号通路调控胃泌素的分泌,CASR能够通过激活胃泌素分泌细胞(G细胞)上的受体,促进胃酸的分泌[25]。本试验结果表明,复合植物提取物能够上调CASR基因相对表达量,这有可能是植物提取物的活性物质能够刺激瘤胃G细胞的增殖分化,从而提高CASR在G细胞中的表达量,但具体影响机制尚需进一步的研究。
3.2 复合植物提取物对湘东黑山羊回肠游离氨基酸含量及黏膜氨基酸转运载体相对表达量的影响
小肠是蛋白质消化吸收的主要场所,小肠的蛋白质来源主要有瘤胃未降解蛋白(UDP)、微生物蛋白和内源蛋白,其中微生物蛋白是小肠蛋白质的主要来源。其在胰腺以及微生物分泌的酶的作用下分解为肽,随后在肠腔羧肽酶的作用下分解为氨基酸[26],氨基酸主要在空肠近端被吸收[27]。相关研究发现,肠道内游离氨基酸组成和含量受饲粮中蛋白质水平和种类的影响,同时瘤胃内的小肽和氨基酸含量会影响肠道内氨基酸的消化和吸收[28]。有研究指出,植物提取物能够提高空肠胰蛋白酶和糜蛋白酶[29]的活性以及十二指肠和空肠绒毛高度和隐窝深度比[30],从而提高营养物质的吸收。本试验结果发现,复合植物提取物能极显著提高回肠游离Gly、Ala和Arg的含量,显著提高Val的含量,与瘤胃游离氨基酸含量相比大幅下降,说明氨基酸在十二指肠和空肠被大量吸收,流入回肠的游离氨基酸含量减少。而这4种氨基酸含量的升高则可能与植物提取物提高机体抗氧化能力和抗炎症作用[31]有关,本课题组已有研究表明,添加此种复合植物提取物能够显著提高湘东黑山羊的抗氧化能力[32]。相关研究表明,由Glu、Cys和Gly组成的谷胱甘肽(glutathione,GSH)是机体抗氧化的主要物质,而在GSH合成的过程中会产生Ala[33];Val能通过一般性调控阻遏蛋白激酶2(general regulation repressor protein kinase 2,GCN2)防止机体氧化应激以及抗炎症的作用;而Arg能够抑制丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和核因子-κB(nuclear factor-κB,NF-κB)通路来抑制肠道的炎症,这有可能是这4种氨基酸在回肠含量升高的原因[34]。但是本试验结果表明,与Ala、Gly和谷氨酰胺(Gln)转运相关的SL38A2转运载体在回肠黏膜的相对表达量显著上调,Gln在机体内可由Vla和Glu生成,与Arg转运相关的转运载体在回肠黏膜的相对表达量并没有显著差异,而参与Glu和Asp转运的SLC1A1和SLC1A3转运载体在回肠黏膜的相对表达量极显著上调。有研究表明,肠道氨基酸含量过高或过低都会刺激氨基酸转运载体的表达[35-36],因此本试验中3种氨基酸转运载体相对表达量的上调可能与回肠Ala、Gly和Val含量的升高有关,但具体是因为植物提取物抗氧化以及抗炎症作用导致氨基酸含量和相应氨基酸转运载体相对表达量的升高,还是其他的调控机制尚需要进一步的研究。
3.3 复合植物提取物对湘东黑山羊盲肠游离氨基酸含量及黏膜氨基酸转运载体相对表达量的影响
虽然氨基酸的消化吸收主要发生在小肠,但还是有部分蛋白质和氨基酸流入大肠,而氨基酸在大肠的转运吸收受到很多因素的影响,如微生物代谢产物和液体的分泌等[27]。本试验结果表明,相对于回肠游离氨基酸含量,盲肠游离氨基酸含量大幅度降低,同时试验组山羊盲肠游离氨基酸除组氨酸(His)和Arg含量外,其他氨基酸含量在数值上低于对照组,其中试验组山羊盲肠游离Thr、Glu、Gly、Try和Phe含量极显著低于对照组,Ser、Ala、Val和Lys含量显著低于对照组。回肠的相关数据表明,试验组回肠相关氨基酸转运载体的相对表达量显著上调,说明复合植物提取物提高了试验组山羊游离氨基酸在小肠的转运吸收,从而导致试验组山羊盲肠游离氨基酸含量显著降低。同时相关试验发现,植物提取物能够抑制胃肠道有害菌的生长,促进有益菌的生长[37],由于氨基酸的转运吸收主要在小肠,同时流入盲肠的碳水化合物较少,因此氨基酸主要作为盲肠微生物的能量来源[38],微生物对氨基酸的分解利用率提高,从而导致试验组游离氨基酸含量显著低于对照组。盲肠相较于小肠其对氨基酸的转运吸收能力大幅度降低,本试验结果表明,复合植物提取物对盲肠氨基酸转运载体的调节作用并不一致,其中与Glu转运吸收相关的SLC1A1基因相对表达量显著下调,与Lys转运吸收相关的SLC7A1基因相对表达量显著上调,且与Ala、Gly、Ser转运吸收相关的SLC3A2和SLC38A2基因相对表达量显著上调。这有可能是复合植物提取物降低了盲肠游离氨基酸含量,相应氨基酸转运载体的消耗较少,从而导致试验组中相关氨基酸转运载体的相对表达量显著上调。因为复合植物提取物中的活性物质进入大肠的数量非常少,因此其对盲肠氨基酸转运载体的直接作用还需要进一步的研究。
4 结 论
① 饲粮添加0.15%复合植物提取物能够显著提高湘东黑山羊瘤胃和肠道中部分游离氨基酸的含量,增加机体可利用氨基酸的含量,改善机体的氨基酸营养。
② 饲粮添加0.15%复合植物提取物能够显著调控湘东黑山羊瘤胃和肠道部分氨基酸转运载体的相对表达量。

