叶黄素对脂多糖应激黄羽肉鸡生长性能、空肠形态和盲肠微生物的影响
王美艳 童玉鑫 闵 遥 王长康 高玉云
(福建农林大学动物科学学院/蜂学学院,福州 350002)
免疫接种能够有效帮助机体对抗特定外来病原体的侵扰,是畜禽养殖过程中的重要手段,然而高频率、大剂量的疫苗接种会使畜禽产生免疫应激反应。在免疫应激状态下,一方面家禽的采食量下降,饲粮中营养素重新分配,用于肌肉沉积的营养素转向支持一系列免疫系统的代谢反应;另一方面家禽的发病率和死亡率升高[1],最终导致养殖业经济损失。因此,建立动物免疫应激模型,寻找免疫调节的营养素具有重要意义。脂多糖(lipopolysaccharide,LPS)又称内毒素,是革兰氏阴性菌细胞外壁的主要成分。研究表明,腹腔注射LPS会引起肠道绒毛萎缩、肠道菌群改变、肠道炎症、病原体感染及氧化损伤等[2-3],是目前研究动物免疫应激的经典模型[4-6]。本课题组已经建立了LPS肉仔鸡免疫应激模型(于21、23、25日龄时连续3次腹腔注射1 mg/kg LPS)[7],证实LPS注射诱导肉仔鸡生长性能显著下降和肠道炎症应答[8]。叶黄素是类胡萝卜素(carotenoids,Car)的一种,普遍存在于羽衣甘蓝和金盏菊中,具有着色、抗氧化、免疫调控等多种生物学功能[9-11]。叶黄素也可以作为免疫调节的营养素提高畜禽的生长性能,特别是当畜禽处于疾病状态或者LPS应激引起强烈的急性期反应时[12]。本课题组前期研究表明,叶黄素可以调控母鸡和肉仔鸡机体的免疫应答、抗氧化能力、细胞凋亡、Car代谢相关基因以及核因子的表达,但对肠道微生物的作用还不清楚[8,13-16]。家禽的肠道中有一个复杂而动态的微生物群落,主要由细菌组成[17],对宿主的生长性能和健康状态具有重要作用[18-20]。因此,本试验研究不同水平叶黄素对LPS应激肉鸡生长性能、空肠形态和盲肠微生物的影响,通过营养调控手段改善家禽肠道健康,从而为应激条件下肉鸡的营养调控及肠道菌群健康提供理论依据。
1 材料与方法
1.1 试验设计
选择体重相近的1日龄健康黄羽肉公鸡288只,随机分为3个组,每组8个重复,每个重复12只鸡。对照组(C组)饲喂基础饲粮,试验组分别饲喂在基础饲粮中添加20(L组)和40 mg/kg叶黄素(H组,叶黄素含量为2%,原料组成包括天然叶黄素、稻壳粉、石粉、二氧化硅和乙氧基喹啉)的试验饲粮。全部试验鸡于21、23和25日龄时连续3次隔天注射1 mg/kg LPS(购自Sigma,货号L2880),试验期26 d。试验采用碎米-豆粕型饲粮,参考《鸡饲养标准》(NY/T 33—2004)进行配制,基础饲粮组成及营养水平见表1。紫外分光光度法检测饲粮中总叶黄素含量(表2)。试验于福建农林大学动物科学学院家禽试验场开展,饲养于封闭式鸡舍,采用单层笼养,严格控制舍内温度、光照和通风。免疫按照常规程序操作,试验期间自由饮水。
1.2 样品采集
饲养结束后,每个重复随机挑选1只鸡进行屠宰,屠宰前禁食12 h,不禁水。称重记录宰前活重,颈部放血处死。打开腹腔,将空肠和盲肠取出,取空肠中段3 cm左右的组织,用生理盐水将内容物冲洗干净,置于4%多聚甲醛磷酸缓冲液固定;将盲肠内容物放入2 mL冻存管,液氮冻存后转移至-80 ℃保存待测。
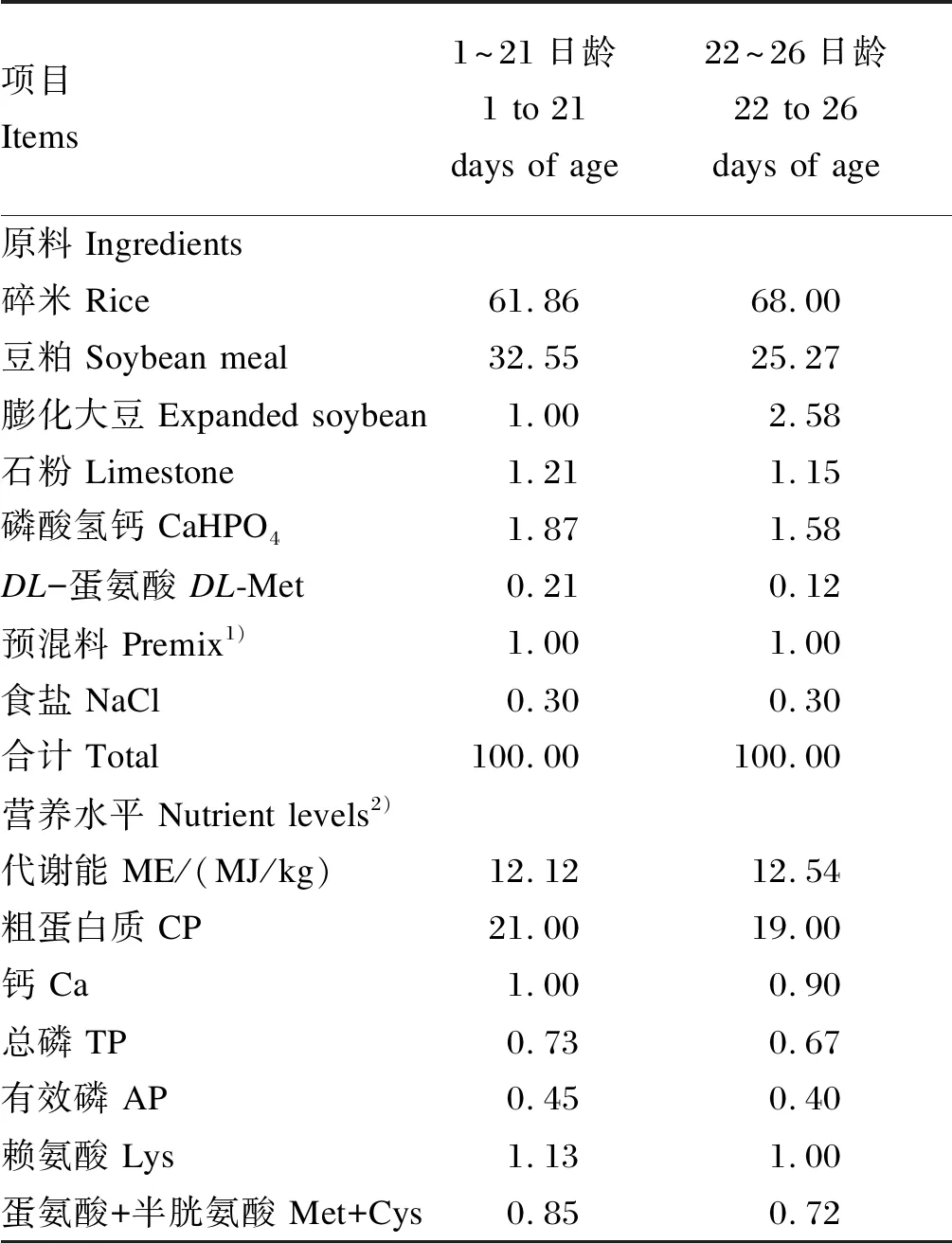
表1 基础饲粮组成及营养水平(风干基础)
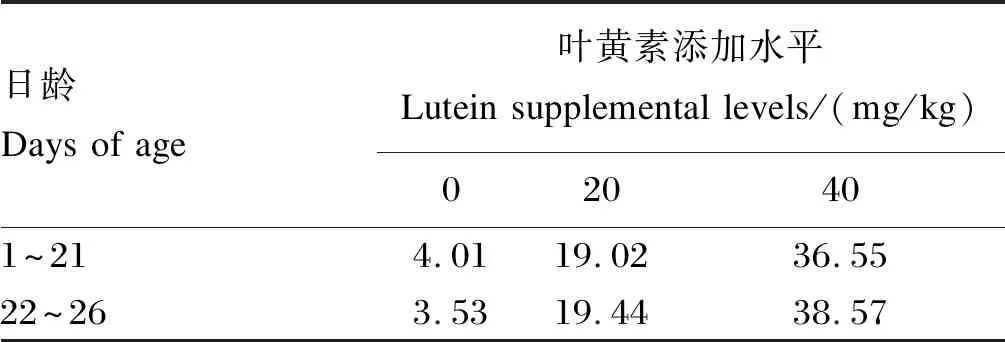
表2 饲粮中叶黄素的测定值
1.3 检测指标与方法
1.3.1 生长性能
于试验第26天08:00(断料12 h),以重复为单位称量试验鸡宰前活重及余料量,统计平均日增重、平均日采食量和料重比。试验期间,如果有鸡只死亡,则立即称余料量和死鸡重,并记录数据。
平均日增重=(平均终末体重-平均
初始体重)/饲喂天数;平均日采食量=平均阶段采食量/饲喂天数;料重比=每个重复的平均阶段采食量/
平均阶段增重。
1.3.2 肠道形态
空肠组织经4%多聚甲醛磷酸缓冲液固定,无水乙醇多稀释梯度脱水后石蜡包埋,连续切片、脱蜡、苏木精-伊红(HE)染色和封片等,光学显微镜进行观察、拍照、分析,并测量绒毛高度、隐窝深度,计算绒毛高度/隐窝深度(villus height/crypt depth,V/C)。
1.3.3 测序及数据分析

1.4 数据处理
试验数据用Excel2019整理后,采用SPSS 25.0统计软件进行单因素方差分析(one-way ANOVA),差异显著时使用Duncan氏法进行多重比较检验,结果均用平均值±标准差(mean±SD)表示。以P≤0.05表示差异显著,以P>0.05表示差异不显著。
2 结 果
2.1 叶黄素对LPS应激黄羽肉鸡生长性能的影响
由表3可知,与C组相比,饲粮中添加40 mg/kg叶黄素可显著提高LPS应激黄羽肉鸡22~26日龄和1~26日龄时的平均日增重(P<0.05),显著降低22~26日龄时的料重比(P<0.05),但各组间的平均日采食量均无显著差异(P>0.05)。
2.2 叶黄素对LPS应激黄羽肉鸡空肠形态的影响
由图1和表4可知,与C相比,饲粮中添加20和40 mg/kg叶黄素可显著提高LPS应激黄羽肉鸡的空肠绒毛高度(P<0.05),添加40 mg/kg叶黄素可显著提高空肠V/C(P<0.05),但各组间的空肠隐窝深度均无显著差异(P>0.05)。
2.3 叶黄素对LPS应激黄羽肉鸡盲肠微生物多样性的影响
2.3.1 测序数据及OTU类
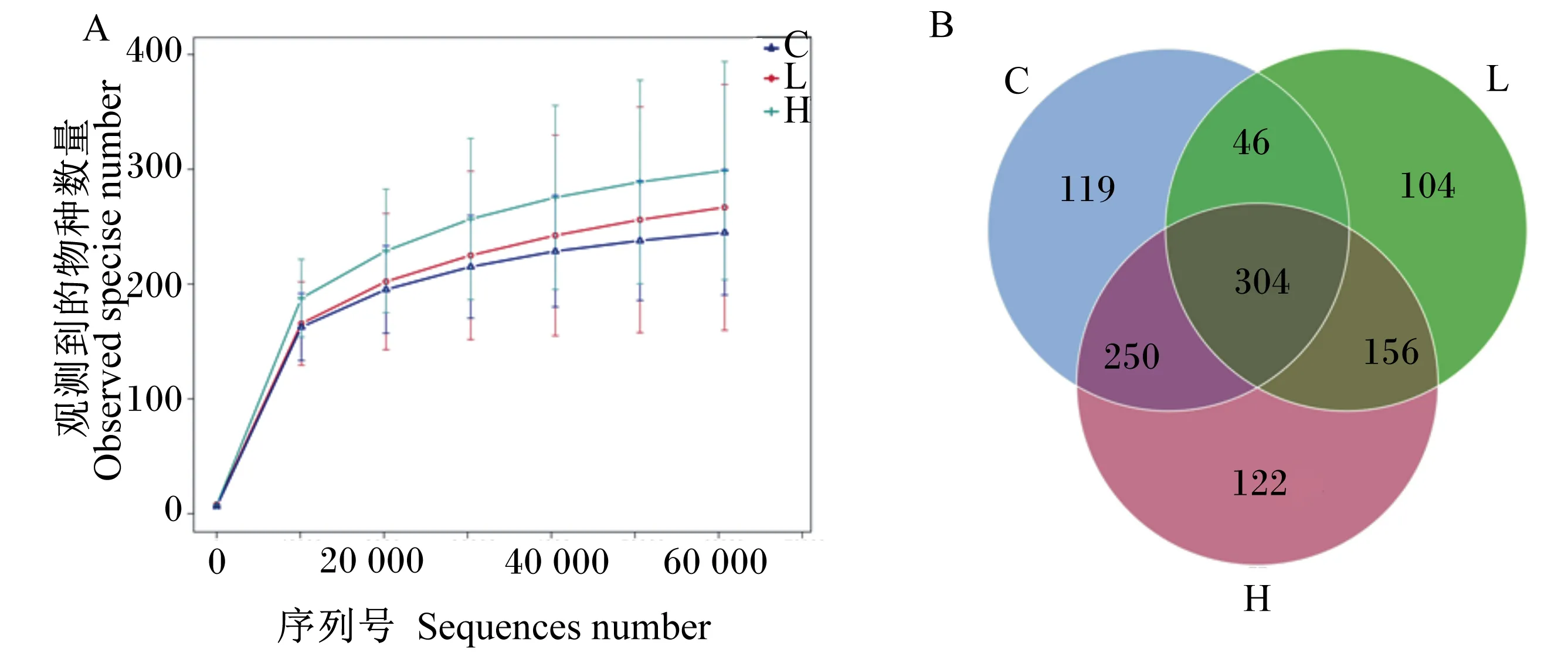
盲肠内容物经测序、质控后有效数据量达65 908,质控有效率达74.01%。以97%的一致性将序列聚类成为OTU,共得到1 154个OTU。由图2-A物种稀释曲线可知,当观测到的物种(observed species)稀释曲线的测序条数达到60 000时,曲线趋向平坦;由表5可知,覆盖率(goods coverage)均为0.99。这说明测序数据合理,测序深度足够,可以反映样品中绝大多数微生物信息。
将所有样品的OTU个数进行韦恩(Venn)分析,从而反映样本组间共有和特有的OTU情况。由图2-B OTU韦恩图可知,3组中共有304个核心OTU,占所有OTU的26.34%。C、L和H组分别特有104、119和122个OTU,同时L和H组共有250个OTU。

表4 叶黄素对LPS应激黄羽肉鸡空肠形态的影响

图1 叶黄素对LPS应激黄羽肉鸡空肠组织HE染色切片的影响
2.3.2 Alpha多样性分析
由表5可知,与C相比,饲粮中添加20和40 mg/kg叶黄素可显著提高LPS应激黄羽肉鸡盲肠微生物的Shannon指数(P<0.05);但各组间盲肠微生物Chao1指数差异不显著(P>0.05)。
2.3.3 Beta多样性分析
在主坐标分析(PCoA)中,样本距离越接近,表示物种组成结构越相似,由图3可知,C组样本集中聚集在右侧,而L和H组样本部分重叠并集中聚集在左侧。多响应置换过程(MRPP)分析法用于分析组间微生物群落结构的差异,配合PCoA降维图使用。由表6可知,3组的组间差异均大于组内差异(A值>0);C组和H组组间差异最大(期望增量=0.41),L组和H组组间差异最小(期望增量=0.37);C组和L组及C组和H组组间差异显著(显著性值<0.05),L组和H组组间差异不显著(显著性值>0.10)。
C: 对照组; L: 20 mg/kg叶黄素组; H: 40 mg/kg叶黄素组。下图同。

表5 叶黄素对LPS应激黄羽肉鸡盲肠微生物Alpha多样性的影响

图3 基于加权Unifrac距离的主坐标分析
2.3.4 门水平和属水平相对丰度分析
由图4-A可知,盲肠微生物注释了10个菌门,其中厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)为优势菌门,占微生物总数的97.61%。由表7可知,饲粮中添加20和40 mg/kg叶黄素黄羽肉鸡盲肠微生物厚壁菌门相对丰度显著高于C组(P<0.05),但变形菌门相对丰度显著低于C组(P<0.05);添加40 mg/kg叶黄素拟杆菌门相对丰度最高。图4-B展示了属水平相对丰度前10的微生物,共占比59.68%。由表7可知,C组中未鉴定的肠杆菌科(unidentified Enterobacteriaceae)相对丰度显著高于其他2组(P<0.05),拟杆菌属(Bacteroides)相对丰度升高(P>0.10);饲粮中添加20和40 mg/kg叶黄素艾森伯格菌属(Eisenbergiella)相对丰度显著高于C组(P<0.05),布劳特氏菌属(Blautia)和腔隙杆菌属(Lachnoclostridium)相对丰度升高(P>0.10);添加40 mg/kg叶黄素普氏梭杆菌属(Flavonifractor)相对丰度显著高于C组(P<0.05)。

表6 MRPP组间差异分析

Firmicutes: 厚壁菌门; Proteobacteria: 变形菌门; Bacteroidetes: 拟杆菌门; Actinobacteria: 放线菌门;Cyanobacteria: 蓝藻门; Unidentified_Bacteria: 未鉴定的细菌; Acidobacteria: 酸杆菌门; Spirochaetes: 螺旋体门; Verrucomicrobia: 疣微菌门; Armatimonadetes: 装甲菌门; Others: 其他; Unidentified_Enterobacteriaceae: 未鉴定的肠杆菌科; Bacteroides: 拟杆菌属; Enterococcus: 肠球菌属; Unidentified_Lachnospiraceae: 未鉴定的毛螺菌科; Eisenbergiella: 艾森伯格菌属; Unidentified_Ruminococcaceae: 未鉴定的瘤胃菌科; Butyricicoccus: 丁球菌属; Bifidobacterium: 双歧杆菌属; Flavonifractor: 普氏梭杆菌; Alistipes: 另枝菌属。

表7 叶黄素对LPS应激黄羽肉鸡盲肠微生物优势门和优势属相对丰度的影响

续表7微生物分类 Taxa of microorganism叶黄素添加水平 Lutein supplemental levels/(mg/kg)02040肠球菌属 Enterococcus5.69±5.387.71±6.244.12±3.06未鉴定的毛螺菌科 Unidentified Lachnospiraceae8.11±4.139.30±3.256.39±2.21艾森伯格菌属 Eisenbergiella3.16±2.61b7.81±1.89a8.04±2.26a未鉴定的瘤胃菌科 Unidentified Ruminococcaceae1.99±1.023.59±2.413.52±1.52丁球菌属 Butyricicoccus2.68±1.473.75±2.084.11±1.69双歧杆菌属 Bifidobacterium1.81±1.181.00±1.211.48±2.58普氏梭杆菌 Flavonifractor0.98±0.47b2.09±0.99ab2.62±1.43a另枝菌属 Alistipes0.12±0.180.40±0.930.97±1.83布劳特氏菌属 Blautia0.43±0.291.07±0.671.07±1.58腔隙杆菌 Lachnoclostridium1.82±0.432.82±1.212.80±0.88
2.3.5 组间差异物种和功能预测
利用线性判别分析效应(LEfSe)分析并通过线性判别分析(LDA)实现降维,从而评估差异物种的影响大小,最后绘制差异物种图。由图5可知,3组间LDA值>4的生物标志物共有14个,包括C组变形菌门、L组厚壁菌门和H组艾森伯格菌属等。由图6可知,为了进一步了解微生物组代谢的情况,采用Tax4Fun法对盲肠微生物进行功能预测,发现与氨基酸代谢、碳水化合物代谢及遗传信息有关的KEGG通路在L和H组中显著富集(P<0.05)。

图5 盲肠微生物LEfSe分析
3 讨 论
3.1 叶黄素对LPS应激肉鸡生长性能的影响
目前,关于叶黄素对肉鸡生长性能的报道结果并不完善。本研究发现,饲粮中添加20和40 mg/kg叶黄素对LPS应激前(1~21日龄)肉鸡的促生长效果不显著。出现这一现象的原因可能是叶黄素对正常生理状态下肉鸡的生长性能没有显著影响。这一结果与李丽平等[21]和阿仑[22]的研究结果基本一致,但Moraes等[23]发现饲粮中添加50 mg/kg叶黄素和1%共轭亚油酸时能显著提高1~20日龄肉鸡的体增重和料重比,缓解共轭亚油酸对肉鸡生长的抑制作用,说明叶黄素对特定条件下肉鸡的生长性能有促进作用。郭俊杰等[24]研究发现,饲粮中添加2 g/kg常规叶黄素可显著提高高温条件[(33.00±0.52)℃]下60~88日龄黄羽肉鸡的末重和平均日采食量,促进肉鸡的生长性能,这与王文龙等[25]和安立龙等[26]的报道基本一致。免疫接种和饲养管理不当等都会诱导肉鸡发生免疫应激反应,从而影响肉鸡的生长性能。本课题组中,张杰[7]研究发现,于肉鸡21、23和25日龄时连续3次隔天注射1 mg/kg LPS,能显著降低肉鸡的平均日增重和体增重;而本试验发现,饲粮中添加40 mg/kg叶黄素能显著提高应激阶段(22~26日龄)和整个试验期(1~26日龄)肉鸡的平均日增重,缓解由于LPS应激造成肉鸡生长性能的下降。这可能与叶黄素具有抗氧化和抗炎特性[24-25],能缓解LPS应激下肉鸡的炎症反应有关。因此,饲粮中添加40 mg/kg叶黄素可以缓解LPS应激下肉鸡生长性能下降的影响。
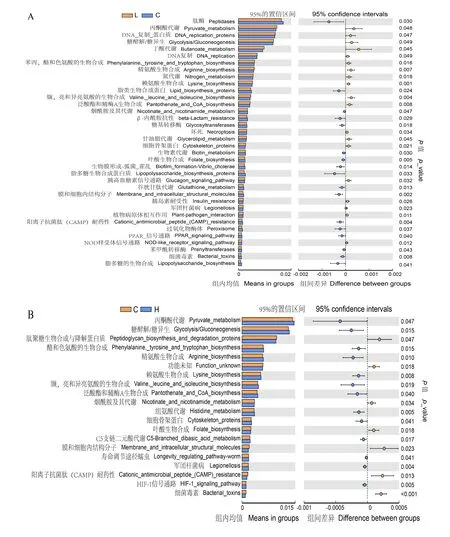
图6 基于KEGG通路分析预测元基因组功能
3.2 叶黄素对LPS应激肉鸡肠道形态的影响
小肠是营养物质消化吸收的主要场所,绒毛高度增加和隐窝深度变浅可以为营养物质的消化吸收提供更大的表面积[26]。Kamboh等[27]研究表明,饲粮中添加金雀异黄素和橙皮苷可以提高LPS应激肉鸡的肠道绒毛高度和V/C。张子琪等[28]研究表明,虾青素和LPS组可以改善小鼠的空肠形态。Csernus等[29]对26日龄肉鸡腹腔注射2 mg/kg LPS,发现添加Car可以提高V/C,并显著提高绒毛高度,促进回肠营养物质吸收。以上研究结果表明,在LPS应激条件下,饲粮中添加Car可以改善肉鸡肠道形态和促进营养物质吸收。本试验结果中,饲粮中添加40 mg/kg叶黄素可以显著提高LPS应激肉鸡的空肠绒毛高度和V/C,说明LPS应激条件下饲粮中添加叶黄素可以改善空肠形态,促进营养物质吸收。
3.3 叶黄素对LPS应激肉鸡盲肠微生物多样性的影响
家禽的胃肠道是细菌丰富度和多样性最高的区域[30],其中盲肠是尿素循环、水分调节和碳水化合物发酵的重要场所,对肉鸡的肠道营养和健康起着重要作用。本试验结果表明,饲粮中添加20和40 mg/kg叶黄素可显著提高LPS应激肉鸡盲肠微生物的Shannon指数,说明饲粮中添加叶黄素可以提高LPS应激肉鸡盲肠微生物的多样性。通过PCoA分析可知20和40 mg/kg叶黄素组LPS应激肉鸡盲肠微生物结构相似,但与C组距离较远,说明饲粮中添加叶黄素可以改变LPS应激肉鸡盲肠微生物的结构和组成。
Wei等[31]对家禽肠道微生物研究发现,肉鸡盲肠中最常见的菌门是厚壁菌门(70%)、拟杆菌门(12%)和变形菌门(9%)。厚壁菌门与纤维分解、碳水化合物代谢有关[32];拟杆菌门能够降解非纤维性碳水化合物、蛋白质,促进胃肠道免疫系统发育[33-34];变形菌门包括大量的革兰氏阴性菌,如大肠杆菌,它们通过细胞壁上的LPS诱导炎症反应[35]。此外,变形杆菌与慢性肠炎的联系已在小鼠模型上得到证实[36]。本试验中,LPS应激肉鸡盲肠微生物中厚壁菌门、变形菌门和拟杆菌门为主要优势菌门,饲粮中添加20和40 mg/kg叶黄素后厚壁菌门的相对丰度约为70%,显著高于C组;变形菌门相对丰度约为10%,显著低于C组。这说明LPS应激对盲肠微生物优势菌门组成没有造成显著影响,但是会改变优势菌门的相对丰度,而添加20和40 mg/kg叶黄素后能改善门水平微生物的相对丰度。饲粮中添加40 mg/kg叶黄素厚壁菌门和拟杆菌门的相对丰度最大,盲肠中消化代谢淀粉类碳水化合物有关细菌以及饲粮中摄取的能量也相对最多。饲粮中添加叶黄素能减少LPS应激肉鸡盲肠中变形菌门和未鉴定的肠杆菌科的相对丰度,在一定程度上能预防家禽呼吸道疾病的发生。本试验中,LPS应激肉鸡盲肠微生物的优势菌属为未鉴定的肠杆菌科和拟杆菌属。与Wei等[31]的结果不一致,这可能与LPS应激诱导肉鸡盲肠微生物菌群改变有关。厚壁菌门下的普氏梭杆菌属,有助于丁酸盐的产生[37],丁酸盐有利于提高饲料转化率和生长性能[38]。本试验中,LPS应激肉鸡后,饲粮中添加40 mg/kg叶黄素普氏梭杆菌属相对丰度显著高于C组,说明添加40 mg/kg叶黄素可能会促进LPS应激肉鸡的生长性能。布劳特氏菌属是一种革兰氏阳性菌,能降解不同类型的碳水化合物,产生乙酸、乳酸等代谢产物,为机体提供能量,减少炎症[39]。本试验中,饲粮中添加20和40 mg/kg叶黄素布劳特氏菌属相对丰度高于C组,说明叶黄素能在一定程度上改善LPS应激肉鸡的盲肠肠道健康。研究发现,肉鸡盲肠微生物中与氨基酸、碳水化合物代谢相关的KEGG通路始终大量存在,这与肉鸡肠道健康密切相关[40-41]。本试验结果表明,各组间KEGG通路表现出差异性富集,其中饲粮中添加20和40 mg/kg叶黄素与氨基酸、碳水化合物代谢相关功能显著富集。因此,饲粮中添加20和40 mg/kg叶黄素均能平衡盲肠菌群结构,缓解免疫应激诱导的盲肠微生物屏障功能损伤。
4 结 论
饲粮中添加20和40 mg/kg叶黄素能改善LPS应激黄羽肉鸡空肠形态和盲肠微生物的结构组成,提高厚壁菌门和艾森伯格菌属相对丰度,降低变形菌门和未鉴定的肠杆菌科相对丰度;与氨基酸代谢、碳水化合物代谢和遗传信息相关的KEGG通路在20和40 mg/kg叶黄素组中显著富集。在本试验条件下,饲粮中添加40 mg/kg叶黄素时效果最佳,能显著提高LPS应激黄羽肉鸡的生长性能。

