高密度脂蛋白胆固醇水平对冠心病合并心力衰竭患者预后的影响
李姣蕾,田晶,吴优优,张岩波4,,韩清华
慢性心力衰竭(CHF)是多种心血管疾病的终末阶段。CHF的患病率高,预后差。2019年《欧洲心力衰竭杂志》报道,中国35岁成人心力衰竭(心衰)患病率约1.3%[1]。CHF患者出院后2~3个月的再住院率近30%,5年病死率达50%[2]。各种心血管疾病均可导致心衰,其中冠状动脉粥样硬化性心脏病(冠心病,CHD)是心力衰竭的重要病因。研究显示[3],约65%的心衰由CHD引起。加之,CHD在非传染性疾病所致死亡中占比高达19.5%[4],使得CHD合并心衰患者的预后备受关注。血脂异常是CHD的主要危险因素之一[5,6]。《2016年中国成人血脂异常防治指南》报道[7],低密度脂蛋白胆固醇(LDL-C)增高是CHD危险性的首要评估指标,而高密度脂蛋白胆固醇(HDL-C)过低同样增加CHD的患病风险。然而,临床中经有效治疗LDL-C达标的部分患者,仍有心血管事件再发风险[8]。因此,另一重要的血浆脂蛋白HDL-C引起人们重视。目前,HDL-C对CHD合并心力衰竭患者预后的作用大小尚不明确。本研究旨在研究CHD合并心力衰竭患者HDL-C水平与心衰严重程度的关系,分析其对死亡的影响,以期为临床血脂干预提供循证学证据,降低该类患者的死亡率。
1 资料与方法
1.1 研究对象选择山西医科大学第一医院和山西省心血管病医院于2014年1月至2018年12月诊断为CHD合并心力衰竭的患者1440例,其中失访183例,最终纳入1257例。按照HDL-C水平三分位数将患者分为三组,低水平组(HDL-C<0.89 mmol/L)426例;中水平组(0.89≤HDL-C≤1.11 mmol/L)428例;高水平组(HDL-C>1.11 mmol/L)403例。纳入标准:既往诊断为冠心病且冠状动脉(冠脉)造影或冠脉CT显示左主干、前降支、回旋支、右冠或主要分支至少一支血管管腔狭窄≥50%[9];按照《中国心力衰竭诊断和治疗指南2018》[10]标准诊断为CHF;纽约心脏病协会(NYHA)心功能分级Ⅱ~Ⅳ级。排除标准:血脂资料不全;严重肝肾功能不全;近两月内发生急性心血管事件;心肌炎、心肌病、风湿性心脏病、心脏瓣膜病、先天性心脏病、高血压病及慢性阻塞性肺疾病等引起的心力衰竭;恶性肿瘤。所有患者均签署知情同意书并经医院伦理委员会批准。
1.2 一般资料应用课题组根据上述心衰指南[10]及临床专家建议制定的CHF电子病例报告表(eCRF)记录患者住院期间的一般情况(性别、年龄、既往史、家族史)、现病史(症状、体征、诊疗经过、病情进展)、辅助检查(血糖、血脂、尿素氮、肌酐、心脏彩超等)及药物治疗(他汀类、抗血小板聚集、β受体阻滞剂)、经皮冠脉介入治疗(PCI)等。每隔半年对患者电话随访,随访内容为死亡事件、时间及药物治疗情况。
1.3 统计学方法采用epidata 3.1对病例内容进行双录入,应用SPSS 22.0进行数据处理及统计分析。计量资料采用(±s)和中位数(四分位数间距)[M(QR)]描述,组间比较采用非参数秩和检验。计数资料采用构成比(%)描述,组间比较采用χ2检验。相关性分析采用Spearman秩相关分析。应用Cox回归方法分析CHD合并心力衰竭患者死亡的影响因素,P<0.05为差异有统计学意义。
2 结果
2.1 HDL-C水平分组基线资料比较本研究纳入患者1257例,平均随访(46.18±20.19)个月,平均年龄(71.12±10.53)岁,其中男性829例,HDL-C(1.03±0.39)mmol/L。于2019年12月完成随访,死亡240例,病死率19.09%。按HDL-C水平三分位数分组,高水平组患者年龄大,男性少,血压、体质指数(BMI)和NYHA分级偏低,合并吸烟史、饮酒史、家族史、糖尿病比例低,丙氨酸氨基转移酶(ALT)、三酰甘油(TG)、肌酐、尿酸值偏低,白蛋白(ALB)、总胆固醇(TC)、LDL-C、左室射血分数(LVEF)偏高,药物中地高辛治疗比例低,差异均有统计学意义(P<0.05)。随访结束后,高水平组患者死亡比例更低,其差异无统计学意义(P>0.05),表1。

表1 三组不同HDL-C水平患者临床基线资料比较
2.2 HDL-C与临床变量的相关分析Spearman相关分析结果表明,LVEF、ALB与HDL-C呈正相关(γLVEF=0.083,γALB=0.113,P<0.01),年龄、NYHA分级、ALT与HDL-C呈负相关(γ年龄=-0.174,γNYHA=-0.097,γALT=-0.101,P<0.01),表2。

表2 HDL-C与临床变量的相关性分析
2.3 HDL-C及相关因素与预后的Cox回归分析多因素Cox回归分析显示:高水平的HDL-C、BMI>23.9 kg/m2及应用他汀类药物可降低患者死亡风险,而年龄>65岁、BMI<18.5 kg/m2及LVEF<50%可增加患者死亡风险(P<0.05),表3。
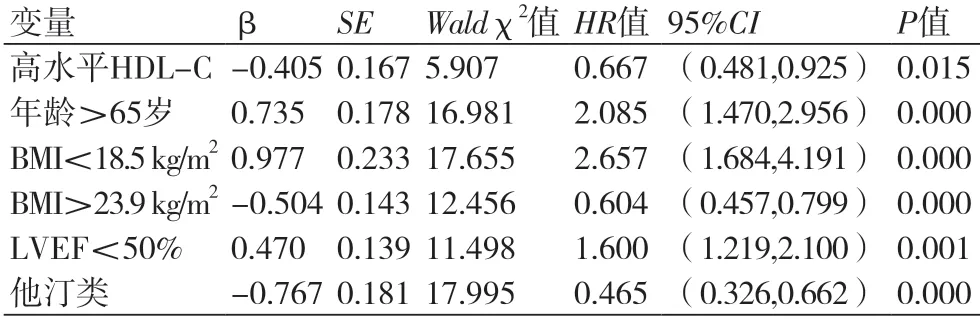
表3 多因素Cox回归分析
3 讨论
《中国胆固醇教育计划调脂治疗降低心血管事件专家建议(2019)》[11]指出,LDL-C水平为CHD患者危险性分层的重要评估指标,其中LDL-C为调脂治疗主要靶标,非HDL-C为次要靶标。另有研究表明,HDL-C与CHD患者的患病率和死亡率呈显著负相关[12]。目前对于CHD合并心力衰竭患者的血脂管理尚无定论,积极寻找对患者预后存在影响的血脂因素,给予早期干预,对改善长期预后具有重要意义。
血浆HDL-C水平受多种因素影响。本研究Spearman分析显示,随着年龄增长血浆HDL-C水平下降,与Walter[13]报道一致。可能是由于随着年龄增长,炎症反应,激素水平改变及端粒长度缩短所致的复制性衰老等影响逆向转运胆固醇,导致血浆HDL-C水平降低[13,14]。性别也是影响HDL-C水平的因素,HDL-C高水平组男性占比低,是由于睾酮会刺激肝脂肪酶和清道夫受体B1编码的基因表达,导致HDL-C分解代谢增加[15]。此外,遗传因素和环境因素(饮食、吸烟、饮酒及体力活动等)也是影响HDL-C的主要因素,通过改善生活方式和调脂治疗来维持血脂水平。
目前有关HDL-C与CHD合并心力衰竭患者关系的研究较少,且结果不一致。一项纳入323例CHD合并心力衰竭患者的回顾性研究显示[16],高HDL-C组患者生存率更高,未发现其他血脂成分对患者预后存在影响,与本研究结果基本一致。另外一项纳入118例CHD合并心力衰竭患者的回顾性研究显示[17],一定范围内TC和HDL-C水平越高,预后越好。Freitas等[18]进行一项针对混合病因所致心衰的研究证实TG和HDL-C升高均可降低心衰患者的死亡率。可能与其多因素Cox回归分析未校正患者药物治疗情况及纳入者为不同病因有关。本研究发现与HDL-C中、低水平组相比,高水平组患者死亡比例更低,但其差异无统计学意义(P>0.05),调整混杂因素后,多因素Cox分析显示,高水平的HDL-C可降低CHD合并心力衰竭患者的死亡风险。原因如下:HDL-C水平与重要营养指标ALB水平呈正相关,说明HDL-C高水平组患者有着更好的营养状况。同时发现HDL-C高水平组患者TC、LDL-C值更高。从生物学角度来看,胆固醇不仅是细胞膜和各种激素的基本组成成分,也是人体主要的能量来源[19]。CHF的长期消耗会导致患者脂质摄入不足及代谢障碍,而高水平的HDL-C、ALB、TC、LDL-C均可提供能量及营养,降低死亡风险;其次,本研究也证实HDL-C水平与心衰严重程度呈负相关,HDL-C水平降低会减弱患者对抗炎症的能力,破坏其免疫功能,出现一系列并发症,加速器官衰竭从而影响预后[20];最后,肝脏是合成胆固醇的主要器官,ALT为评价肝功能的重要指标之一,本研究评估了HDL-C与ALT间的关系,结果表明HDL-C与ALT呈负相关,说明HDL-C高水平组患者肝功能良好是其死亡风险降低的重要原因。
本研究同时证实BMI>23.9 kg/m2及应用他汀类药物可降低患者死亡风险,而年龄>65岁、BMI<18.5 kg/m2及LVEF<50%可增加死亡风险。LVEF是临床反映心脏收缩能力的主要指标,其下降表明心脏收缩能力减弱,每搏输出量减少,增加死亡风险。高龄患者死亡风险增加的原因可能与老年人免疫功能低下、脏器功能老化、合并症增加以及日常护理不规范等有关。Powell-Wiley等[21]研究显示,射血分数降低型心力衰竭患者高BMI水平与30 d内低全因死亡率相关,而射血分数保留型心力衰竭患者BMI水平超过30 kg/m2,会增加死亡风险。说明肥胖可能代表患者营养状况良好,未出现恶病质及血流动力学改变[22]。Lee等[23]指出,对于CHD合并心力衰竭患者,他汀类药物治疗是获益的,可能与他汀类药物调脂外的抗炎、抗氧化、恢复内皮功能等其他生物学作用有关。
综上,本研究以CHD合并心力衰竭患者为研究对象,证实HDL-C可作为评估该类患者心衰严重程度及预后的重要指标之一,也为该类患者血脂管理提供新的循证学证据,提示在临床中不能忽视对HDL-C的管理,为改善患者长期预后提供新的治疗靶点。本研究局限之处在于并非随机对照研究;随访中未对患者进行HDL-C水平监测,仍需更大样本、多中心的前瞻性研究进一步确定HDL-C水平最佳靶点。

