高浓度葡萄糖通过Bmi1促进小儿肾母细胞瘤免疫逃逸的机制研究
梅娥,吕明珠,海本刚
(1.十堰市妇幼保健院,湖北 十堰 442000; 2.湖北医药学院 附属东风医院,湖北 十堰 442000;3.十堰市郧阳区妇幼保健院,湖北 十堰 442000)
小儿肾母细胞瘤是儿童常见的恶性肿瘤之一,全球每年的发病率为1/10万[1]。近年来随着治疗方法的优化,小儿肾母细胞瘤的预后已得到明显改善,但抑制其复发和转移一直是临床研究热点[2]。研究发现,小儿肾母细胞瘤患儿被诊断为糖尿病的风险显著增加[3],表明小儿肾母细胞瘤与糖尿病之间存在一定的相关性。探究两者的潜在关系也是治疗小儿肾母细胞瘤必须解决的重要问题。B细胞特异性MLV整合位点- 1(Bmi1)是胚胎发育信号系统中重要的调控因子[4]。Duan等[5]发现,高浓度葡萄糖诱导胰腺癌细胞的Bmi1表达升高,进而降低自然杀伤细胞(NK细胞)对胰腺癌细胞的免疫杀伤敏感性,说明Bmi1在葡萄糖调控NK细胞杀伤肿瘤细胞中具有重要作用。近年研究显示,Bmi1在小儿肾母细胞瘤中高表达,且与肿瘤的预后及转移相关[6]。目前有关Bmi1与NK细胞对小儿肾母细胞瘤杀伤敏感性的研究尚未见报道,本研究通过观察Bmi1在小儿肾母细胞瘤组织和细胞中的表达,阐明不同浓度葡萄糖作用下,Bmi1表达变化及沉默Bmi1对NK细胞杀伤小儿肾母细胞瘤细胞敏感性的影响,以期为临床探究小儿肾母细胞瘤免疫逃逸提供参考依据。
1 材料与方法
1.1 组织样本、细胞株及主要试剂
25例肿瘤组织样本均来自十堰市妇幼保健院2018年3月至2020年2月收治的小儿肾母细胞瘤病例。所有患儿术后病理诊断皆为小儿肾母细胞瘤,术前未行化疗或放疗,且所有患儿监护人已签署知情同意书。本研究获得十堰市妇幼保健院伦理委员会的批准。组织样本均保存于-80 ℃。肾母细胞瘤细胞G401和胚肾细胞CCC- HEK- 1均购自中国科学院上海细胞生物学研究所,McCoy’s 5A培养基、胎牛血清、胰酶和DMEM培养基均购自美国Gibco公司,淋巴细胞分离液购自上海信裕生物科技有限公司,NK细胞培养基购自武汉普诺赛生命科技有限公司,PE标记的CD3、FITC标记的CD56、NKG2D单抗、MHCⅠ类多肽相关序列A(MICA)及MICB单抗均购自美国BD公司,Trizol试剂和实时荧光定量聚合酶链反应(qRT- PCR)试剂盒购自赛默飞世尔科技(中国)有限公司,对照小干扰RNA(si- NC)、Bmi1小干扰RNA(si- Bmi1)、LipofectamineTM 3000及BCA 蛋白定量试剂盒均购自美国Invitrogen公司;Bmi1抗体、二抗(羊抗兔)和乳酸脱氢酶(LDH)释放检测试剂盒均购自美国Abcam公司。
1.2 细胞培养及小干扰RNA转染
CCC- HEK- 1细胞用含10%胎牛血清的DMEM培养基置于37 ℃、5%CO2培养箱培养;G401细胞用含10%胎牛血清的McCoy’s 5A培养基置于37 ℃、5%CO2培养箱培养。收集对数生长期的G401细胞,显微镜下计数,调整细胞浓度至3.0×106个·ml-1,接种于6孔板内。按照LipofectamineTM3000转染试剂说明书,将50 ng的si- NC、si- Bmi1分别转染G401细胞,置于37 ℃、5%CO2培养箱培养24 h后更换培养基。在高浓度葡萄糖刺激实验中,含胎牛血清的培养基中分别加葡萄糖至终浓度为5、10、15 mmol·L-1。
1.3 NK细胞的分离及鉴定
依据淋巴细胞分离液实验步骤分离3例健康人外周血单个核细胞,加入NK细胞培养基置于37 ℃、5%CO2培养箱培养。PBS洗涤重悬NK细胞,调整细胞浓度至1×107个·ml-1,依次加入PE标记的CD3抗体、FITC标记的CD56抗体,室温避光条件下孵育20 min,PBS重悬细胞后利用流式细胞仪检测NK细胞表型。
1.4 免疫组化法检测Bmi1的表达
将获得的小儿肾母细胞瘤组织样本和瘤旁正常组织进行常规石蜡切片,切片脱蜡后蒸馏水浸洗1 min,对切片进行抗原修复,滴加3%的H2O2于组织切片,室温孵育10 min,磷酸盐缓冲溶液(PBS)冲洗。滴加稀释的山羊血清,室温孵育40 min,滴加Bmi1抗体,4 ℃孵育过夜。PBS冲洗切片,滴加二抗37 ℃孵育25 min。PBS冲洗切片,滴加DAB显色液,自来水冲洗终止染色,加入Harris苏木素复染1 min,水洗后用1%的盐酸酒精分化,再用自来水水洗返蓝。将切片进行梯度酒精脱水后,再依次滴加二甲苯Ⅰ和二甲苯Ⅱ,封片剂封片后晾干、镜检、拍照。
1.5 qRT- PCR检测Bmi1、MICA及MICB的mRNA表达
Trizol试剂提取组织样本或细胞的总RNA,采用反转录试剂盒一步法进行反转录,根据荧光定量试剂盒所述实验方法进行qRT- PCR反应,引物序列见表1。反应条件为:95 ℃变性15 s、55 ℃退火30 s、72 ℃延伸10 s,进行40个循环。扩增结果采用2-ΔΔCt法计算Bmi1、MICA及MICB的mRNA相对表达量。

表1 qRT- PCR引物序列
1.6 蛋白质印迹法检测Bmi1、MICA及MICB的蛋白表达
RIPA细胞裂解液裂解已转染的G401细胞,提取细胞总蛋白,利用BSA法检测细胞蛋白浓度。取120 μg 蛋白进行变性,10%分离胶进行SDS- PAGE电泳分离等量蛋白,将目标蛋白转至PVDF膜。5%脱脂牛奶4 ℃封闭1 h,TBST洗膜5 min共3次,加入Bmi1、MICA和MICB抗体(1∶1 500),4 ℃摇床孵育过夜。TBST洗膜5 min共3次,加入HRP标记的兔抗鼠的二抗(1∶1 000)37 ℃孵育1 h,TBST洗膜5 min共5次。显影曝光,利用Image- Pro Plus图像分析系统对蛋白条带的灰度值进行分析。
1.7 流式细胞术检测NKG2D配体MICA、MICB的表达
收集G401细胞,PBS重悬洗涤细胞,以5.5×104个·ml-1的浓度接种于96孔板内。根据每106个细胞1 μg的浓度加入MICA和MICB抗体,4 ℃孵育细胞25 min,PBS洗涤细胞,加入FITC标记的山羊抗鼠二抗4 ℃孵育30 min,PBS洗涤3次,利用流式细胞仪分析阳性细胞。
1.8 LDH法检测NK细胞对G401细胞的杀伤敏感性
根据实验目的,胰酶消化葡萄糖处理或转染的G401细胞(靶细胞),利用含无胎牛血清的McCoy’s 5A培基重悬细胞,调整细胞密度至4×105个·ml-1。收集NK细胞,PBS洗涤重悬细胞,NKG2D单抗孵育NK细胞20 min。PBS洗涤NK细胞及NKG2D单抗孵育的NK细胞(效应细胞),使用含无胎牛血清的DMEM培养基重悬细胞,调整细胞密度至8×106个·ml-1。按照效靶比20∶1将细胞加入96孔板内,为实验组。同时设置效应细胞自然释放组、靶细胞自然释放组及靶细胞最大释放组。每组各设置6个复孔。将96孔板置于37 ℃、5%CO2培养箱培养6 h,离心后每孔吸取100 μl细胞上清置于96孔板,每孔加入100 μl的LDH溶液作用5 min,加入1 mol·L-1的盐酸,利用酶标仪在490 nm处检测光密度值(OD值)。杀伤敏感性=(实验组OD值-效应细胞自然释放组OD值)/(靶细胞最大释放组OD值-靶细胞自然释放组OD值)×100%。
1.9 统计学处理
统计学分析采用SPSS 20.0软件,取3次独立实验结果,数据均以均数±标准差表示,组间两两比较采用t检验,多组间双因素比较采用Two- way ANOVA分析,P<0.05表示差异具有统计学意义。
2 结 果
2.1 Bmi1蛋白在小儿肾母细胞瘤组织及细胞中的表达
免疫组化实验结果显示,Bmi1在小儿肾母细胞瘤瘤旁正常组织中表达微弱,而在瘤组织中过度表达,见图1。
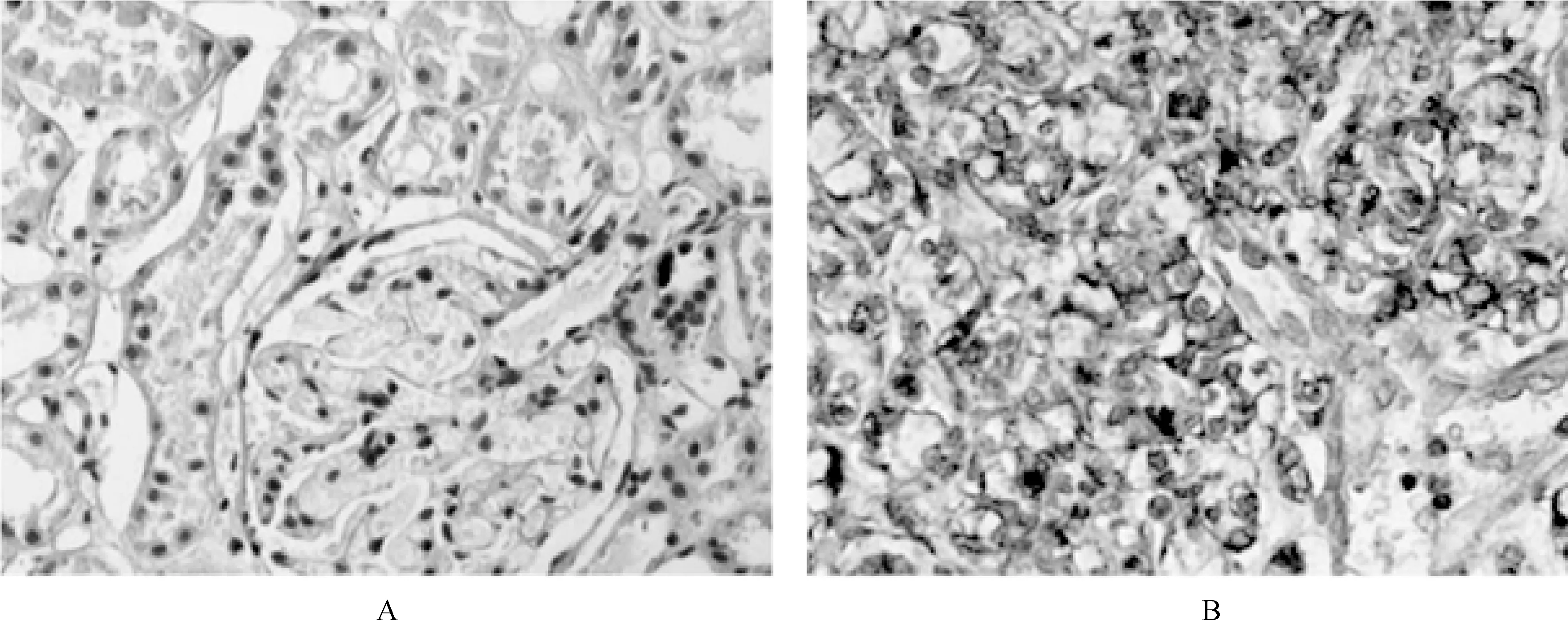
图1 小儿肾母细胞瘤组织和瘤旁正常组织Bmi1蛋白表达的免疫组化染色结果(×200) A.瘤旁正常组织; B. 小儿肾母细胞瘤组织
2.2 Bmi1蛋白在肾母细胞瘤细胞G401和胚肾细胞CCC- HEK- 1中的表达
qRT- PCR及蛋白质印迹实验结果显示,肾母细胞瘤细胞G401中Bmi1蛋白和mRNA表达水平高于胚肾细胞CCC- HEK- 1(P<0.01),见表2。
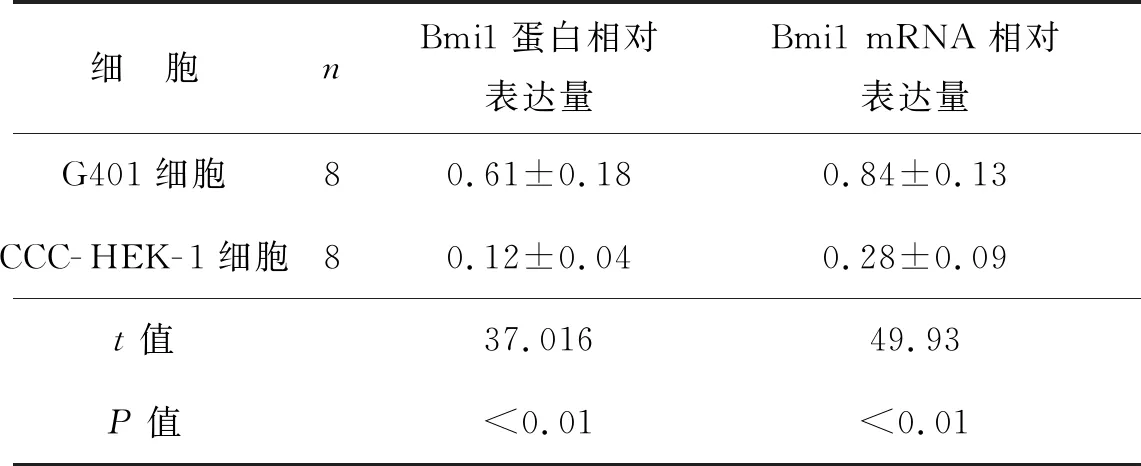
表2 G401细胞和CCC- HEK- 1细胞中Bmi1蛋白及mRNA的表达水平比较
2.3 不同浓度葡萄糖对G401细胞中Bmi1表达的影响
qRT- PCR及蛋白质印迹实验结果显示,随着葡萄糖浓度的增加,G401细胞中Bmi1 mRNA及蛋白表达水平明显升高(P<0.05),见表3。

表3 不同浓度葡萄糖对G401细胞中Bmi1蛋白及mRNA表达的影响
2.4 不同浓度葡萄糖对G401细胞中MICA和MICB表达的影响
qRT- PCR及蛋白质印迹实验结果显示,随着葡萄糖浓度的增加,G401细胞中MICA和MICB的蛋白及mRNA表达水平逐渐降低(P<0.05),见表4。流式细胞实验结果显示,随着葡萄糖浓度的增加,G401细胞的MICA和MICB表达水平逐渐降低,见图2。
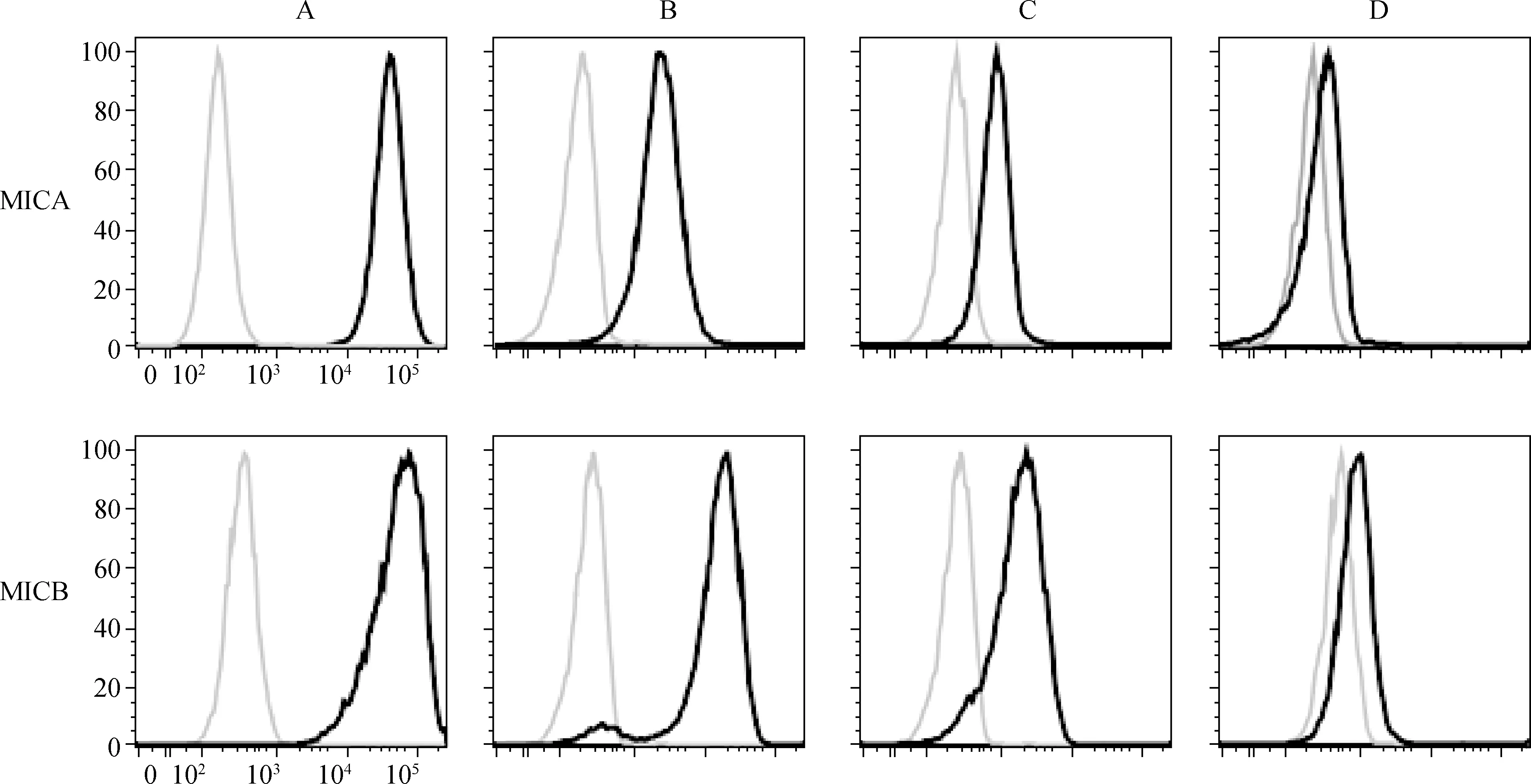
图2 不同浓度葡萄糖对G401细胞中MICA和MICB表达的影响 A、B、C、D深色曲线依次为0、5、10、15 mmol·L-1浓度的葡萄糖,浅色曲线为IgG对照
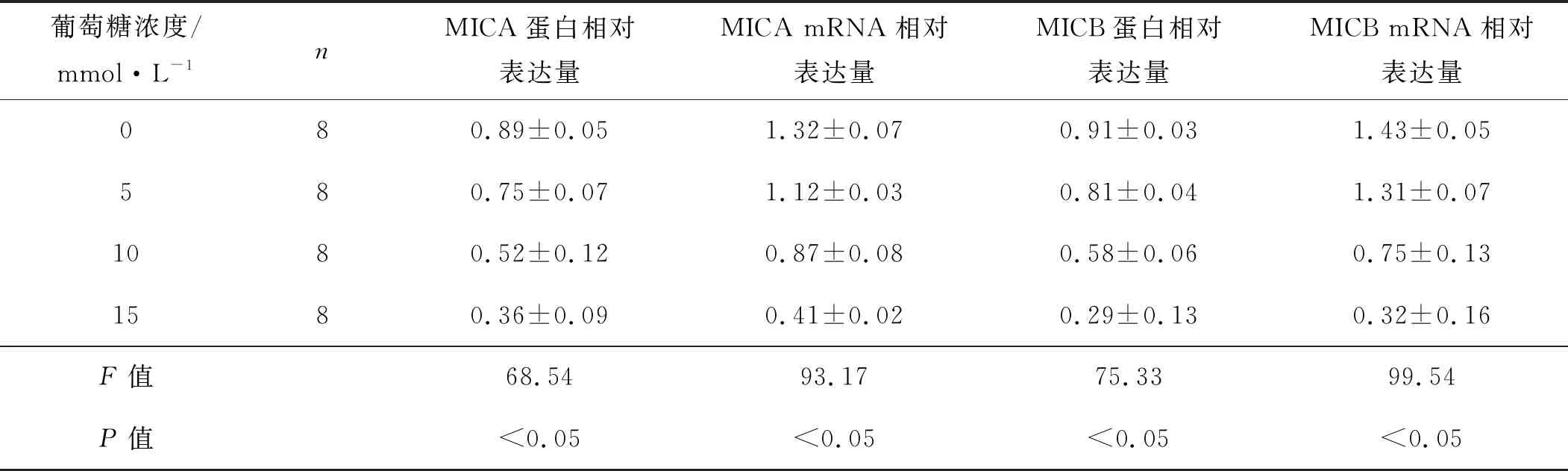
表4 不同浓度葡萄糖对G401细胞中MICA和MICB蛋白及mRNA表达的影响
2.5 沉默Bmi1对高浓度葡萄糖处理的G401细胞中MICA和MICB表达的影响
由于15 mmol·L-1葡萄糖处理G401细胞后Bmi1蛋白表达最高,MICA和MICB蛋白表达最低,因此选择15 mmol·L-1葡萄糖处理的G401细胞作为此实验细胞。qRT- PCR及蛋白质印迹实验结果显示,与si- NC相比,si- Bmi1促进G401细胞中MICA和MICB的蛋白及mRNA的表达(P<0.05),见表5。流式细胞实验结果显示,与si- NC相比,si- Bmi1促进G401细胞中MICA和MICB的表达,见图3。
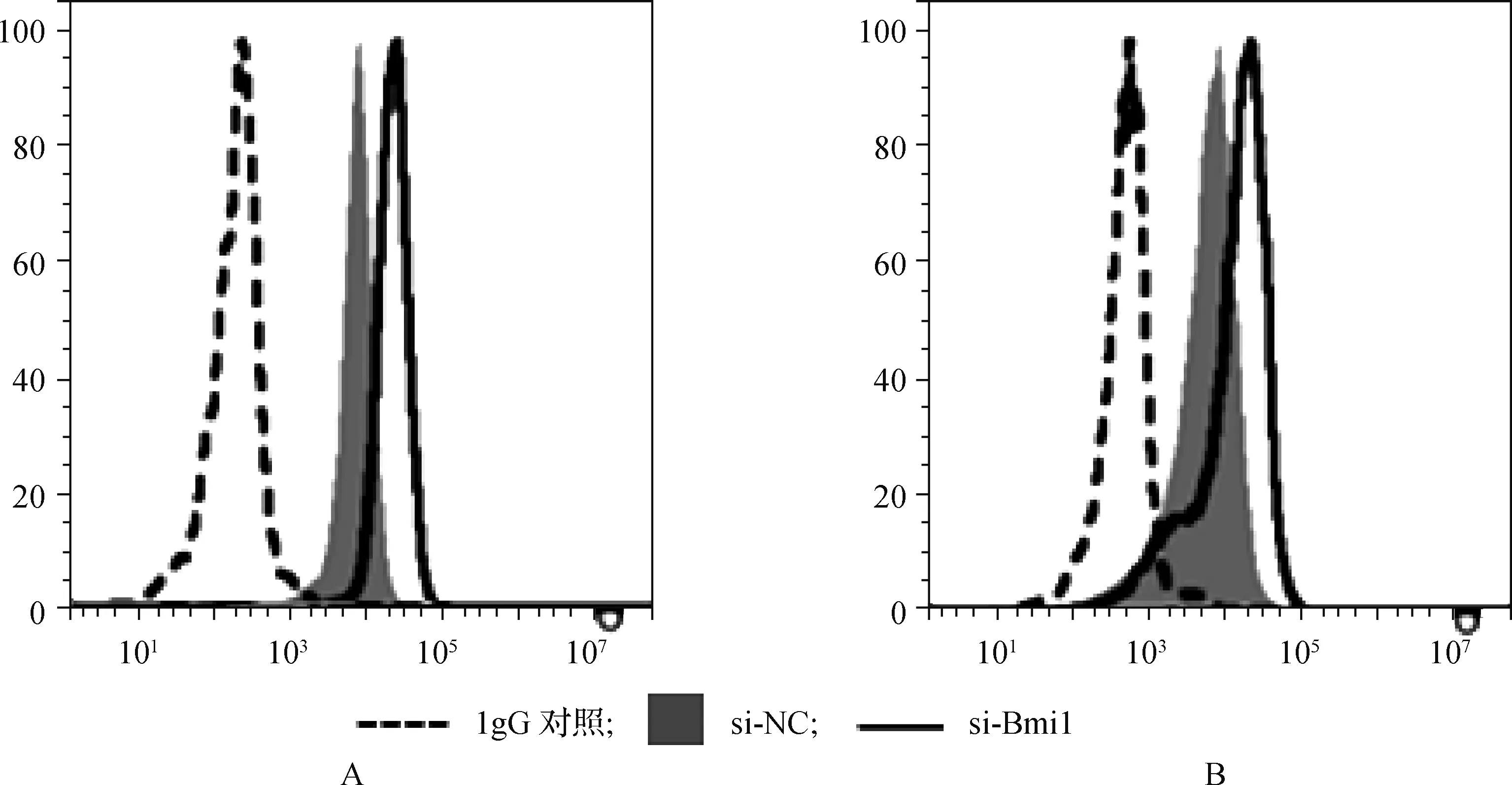
图3 沉默Bmi1对高浓度葡萄糖处理的G401细胞中MICA及MICB表达的影响 A.MICA; B. MICB
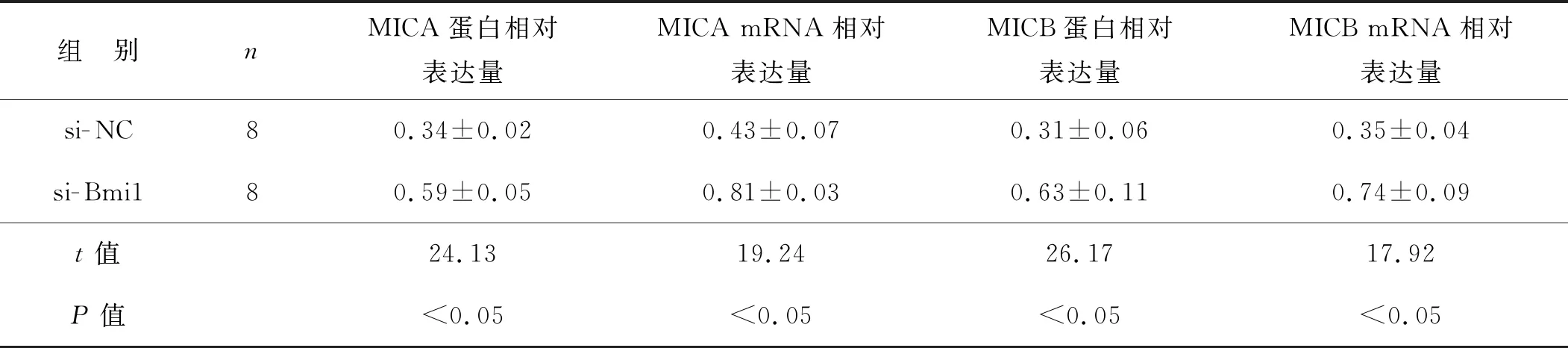
表5 沉默Bmi1对高浓度葡萄糖处理的G401细胞中MICA和MICB蛋白及mRNA表达的影响
2.6 NK细胞纯度鉴定
流式细胞实验结果显示,CD3-CD56+的NK细胞纯度达到90%以上,见图4。
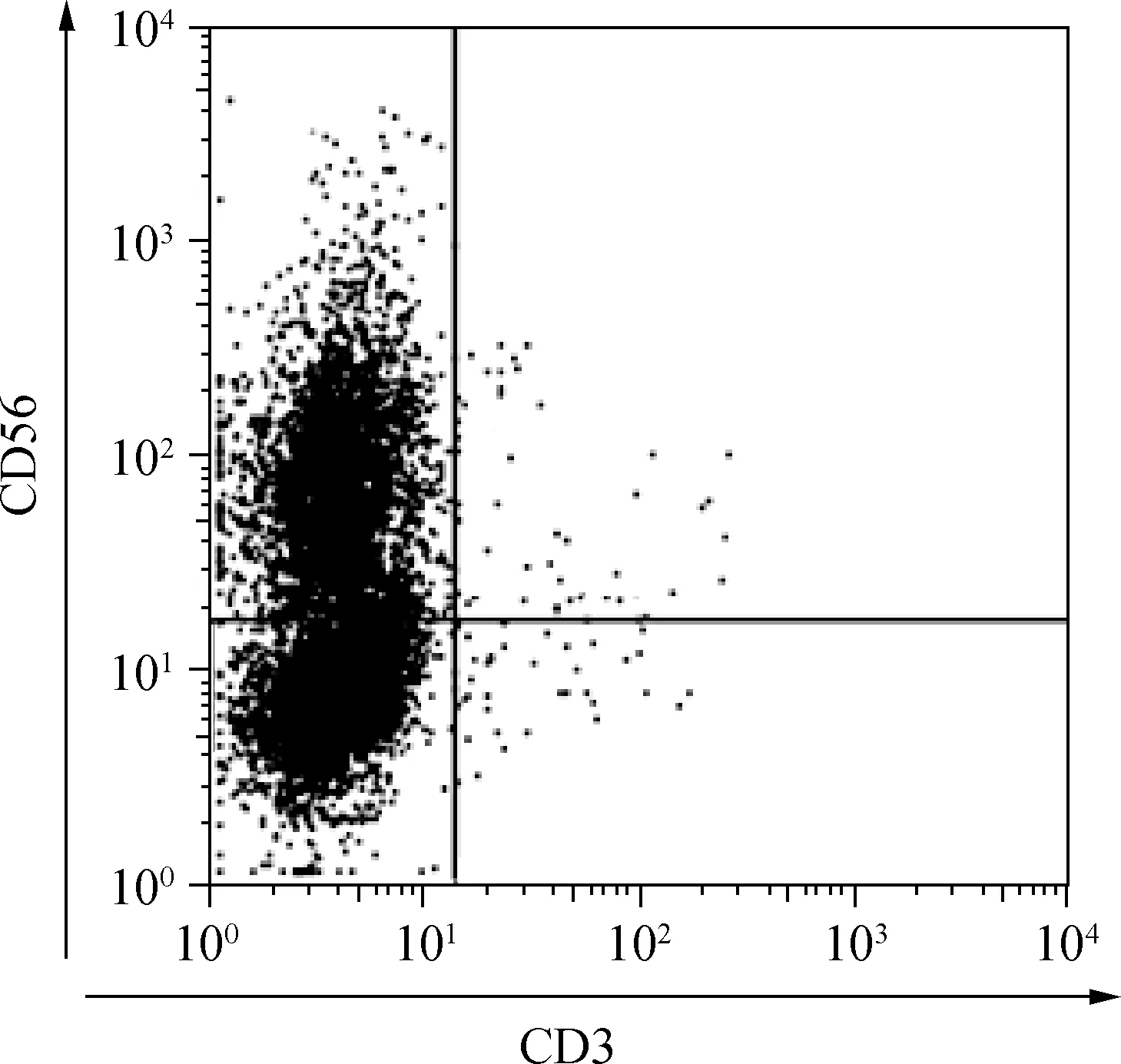
图4 CD3-CD56+的NK细胞
2.7 不同浓度葡萄糖对NK细胞杀伤G401细胞敏感性的影响
LDH实验结果显示,NK细胞对无葡萄糖及含5、10、15 mmol·L-1葡萄糖的G401细胞的杀伤率依次为52.11及41.37、18.42、10.03,表明随着葡萄糖浓度的升高,NK细胞对G401细胞的杀伤敏感性降低(P<0.05)。
2.8 沉默Bmi1对NK细胞杀伤高浓度葡萄糖处理的G401细胞敏感性的影响
由于15 mmol·L-1葡萄糖对NK细胞杀伤G401细胞的抑制作用最强,因此选择15 mmol·L-1葡萄糖处理的G401细胞作为此实验细胞。LDH实验结果显示,NK细胞对si- NC组G401细胞的杀伤率为11.13±0.23,对si- Bmi1组G401细胞的杀伤率为32.16±0.27,两者差异具有统计学意义(P<0.05)。
2.9 NKG2D抗体对NK细胞杀伤G401细胞敏感性的影响
LDH实验结果显示,NKG2D抗体封闭NK细胞表面的NKG2D受体,NK细胞对高浓度葡萄糖处理的G401细胞的杀伤敏感性低于单抗阻断前(P<0.05)。比较抗体封闭前后不同葡萄糖浓度下NK细胞对G401细胞的杀伤敏感性差异也具有统计学意义(P<0.05),见表6。此外,NK细胞对沉默Bmi1后的高浓度(15 mmol·L-1)葡萄糖处理的G401细胞的杀伤敏感性低于单抗阻断前(P<0.05),见表7。

表6 NKG2D抗体对NK细胞杀伤不同浓度葡萄糖作用的G401细胞敏感性的影响
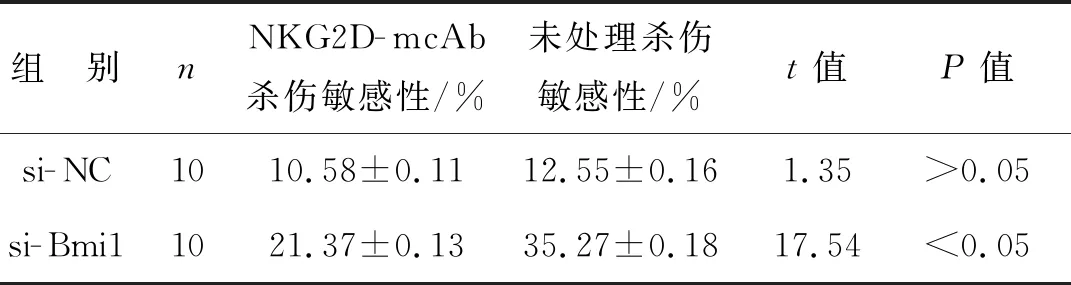
表7 NKG2D抗体对NK细胞杀伤沉默Bmi1高浓度葡萄糖处理的G401细胞敏感性的影响
3 讨 论
小儿肾母细胞瘤是小儿泌尿系统常见的恶性肿瘤,发病率约占小儿实体瘤的8%[7]。研究显示,小儿肾母细胞瘤患儿在治疗过程中机体糖代谢异常,导致患儿患糖尿病的概率增加[8]。最新研究发现,机体内高浓度的葡萄糖会抑制NK细胞的数量和功能[9- 10]。NK是机体重要的淋巴细胞,在抑制肿瘤免疫逃逸中发挥重要作用,因此探究高浓度葡萄糖对小儿肾母细胞瘤免疫逃逸的影响是十分必要的。
Bmi1是PRC1家族的主要成员之一,在肿瘤的发生发展中发挥促癌因子的作用[11- 12]。最新研究显示,高浓度葡萄糖可通过Bmi1促进胰腺癌细胞逃避NK细胞的免疫杀伤[5]。本研究发现Bmi1在小儿肾母细胞瘤组织和G401细胞中高表达,随着葡萄糖浓度的升高,G401细胞中Bmi1表达量也随之升高,说明高浓度葡萄糖可促进G401细胞中Bmi1的表达。
Duan等[5]研究发现,过表达Bmi1通过抑制MICA和MICB表达,降低NK细胞对胰腺癌细胞的杀伤敏感性。NK细胞表面关键的活化性抗体NKG2D与肿瘤细胞表面活化性受体NKG2DL(MICA和MICB)结合,给予NK细胞活化性信号,直接杀伤肿瘤细胞。近年研究发现,高浓度葡萄糖参与调控NK细胞对肿瘤细胞的杀伤敏感性[13]。连小珂等[14]研究发现,消化系统恶性肿瘤患者体内的高血糖会抑制NK细胞数量及其功能的发挥。本研究发现,高浓度的葡萄糖抑制G401细胞中MICA和MICB的表达,并降低NK细胞对G401细胞的杀伤敏感性;在机制探讨部分,我们着重研究Bmi1在其中发挥的作用。研究发现沉默Bmi1可逆转高浓度葡萄糖对MICA和MICB表达及NK细胞杀伤G401细胞敏感性的抑制作用。此外,利用NKG2D抗体作用于NK细胞发现,NK细胞对高浓度葡萄糖处理的G401细胞及沉默Bmi1的高浓度葡萄糖处理的G401细胞的杀伤敏感性均降低。这表明,高浓度葡萄糖是通过Bmi1抑制G401细胞MICA及MICB的表达,减少G401细胞表面MICA及MICB与NK细胞表面MG2D的结合,抑制NK细胞对G401细胞的杀伤敏感性。
综上所述,Bmi1在小儿肾母细胞瘤组织及肾母细胞瘤细胞G401中高表达,高浓度葡萄糖促进Bmi1的表达,抑制MICA和MICB的表达,降低NK细胞对G401细胞的杀伤敏感性,沉默Bmi1可逆转高浓度葡萄糖对MICA和MICB表达及NK细胞杀伤G401细胞敏感性的抑制作用,这可为进一步探讨小儿肾母细胞瘤免疫逃逸机制提供新的思路。

