2015-2020年我国禽腺病毒流行病学调查及高致病性FAdV-4分离株遗传变异性分析
冯敬敬,牛登云,马利芳,段宝敏,史秋颖,李 颖
(天津渤海农牧产业联合研究院有限公司,天津 300308)
腺病毒是家禽和其他养殖动物常见传染病,国际病毒分类委员会将腺病毒家族分为12类,包括5种禽腺病毒(Fowl adenovirus A-E)、3种火鸡腺病毒(Turkey adenovirus B-D)、1种鹰腺病毒(Falcon adenovirus A)、1种鹅腺病毒(Goose adenovirus A)、1种鸭腺病毒(Duck adenovirus B)、1种猪腺病毒(Pigeon adenovirus A)[1-2]。禽腺病毒为双股DNA病毒,无囊膜,衣壳蛋白主要有五邻体(fiber,12个)和六邻体(hexon,240个),其中六邻体是主要结构蛋白,含有型、群和亚群的特异性抗原决定簇,且所有的禽腺病毒都存在相同的群特异性抗原决定簇[3-4]。
禽腺病毒病最早发生于1987年的巴基斯坦安加拉哥特,所以也被称为安卡拉病,随后在印度、科威特、伊拉克、日本、韩国、俄罗斯、墨西哥南部和中美地区相继暴发,给家禽养殖业造成重大经济损失,该病毒具有较高的传染性,包括垂直传播和水平传播[5-7]。该病在我国首次暴发于1976年的台湾,之后在江苏、河南、山东地区相继出现,2010年以后该病呈大面积暴发趋势。根据不同国家的研究情况来看,FAdV-4是主要流行的血清型。主要感染3~5周龄的肉鸡,致死率高达80%,一般在感染后3周开始出现死亡,第4周死亡率达到最高,第5周死亡率开始下降。感染该病的机体表现为渗透压减少,血管通透性增加,脾脏肿大导致全身组织循环不畅,组织液聚集心脏,引发心包积液[8]。根据实验研究和资料显示,FAdV-4本身可以引起发病,而且可以从感染鸡只的肝脏匀浆中分离到该病毒,而其他毒株需要免疫抑制因素的协同作用才能致病,且不同分离株的毒力和稳定性存在一定差别[9-10]。
目前关于禽腺病毒的致病机理尚不明确,关于FAdV-4型致病基因还存在争议,所以不间断的区域监测是十分重要的。本中心从2015年开始,对全国重点养殖禽类的区域进行了监测跟踪,截止到2020年12月,共收集到7098余份禽腺病毒疑似样品,共测序成功1668份,分离到703株,其中高致病性FAdV-4型437株,非致病性FAdV-4型2株,根据氨基酸的比对分析发现,部分位点已出现变异。
1 材料和方法
1.1 主要试剂和细胞系 主要试剂有96孔板预封装核酸提取试剂购自西安天隆科技有限公司;PCR高保真酶以及HiFi Buffer购自北京全式金生物技术有限公司;RNase-free Water购自北京全式金生物技术有限公司;dNTP Mixture、Reverse Transcriptase M-MLV(RNase H-)、Recombinant RNase Inhibitor、DL2000 DNA marker均购自宝生物工程(大连)有限公司;Biowest Agarose购自北京沃比森科技有限公司;DMEM高糖液体培养基、0.25%胰酶和青链霉素均购自美国Gibco公司;FBS购自美国康宁公司;LMH细胞系由本中心保存。
1.2 临床样本来源 2016-2020年共收集到来自全国各地的7098份禽腺病毒疑似样品,包括发病鸡只的肛拭子、心包积液、肝脏、心脏、肺脏、气管、肾脏等。
1.3 引物设计和hexon基因PCR鉴定 将GenBank上登录的12个血清型毒株序列用作参考毒株,并根据4型参考毒株ON1(GenBank登录号:GU188428)的hexon基因序列,利用Primer Premier 5.0设计引物,FAdV-F:5'-TGGACATGGGGGCGACCTA-3';FAdV-R:5'-TTGCCTGTGGCGAAAGGCG-3',引物扩增长度为2500 bp,由生工生物工程(上海)股份有限公司合成。采用核酸提取试剂盒对分离到的毒株进行核酸提取,具体操作步骤详见说明书。反应体系(50 μL)为:dNTP 4 μL,10×PCR Buffer 5 μL,上、下游引物各2.5 μL,Ex-TaqDNA 聚合酶0.5 μL,DNA5 μL。PCR反应条件为:94℃预变性5 min;94℃变性1 min,67℃退火1 min,72℃延伸3 min,共34个循环;72℃再延伸10 min。将PCR产物经1%琼脂糖凝胶电泳进行检测,将阳性PCR产物送北京华大基因测序公司进行测序。
1.4 病毒分离 临床样本处理按照如下方法进行,采集内脏剪碎后与无菌PBS等体积融合后研磨,收集研磨液于离心管中,10 000 ×g离心5 min,取上清液通过0.22 μm滤膜过滤,所得样本即为待分离样本。待LMH细胞长至75%~90%时,弃掉生长液,按培养液体积的1∶10接种待分离样本,置于37℃、5%CO2培养箱吸附2 h后,弃掉液体,立即加入2%胎牛血清的DMEM维持液继续培养2~5 d,每天观察细胞生长和病变(CPE)情况,若无CPE出现,则培养至第5 d后将细胞冻融3次后继续传代,传至6代仍无细胞病变则视为病毒样本阴性,若出现CPE则连续传3代,3代均有CPE的则视为有病毒,冻融3次后收获病毒,置-80℃条件下保存待鉴定。
1.5 FAdV-Ⅰ流行病学统计分析 对测序成功的1668份送检样品按照送检地区、发病月份、血清型和鸡群品种进行流行病学统计分析。
1.6 高致病性FAdV-4型hexon基因遗传进化分析 将本中心分离到的439株血清4型FAdV分离株全部进行hexon基因测序分析,并与国际上报道的高致病性FAdV-4进行核苷酸和氨基酸序列比对。本文引用的高致病性FAdV-4毒株主要包括:AH712(GenBank登录号:KY436522)、AHBZ(GenBank登录号:KU569295)、HB1510(GenBank登录号:KU587519)、HLJFAD15(GenBank登录号:KU991797)、HNJZ(GenBank登录号KU558760)、JSXZ(GenBank登录号:569296)、MX-SHP95(GenBank登录号:KP295475)、SD1511(GenBank登录号:MF496037)、SDDZ(GenBank登录号:KU558761)、SDSX1(GenBank登录号:KY636400)和SXCZ(GenBank登录号:KU558762)。
2 结果
2.1hexon基因PCR鉴定 采用引物FAdV-F/R对禽腺病毒疑似样品进行hexon基因扩增,共扩增到1668个基因片段,长度均在2500 bp左右,将基因片段进行测序,分析结果显示,基因片段全部为FAdV-Ⅰ中的hexon基因,具体结果见图1。

图1 FAdV疑似样品hexon基因PCR鉴定Fig.1 The PCR identification of hexon gene from FAdV suspected samples
2.2 病毒分离 将测序鉴定为FAdV-Ⅰ的样品处理后接种LMH细胞,部分样品接种3代后48 h可以出现明显的细胞病变,表现为LMH细胞变圆,折光度增强,贴壁性减弱,共得到703株可稳定传代的细胞分离株,而其余样品虽测序成功,但接种LMH细胞盲传6代后仍无细胞病变(图2)。
图2 LMH细胞接种结果Fig.2 LMH infection results
2.3 FAdV-Ⅰ流行病学统计分析 根据本中心的流行病学统计发现,2015年仅在14个省份出现禽腺病毒零星散发,2016年其传播范围已涵盖22个省,至2020年已在全国27个省出现大面积暴发;分析不同血清型的流行状况可见FAdV-4、FAdV-8a、FAdV-8b和FAdV-11一直占据主导地位,且其余血清型检出情况也在逐年增加;根据发病季节分析可见秋冬季节为该病的高发季节,推测与秋冬季节呼吸道疾病高发有关;2017年以前本中心未从水禽上检测到过该病,之后水禽检出率逐年增加,样品主要来自于商品代或父母代的樱桃谷鸭、番鸭、朗德鹅等的肝脏和肾脏,2017年至今hexon基因共测序成功151份,得到分离株23株,涵盖FAdV-1(4.3%)、FAdV-4(34.7%)、FAdV-8a(8.0%)、FAdV-8b(7.3%)、FAdV-10(21.7%)、FAdV-11(24%)六种血清型(图3)。
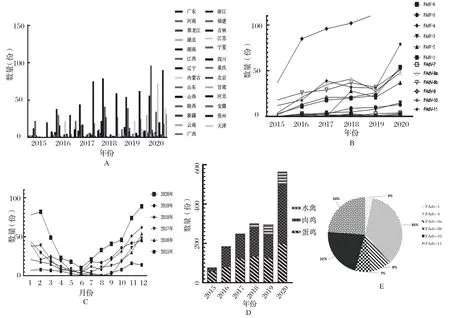
图3 近6年FAdV检出情况分析Fig.3 Analysis of FAdV detection in the past six years
2.4 高致病性FAdV-4型hexon基因遗传进化分析 通过与参考序列的同源性和遗传进化树比对分析发现,本中心的437株分离株与高致病性FAdV-4参考株在同一分支,2株分离株与ON1参考株在同一分支(图4)。其中HNJZ是高致病性FAdV-4的代表毒株,2015年分离于河南郑州,本中心分离的437株与其同源性在99.1%~100%;同样作为高致病性FAdV-4的代表毒株MX-SHP95株分离于2014年的墨西哥,本中心分离的437株与其同源性在98.9%~99.5%;ON1作为非致病性FAdV-4的代表毒株,本中心有2株分离株与其同源性在99.6%~100%。Hexon氨基酸与参考株相比已发生明显的变异,变异主要集中在166 bp~243 bp,主要位点包括188、193、195、238和240位氨基酸,具体氨基酸变异位点见表1。

图4 近6年FAdV-4分离株 hexon 基因的遗传进化树分析Fig.4 Evolutionary tree analysis of the hexon gene of FAdV-4 isolates in the past six years

表1 hexon基因的氨基酸变异位点Table 1 Amino acid variation site of hexon gene
3 讨论
血清4型禽腺病毒是心包积液综合征(hydropericardium syndrome,HPS)的病原,具有较高的致病率和死亡率,是家禽养殖的重要病因之一[11]。2015年以前,中国地区的禽腺病毒病患病率较低,只有部分养殖地区密集的地方出现零星散发,2015年以后,该病的感染呈现逐年增加的趋势,直至目前呈全国大面积流行的态势[12-13]。为了更好的研究禽腺病毒在我国的流行态势,本中心在近几年进行了不间断的监测和大数据分析,根据本中心的流行病学调查数据发现,其流行趋势由最初的少数血清型零星散发衍变成现在多种血清型同时大面积暴发,且出现同一机体混合感染多种血清型的感染模式。
根据本研究的流行病学调查发现,2017年以前未在水禽上检测到过禽腺病毒,但之后水禽源的检出率逐年增加,且通过hexon基因分析发现,绝大部分水禽上检测的禽腺病毒均属于Ⅰ群禽腺病毒,只有少部分测序结果显示为鸭腺病毒2型和鸭腺病毒3型,且鸭腺病毒和Ⅰ群禽腺病毒混合感染的情况居多。2020年有学者利用高致病性FAdV-4 HLJDAD15株者建立了一种特异性real-time PCR,检测鸭源感染的动态分布,研究发现HLJDAD15的致病性和复制模式在鸡和鸭之间完全不同。在鸡中可诱导产生严重的肝细胞损伤和10%的死亡率,而在鸭子中没有观察到临床症状,且鸡感染后5 d病毒滴度达到峰值,而鸭在感染后7 d和21 d出现两个病毒滴度峰值,且均低于鸡的感染模型,所以研究者推测鸭子可能是FAdV-4传播的中间宿主[14]。2018年也有学者采用高致病性FAdV-4 SD0828株进行鸡、鸭感染模式的研究,发现该病毒均可以在CEF和DEF中复制,但DEFS的复制率明显较低,说明CEF更有利于病毒生长,而且研究发现鸭感染FAdV-4后其促炎细胞因子(白细胞介素-6和-8)和干扰素刺激基因(MX和OAS)的mRNA表达水平明显上调,推测是这几种基因导致的该病感染率低[15]。
Zhang等[16]通过反向遗传技术将HLJFAD15株hexon基因进行改造,首次证实hexon基因的188位氨基酸可以决定禽腺病毒的致病性,若188位氨基酸为R(精氨酸),则该分离株为高致病性FAdV-4,以其感染鸡群可导致较高的死亡率;若11位氨基酸为I(异亮氨酸),则该分离株为非致病性FAdV-4,以其感染鸡群不会导致鸡只死亡。而Zhang等[17]通过同源基因重组和反向遗传技术将HNJZ和ON1的1996缺失片段、fiber2基因和hexon基因进行替换验证,发现1996缺失片段与致病性无太大关系,而fiber2基因在病毒感染和致死率中发挥重要作用,hexon基因的改变会导致致死率的改变。本研究通过与参考序列比对分析发现,有437株病毒hexon基因的188位氨基酸为R,其余2株的188位氨基酸为I,参考序列中高致病性FAdV-4hexon基因的188位氨基酸全部为R,低致病性FAdV-4代表毒株ON1其hexon基因的188位氨基酸为I。除此之外,本研究还发现,高致病性FAdV-4hexon基因的195位氨基酸为Q(谷氨酰胺),非致病性FAdV-4其hexon基因的195位氨基酸为E(谷氨酸)。
简言之,我们对血清4型在机体中的动态分布和致病机理未能充分理解,所以现有的市售疫苗并不能很好的控制该病的传播,相反该病的检出情况仍在逐年增加,目前禽腺病毒的基因工程疫苗还在研发阶段,关于影响其致病性的基因还存在争议,所以做好疾病监测预警和养殖场的生物安全工作是重中之重。

