猪圆环病毒3型Cap蛋白的原核表达
王帅勇,汪 琪,朱世强,姚 云,虞凌雪,刘晓敏,单同领,郑 浩,周艳君,童 武,李国新,高 飞,童光志,于 海
(中国农业科学院上海兽医研究所,上海 200241)
猪圆环病毒(Porcine circovirus,PCV)属于圆环病毒科圆环病毒属,是一种单股环状DNA病毒。之前的研究发现猪圆环病毒分为PCV1和PCV2两个基因型,PCV1是由Tischer等[1]在1974年发现并被认为是一种细胞污染物,对猪群没有致病性;PCV2最早是由Clark等[2]在1991年于加拿大被发现的,对猪群有较强的致病性。很多研究表明PCV2是猪圆环病毒相关疾病(porcine circovirus associated diseases,PCVAD)的主要病原,能够引起猪的多种疾病,主要包括:断奶仔猪多系统衰竭综合征(postweaning multisytemic wasting syndrome,PMWS)、猪皮炎与肾病综合征(porcine dermatitis and nephropathy syndrome,PDNS)、猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)以及仔猪震颤(congenital tremors,CT),给养猪业造成了非常严重的经济损失[3-4]。
2016年,Palinski等[5]首次在美国发现新的PCV基因型并命名为猪圆环病毒3型(Porcine circovirus type 3,PCV3),该病毒能够引起多种猪病,与PCVAD非常相似。PCV3的基因组全长为2000 bp,主要包括3个开放性阅读框(opening reading frame,ORF),其中ORF1主要编码Rep蛋白,与病毒的复制相关,ORF2主要编码Cap蛋白,该蛋白是病毒的唯一结构蛋白,与病毒的感染和免疫有较强的相关性。
目前为止,已经有多个国家都有关于PCV3的报道,包括中国、巴西、德国、意大利和俄罗斯等[6-10]。通过PCV3在中国不同地区流行情况的报道可以看出,PCV3已经广泛存在于中国的猪群当中,本实验室在之前的流行病学调查过程当中检测到了PCV3的阳性病料,通过测序获得了7株PCV3全长基因序列,本研究选取其中1株作为代表株,设计一对针对去核定位信号的ORF2特异性引物,成功扩增PCV3全长基因序列并将其连接到pCold TF载体上,构建了重组的原核表达质粒并对其进行了原核表达,获得了可溶性的重组蛋白并且对蛋白的抗原性进行了鉴定和分析,为进一步研究PCV3 Cap 蛋白的功能及建立间接ELISA检测方法奠定了基础,并为防控PCV3提供了特异、高效的检测工具。
1 材料与方法
1.1 载体、菌株 载体pCold TF由本实验室保存;大肠杆菌E.coliDH5α、表达宿主菌BL21(DE3)感受态细胞购自天根生化科技有限公司;IPTG购自Sigma公司;限制性内切酶XhoⅠ和SaIⅠ、病毒DNA提取试剂盒和质粒提取试剂盒购自大连宝生物工程有限公司;pfu高保真DNA聚合酶购自Agilent Technologies公司;引物由金唯智生物公司合成;辣根酶标记山羊抗小鼠IgG购自CST公司;DAB显色试剂盒购自北京索莱宝科技有限公司。
1.2 引物的设计与合成 应用Primer premier5.0软件,根据实验室之前在检测病料过程中通过测序获得的1株PCV3全基因组序列设计1对去掉Cap蛋白N端核定位信号(34个氨基酸)的特异性引物,分析pCold TF载体质粒图谱,分别在引物的上、下游加入XhoⅠ和SaIⅠ酶切位点和保护性碱基(划线的碱基)。上游引物:5'-CCGCTCGAGATGAGACACA GAGCTATATA-3';下游引物:5'-ACGCGTCGAC TTAGAGAACGGACTTGTAA-3'。
1.3 病毒DNA的提取及目的基因的PCR扩增 取实验室检测为阳性的病料进行研磨,将研磨液10 000 ×g离心10 min,将离心后的上清液按照DNA提取试剂盒说明书提取病毒DNA全基因组,并以此为模板,通过PCR进行Cap目的基因片段的扩增。PCR反应体系为:ddH2O 37 μL,10×pfu Ultra ⅡRxn Buffer 5 μL,上、下游引物各2 μL,dNTP 1 μL,DNA 2 μL,pfu Ultra Ⅱ Fusion Hs DNA 1 μL,总体积为50 μL。将上述PCR反应体系进行震荡混匀后离心,反应程序为:95℃预变性1 min;95℃变性20 s,55℃退火20 s,72℃延伸1 min,共30个循环;72℃再延伸10 min。扩增后的核酸产物经1%琼脂糖凝胶电泳鉴定,切胶进行胶回收。
1.4 重组表达质粒的构建与鉴定 将胶回收产物同pCold TF空载体经限制性内切酶XhoⅠ和SaIⅠ双酶切5 h,胶回收Cap和载体的目的片段,用T4 DNA连接酶16℃过夜连接,将连接产物转化至大肠杆菌DH5α感受态细胞中,挑取单个菌落在水平摇床上培养16 h,菌液PCR鉴定后,将阳性菌液送生工生物工程(上海)股份有限公司测序。将测序正确的阳性菌液扩增,提取质粒,获得的阳性重组表达质粒命名为pCold TF-dPCV3Cap。
1.5 重组蛋白的诱导表达及SDS-PAGE分析 将重组表达质粒pCold TF-PCV3-dCap转化到表达宿主菌BL21(DE3)感受态细胞中,挑取单菌落在水平摇床上进行增菌培养;当菌液浓度活化至OD600值达0.7左右,按照1∶1000比例加入终浓度为1 mol/mL的IPTG;将菌液转入水平摇床上分别诱导12、16、20和24 h后收集菌液,10 000 ×g离心10 min取上清液,用适量PBS重悬沉淀并取出适量重悬液与SDSPAGE缓冲上样液充分混匀,沸水浴10 min。经过SDS-PAGE电泳分析,确定IPTG的最佳诱导时间。
1.6 重组蛋白的可溶性分析 收集诱导后的菌液,10 000 ×g离心10 min,用适量PBS重悬后在冰浴中进行超声波破碎,每次超声5 s,间隔5 s,破碎至菌液澄清。将破碎后的菌液10 000 ×g离心10 min后,分别收集上清液和沉淀。在沉淀中加入与上清液等体积的PBS重悬,然后取出适量重悬液与SDSPAGE缓冲上样液充分混匀,沸水浴10 min,进行SDS-PAGE电泳分析。
1.7 重组蛋白的纯化 大量诱导表达重组蛋白,收集菌液,10 000 ×g离心10 min,用适量PBS重悬后在冰浴中进行超声波破碎并收集上清液,按照磁珠蛋白纯化说明书进行纯化,用SDS-PAGE来检测蛋白纯度。
1.8 重组蛋白的Western blot鉴定 将纯化后的重组蛋白经SDS-PAGE蛋白电泳,转印到硝酸纤维素(NC)膜,用5%脱脂奶粉封闭1 h,用小鼠阳性血清作为一抗(1∶5000稀释),在4℃摇床上孵育过夜,用TBST漂洗3次,每次10 min;以辣根过氧化物酶标记山羊抗小鼠lgG为二抗(1∶5000稀释),常温孵育1 h,TBST漂洗3次,每次10 min,最后应用DAB显色液进行显色反应。
2 结果
2.1 目的基因的扩增 用设计的特异性引物扩增Cap蛋白的基因片段,命名为PCV3-dCap,经1%琼脂糖凝胶电泳后获得与预期大小相符的目的条带(图1)。

图1 PCV3-dCap基因PCR扩增产物Fig.1 The PCR products of PCV3-dCap gene
2.2 重组质粒pCold TF-PCV3-dCap的构建及鉴定 将扩增的目的片段与pCold TF载体连接后,通过PCR方法进行菌液鉴定及阳性重组质粒的序列测序。测序结果显示,PCV3-dCap片段成功连接到pCold TF载体上,并且没有出现碱基突变和缺失,将获得的重组质粒命名为pCold TF-PCV3-dCap。
2.3 重组蛋白的诱导表达及SDS-PAGE分析 通过IPTG诱导表达后收集到大量菌液,取超声破碎和离心后的上清液及沉淀进行SDS-PAGE鉴定。结果显示,重组蛋白能够在上清液中大量表达,大小为75 kDa,与预期一致(图2)。同时将通过不同诱导时间的上清液进行SDS-PAGE分析,发现在诱导时间为20 h时,重组蛋白的表达量最大。
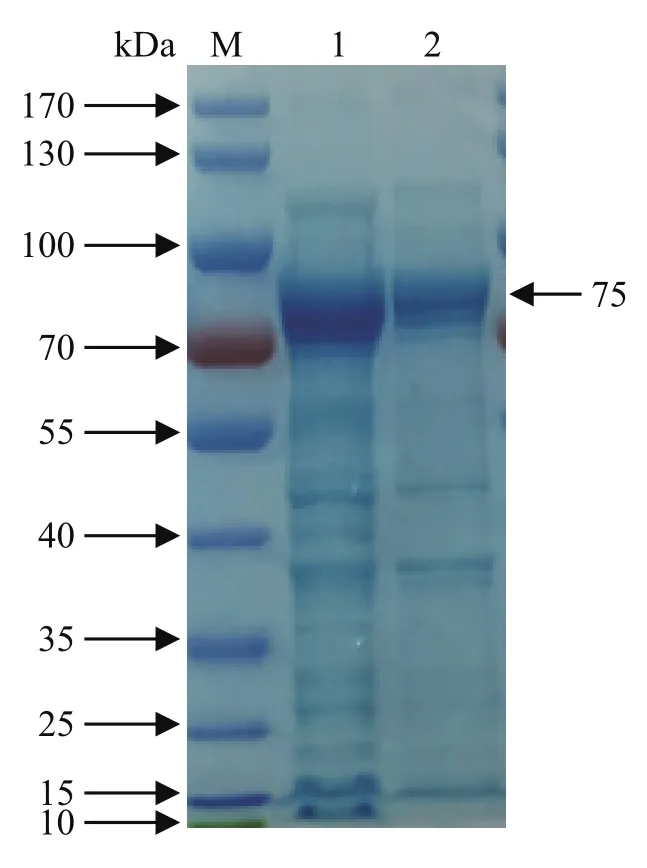
图2 重组蛋白表达可溶 性分析Fig.2 Soluble analysis of recombinant pCold TF-PCV3-dCap protein by SDS-PAGE
2.4 重组蛋白的纯化 在最佳诱导条件下,大量诱导表达重组蛋白,收集菌液后进行超声破碎和离心,将上清液按照磁珠蛋白纯化盒的说明进行纯化,经SDS-PAGE鉴定,目的蛋白纯度较高且单一(图3)。
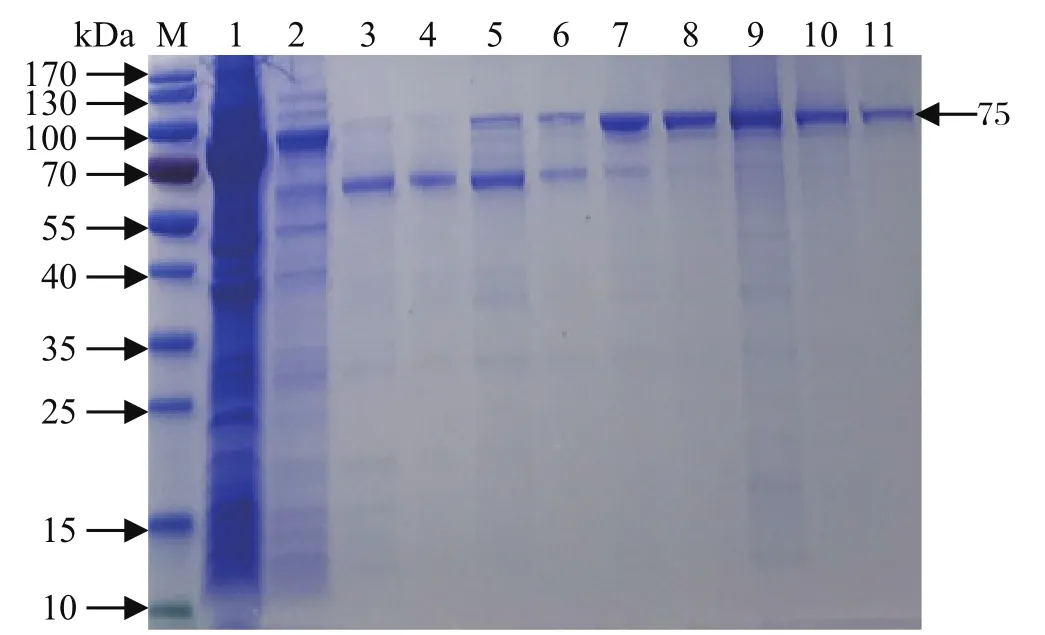
图3 重组蛋白的纯化Fig.3 The purification of recombinant protein
2.5 重组蛋白的Western blot鉴定 以阴性小鼠血清作为一抗来进行Western blot实验。结果显示,重组蛋白和诱导空载体表达的蛋白在目的条带位置均没有出现任何条带(图4A)。同时,以阳性小鼠血清作为一抗来进行Western blot实验,结果显示重组蛋白在目标条带位置有明显的条带,而诱导空载体所表达的蛋白在目标条带处没有条带(图4B),表明pCold TF-dPCV3-Cap重组蛋白具有良好的反应原性和特异性。

图4 重组蛋白的Western blot分析Fig.4 Western blot analysis of the recombinant protein
3 讨论
自2016年首次发现PCV3以来,世界各地均有发现PCV3的相关报道,由于PCV容易与多种猪源性病原体发生混合感染[4],导致猪的多种疾病,给养猪业带来了巨大的经济损失。PCV感染细胞后不发生细胞病变,截止目前,世界范围内还没有成功分离到PCV3野毒株。目前已有多篇报道表明存在PCV2和PCV3共感染的情况[11],因此建立针对PCV3的特异性检测方法非常重要。当前针对于PCV的主要防控方式是疫苗接种,因此反应原性和特异性较好的原核表达蛋白对于亚单位疫苗的研发也具有重要的意义[12]。Cap蛋白是PCV唯一的结构蛋白,主要与病毒的感染复制有关,同时也是检测PCV的主要指标,目前已经有研究表明,PCV2和PCV3的Cap基因同源性很低,两者之间无法提供交叉保护[13-14]。因此对于PCV3的Cap蛋白的研究具有重要的意义[15]。
本研究通过原核表达方式所获得的PCV3-dCap蛋白主要在上清液中表达,在表达过程中无需处理包涵体,这为大量表达该蛋白带来了很大的便利,同时本研究所采用的磁珠纯化蛋白的方式较为简单,可操作性强,在大量纯化蛋白时能够极大的提高纯化效率。使用纯化后的重组蛋白免疫小鼠,得到的阳性小鼠血清能够与重组蛋白发生特异性反应,证明了该蛋白具有良好的免疫原性。本研究原核表达的重组蛋白为建立PCV3抗体特异性检测方法和亚单位疫苗的研发奠定了良好的基础。

