在四环素调控系统下表达HA蛋白MDCK细胞系的建立
于海龙,许榜丰,石晓娜,马天馨,闫婉婉,李雪松,杨健美,滕巧泱,刘芹防,苑纯秀,赵权,李泽君
(1.吉林农业大学动物科学技术学院,长春 130118;2.中国农业科学院上海兽医研究所,上海 200241)
H9N2亚型禽流感是由流感病毒(Avian influenza virus,AIV)引起的一种急性、高度接触性传染病,不仅给养禽业造成巨大经济损失,而且还可能突破物种屏障直接感染人,危及人类健康[1-2]。目前,鸡胚扩增流感病毒生产疫苗是防控H9N2亚型禽流感病毒的最有效方式[3],但用后的鸡胚残体处理需要额外的人力物力,处理不当还会污染环境。而且在短时间内需要大量病毒时,如在流感病毒大规模暴发期间,鸡胚扩增病毒无法满足快速生产需要。因此构建适宜流感病毒大量扩增的细胞系是当前流感疫苗研发需要加快解决的问题。
血凝素蛋白(Hemagglutinin,HA)是流感病毒的主要免疫蛋白,HA蛋白裂解为HA1和HA2是病毒入侵宿主细胞的前提[4]。低致病性禽流感病毒的HA裂解位点处只含有一个碱性氨基酸,只能被呼吸道和肠道所分泌的胰蛋白酶识别并裂解[5]。在细胞中培养时需使用TPCK胰酶和无血清培养液,生产成本高。高致病性禽流感病毒HA裂解位点处含有多个碱性氨基酸,能被宿主细胞内普遍存在的蛋白酶识别并裂解,在细胞中培养时无需额外添加辅助试剂。本研究构建了稳定表达突变为强毒裂解位点的H9 HA蛋白的MDCK细胞系,提供能有效支持H9N2流感病毒扩增的系统,为高效低成本生产流感疫苗提供保障。为了避免HA2蛋白的持续裂解导致细胞间相互吸附而影响细胞增殖,本研究将HA基因插入四环素调控系统中Tet-on系统调控元件与反应元件的中间,在细胞增殖达到要求时再添加强力霉素(doxycycline hydrochloride,DOX)诱导HA基因的表达[6]。
1 材料和方法
1.1 病毒、质粒、细胞 H9N2亚型禽流感病毒 A/Chicken/Shanghai/441/2009(简称为441株)、PR8 SH441病毒是由本实验室通过反向遗传技术拯救所得,以A/PR/8/34(H1N1)为背景,将HA和NA基因替换成SH441病毒的HA和NA基因的重组病毒、293T细胞及MDCK细胞、质粒V2-H9(以lentiCRISPRV2为载体,H9 HA裂解位点上游的1个碱性氨基酸突变为4个碱性氨基酸后插入到四环素调控系统中Tet-on系统的反应元件与调控元件之间,由此构建了重组质粒V2-H9)、质粒psPAX2、质粒pMDSV均由上海兽医研究所动物流感及禽新发病毒病病原生态学创新团队保存。
1.2 主要实验试剂 质粒提取试剂盒购自 QIAGEN 公司;DMEM 培养基购自 Hyclone 公司;胎牛血清(FBS)购自 Biosun 公司;无血清培养液opti-MEM购自 Gibco公司;HRP标记的羊抗鼠IgG和FITC标记山羊抗鼠IgG购自Thermo Fisher 公司;鼠抗H9单克隆抗体4B7由本实验室制备储存,转染试剂由实验室制备;Doxycycline、牛血清蛋白(BSA)、细胞摇瓶、MDCK悬浮培养液购自上海源叶生物科技有限公司;SDS-PAGE蛋白上样缓冲液(5×)、SDSPAGE凝胶配制试剂盒购自 Beyotime 公司。
1.3 逆转录病毒颗粒的制备 在T75细胞培养瓶中均匀铺293T细 胞,待细胞长至80%时用于转染,将V2-H9与提供几个相关蛋白来完成拟病毒粒子功能的辅助质粒psPAX2、pMDSV分别按照10 μg、5 μg、5 μg的量加入250 μL无血清opti-MEM培养液后,加入转染试剂20 μL,混匀,室温静置30 min,在此期间,用无菌PBS缓冲液洗涤293T细胞两次后每瓶加入5 mL opti-MEM无血清培养液,最后将质粒混合物置于细胞培养瓶中,再转入37℃、5%CO2培养箱中进行培养,4 h后换成2% FBS DMEM培养液,72 h后收集含有逆转录病毒颗粒的细胞上清液。
1.4 表达HA蛋白MDCK单克隆细胞的筛选 用收集的逆转录病毒上清液感染MDCK细胞,24 h后消化MDCK细胞,形成单细胞悬液后,均分在 20 个含5 μg/mL嘌呤霉素和10%FBS的DMEM培养液的细胞培养皿(10×20 mm)中筛选阳性细胞,每隔72 h更换一次含有嘌呤霉素和10%FBS的DMEM培养液。当单个细胞长成细胞群落时,将无菌玻璃管罩在细胞集落上,使玻璃管与平皿完全密封,用PBS洗3遍后,加入200 μL胰酶消化细胞,消化后将细胞移至48孔板扩大培养。
1.5 病毒HA效价的测定 将筛选出的MDCK细胞铺至细胞瓶中,每株MDCK细胞均匀铺3瓶T25细胞瓶,并加入DOX进行诱导,同时设立正常MDCK细胞作对照,待细胞长满细胞瓶,拿出1瓶细胞消化记数,剩余两瓶用作后续实验,PR8 SH441病毒按照0.1个MOI的感染剂量接种至T25细胞瓶中,在细胞培养箱中感作2 h,每隔20 min左右取出细胞瓶缓慢摇晃2次,2 h后用无菌PBS清洗细胞瓶底部,洗去未结合细胞的病毒,然后加入2%FBS培养液维持细胞生长,48 h后收取细胞上清液测血凝价。血凝板中每一行测一个毒的效价,血凝板中先加入50 μL的无菌PBS,然后在每行第一个孔中加入50 μL收集的上清液,用50 μL排枪倍比稀释至第12个孔,然后在每孔中加入50 μL 1%的鸡红细胞,室温静置30 min后读数。
1.6 病毒在MDCK细胞系上的生长曲线 将HA效价最高的两株MDCK细胞铺至T25细胞瓶中,加入DOX诱导,同时设立正常MDCK细胞作对照,将病毒按照0.1个MOI的感染剂量接种至T25细胞瓶中,在细胞培养箱中感作2 h,每隔20 min左右取出细胞瓶缓慢摇晃2次,2 h后用无菌PBS清洗细胞瓶底部,洗去未结合细胞的病毒,加入2%FBS的DMEM培养基维持细胞生长,分别在接种后12、24、48、72 h收取细胞上清液各两管,每管100 μL,-80℃储存备用。同时补加100 μL的2%FBS的DMEM培养液,最后按照测定TCID50的方法测定上清液中各个时间点的病毒滴度(TCID50/mL),并绘制病毒在筛选到的MDCK细胞上的生长曲线。
1.7 间接免疫荧光(Indirect fluorescence assay,IFA)鉴定 将第34株MDCK单克隆细胞铺至48孔板,实验组加入DOX诱导HA蛋白的表达,同时设立不加DOX诱导为对照组,24 h后弃掉培养液,加入4%多聚甲醛室温固定15 min后,加入0.5%Triton通透15 min,然后用1%BSA 37℃封闭30 min后,加入1∶100稀释的单克隆抗体4B7后置于4℃过夜,37℃下作用90 min,PBS洗3遍后加入1∶200稀释的FITC标记的羊抗鼠lgG为二抗,37℃作用1 h后,PBS洗4次,放置荧光显微镜下观察。
1.8 Western blot鉴定 将第34株MDCK单克隆细胞铺至6孔板中,实验组加入DOX诱导HA蛋白的表达,不加入DOX为对照组,24 h后加入200 μL 1×SDS上样缓冲液裂解细胞,裂解产物置于95℃金属浴中变性10 min,配制10孔1.0 mm的10%下层蛋白胶和上层蛋白胶,配置好后每孔加入20 μL的样品,将电压调至60 V跑上层胶,120 V跑下层胶,约1 h后,在250 mA转膜90 min后,用5%脱脂乳室温封闭50 min,封闭结束后加入1∶100稀释的单克隆抗体后置于4B7 4℃过夜,用PBST洗4遍后,以1∶5000 HRP标记的羊抗鼠lgG为二抗,室温作用45 min后,用PBST洗4遍,用ECL显色液在显色仪上曝光并拍照。
1.9 第34株MDCK单克隆细胞低血清驯化以及悬浮培养 将第34株MDCK单克隆细胞采用逐级递减血清的方法,培养液中的血清浓度逐级递减,总共分为4个阶段,每个阶段以血清含量为界,按照血清含量梯度设计为:10%、8%、5%、2% 4个阶段,待MDCK单克隆细胞在每个阶段血清浓度中生长稳定后方可传入下一阶段,直至该细胞可以在2%FBS培养液中稳定生长。将在2%FBS培养基中生长稳定的细胞用胰酶消化后,置于离心机中将细胞离心至离心管底部,然后用无血清培养液吹散细胞,吸取全部的细胞转移至250 mL细胞摇瓶中,补加MDCK无血清培养液至100 mL,然后将细胞摇瓶放入5%CO2、37℃恒温摇床中悬浮培养,每隔24 h进行半换液(即取出50 mL细胞液,细胞离心后加入50 mL MDCK无血清培养液),以此来保证细胞的营养供给,并记录细胞密度。
1.10 第34株MDCK悬浮细胞接毒 第34株MDCK悬浮细胞密度为1×106个/mL时加入30 mL DOX诱导HA蛋白的表达,24 h后按照0.1个MOI的感染剂量接毒PR8 SH441,48 h后收取细胞上清液测血凝价,做两组重复。
2 结果
2.1 HA效价的测定 将筛选到的42株MDCK细胞系以0.1个MOI的感染剂量接毒PR8 SH441,每株细胞做一组平行重复,感染48 h后,收集细胞上清液,然后用1%的鸡红细胞测定病毒的HA效价(图1)。结果显示:对照组MDCK细胞HA效价为3log2,而插入H9 HA的MDCK细胞HA效价达到6log2及以上的有13株,其中第19株和第34株MDCK细胞的HA效价可接近于8 log2。
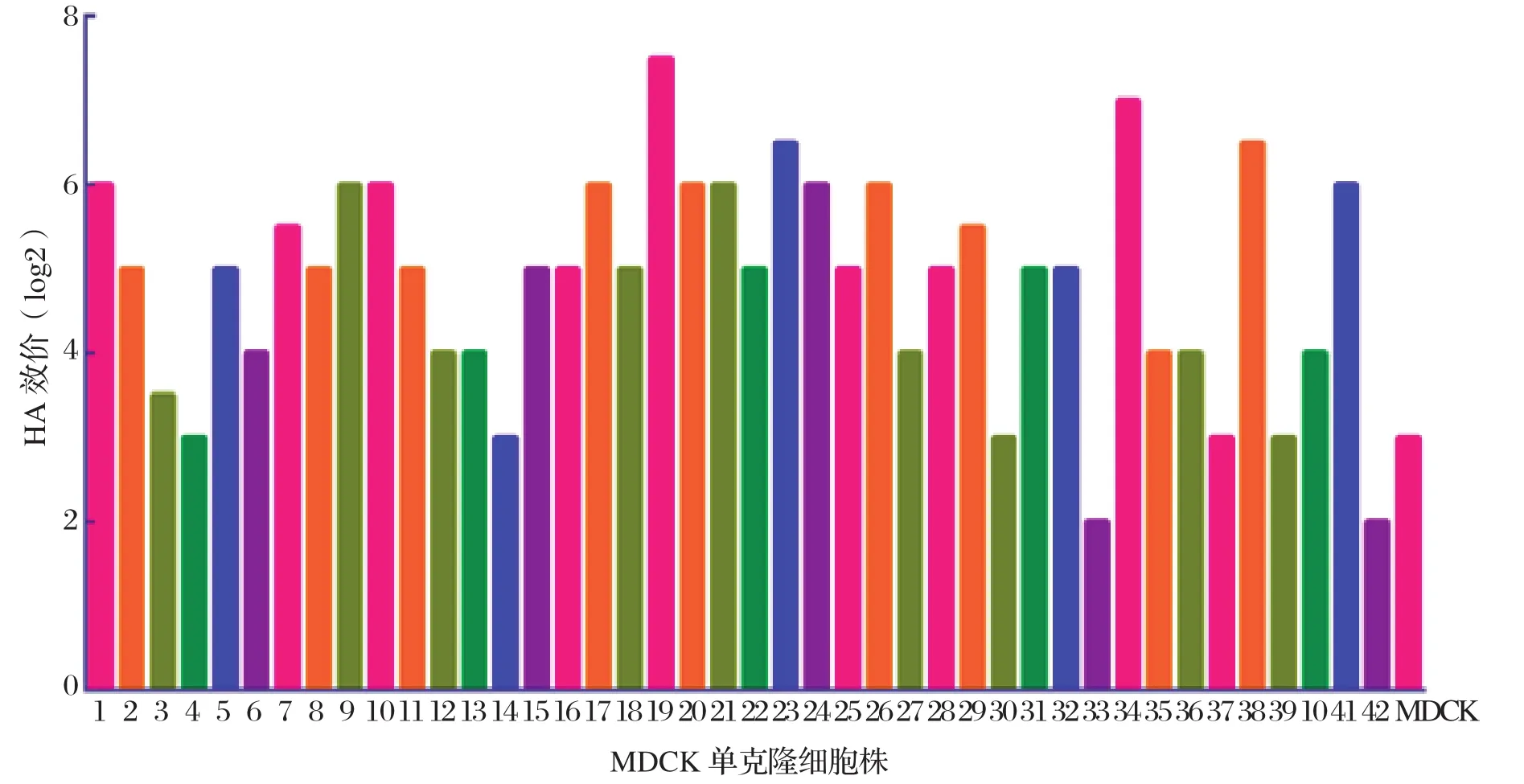
图1 PR8 SH441病毒在MDCK细胞系中的复制滴度Fig.1 Replication of PR8 SH441 virus in MDCK cell lines
2.2 PR8 SH441病毒在MDCK单克隆细胞上的生长曲线 PR8 SH441病毒以0.1个MOI的剂量感染筛选出的第19株和第34株MDCK细胞,并且以正常MDCK作对照,在感染后12、24、48、72 h后收集细胞上清液,并且每株细胞做一组平行重复,然后应用流感病毒TCID50测定病毒滴度,绘制出PR8 SH441病毒在MDCK细胞中的生长曲线(图2)。结果显示:第34株MDCK单克隆细胞更有利于病毒的复制。
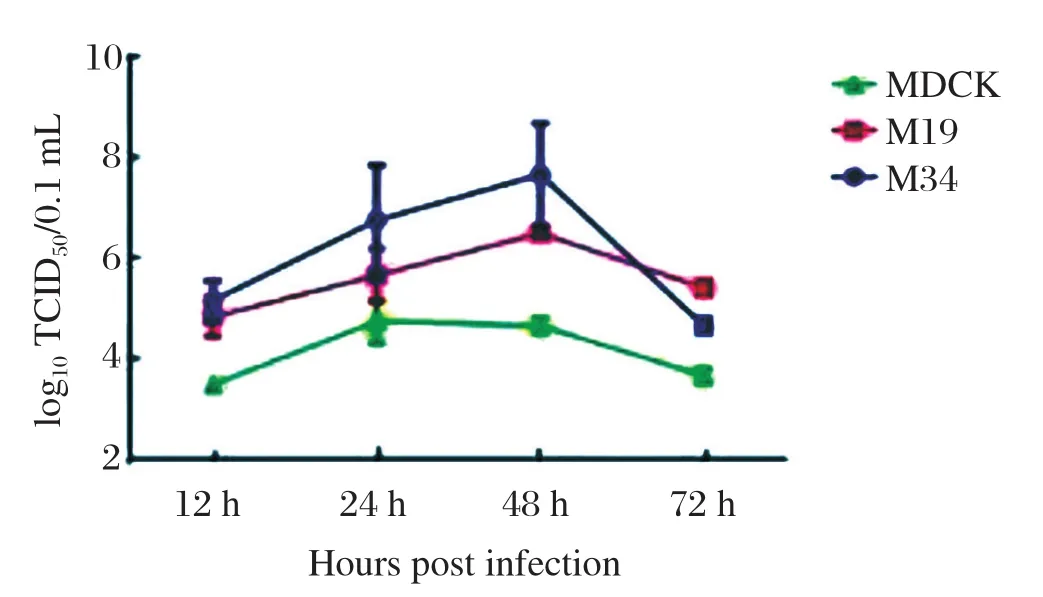
图2 PR8 SH441病毒在MDCK细胞系上的生长曲线Fig.2 Growth curve of PR8 SH441 virus in MDCK cell lines
2.3 IFA鉴定 结果显示:表达H9 HA的第34株MDCK单克隆细胞在细胞膜上显示特异性荧光,而对照组中无绿色荧光(见图3),证明H9 HA已经成功在MDCK细胞中定位表达并定位在细胞膜上。

图3 表达HA基因的第34株MDCK单克隆细胞的IFA鉴定结果Fig.3 IFA analysis of HA gene expression in 34th MDCK monoclonal cell
2.4 Western blot鉴定 表达H9 HA的第34株MDCK单克隆细胞样品呈现出一条特异性条带,分子量大小为76 KDa,与HA的分子量相符合,而对照组MDCK细胞样品中无HA蛋白大小的特异性条带,GAPDH作为内参,分子量大小为36 KDa(图4)。
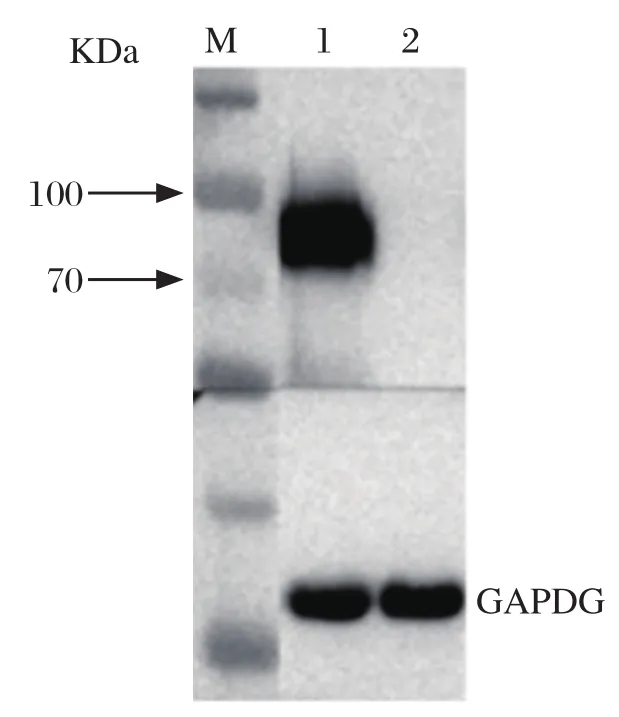
图4 表达HA基因的第34株MDCK单克隆细胞Western blot检测结果Fig.4 Western blot analysis of HA gene expression in 34th MDCK monoclonal cell
2.5 第34株MDCK单细胞的悬浮培养 将第34株MDCK单克隆细胞置于5%CO2、37℃恒温摇床中悬浮培养,每隔24 h记录细胞密度(图5)。结果显示,第34株MDCK单克隆细胞可以在无血清培养基中悬浮培养。

图5 第34株MDCK单克隆细胞的悬浮培养Fig.5 Suspension culture of the 34th MDCK monoclonal cell
2.6 PR8 SH441病毒在第34株MDCK悬浮细胞HA效价的测定 在感染病毒PR8 SH441 48 h后,收集细胞上清液,然后用1%的鸡红细胞测定病毒的HA效价,PR8 SH441病毒在第34株MDCK悬浮细胞HA效价可达到9log2(图6)。

图6 PR8 SH441病毒在第34株MDCK悬浮细胞中的复制滴度Fig.6 The replication titer of PR8 SH441 virus in the 34th MDCK suspension cell
3 讨论
疫苗对于流感病毒的防控依旧是目前最直接、最有效的手段[7]。禽流感疫苗的传统生产工艺是将禽流感病毒接种 SPF 鸡胚,收获尿囊液获得。但是鸡胚衍生疫苗的生产无法满足大规模需求,同时鸡胚用后的处理也会给环境造成压力,因此,促使人们将目光聚焦在以细胞基质生产流感疫苗的方式上,而MDCK细胞是公认的制备流感疫苗最有前景的细胞[8-9]。
慢病毒载体在细胞和基因治疗中应用十分广泛,是一种十分强大的遗传工具。受感染细胞产生的后代将携带相同的转基因,高滴度的慢病毒颗粒需要合适的细胞来生产。通常,选择的细胞是人胚胎肾细胞293(HEK-293),特别是衍生的293T细胞。293T细胞不仅增殖速度快,转染效率高,而且它还被证实能提高慢病毒的滴度。由于慢病毒感染的方式是将外源基因随机插入到细胞基因组中,由于插入位置的不确定性,所以病毒在每株MDCK细胞上形成的HA效价存在差异。本研究通过慢病毒感染的方式将H9 HA插入MDCK细胞中,通过血凝试验和病毒生长曲线发现:在筛选到的42株MDCK细胞系中,第34株MDCK单克隆细胞株最有利于流感病毒的复制。
继续将第34株MDCK单克隆细胞进行悬浮培养以用于后续疫苗的生产。近年来,应用全悬浮细胞培养技术增殖培养病毒已广泛应用于生物制药行业。与传统贴壁培养技术相比,应用细胞系悬浮培养生产工艺有着巨大的优势。一方面,可大大增加单位体积的细胞密度,提高病毒滴度;另一方面,培养条件安全可控,全封闭、管道化系统生产不仅降低了污染几率,而且减轻了劳动强度,提高了生产效率;第三方面,技术成熟,产量和质量均可显著提高。
综上所述,本研究筛选出42株可控表达H9 HA蛋白的MDCK细胞系,通过血凝试验和生长曲线发现第34株MDCK单克隆细胞最适合流感病毒的复制,并将该细胞株驯化后悬浮培养,可为细胞基质生产流感疫苗提供高效的细胞系。

