典型农田土壤酶活性分布特征及影响因素分析
李欣 ,陈小华,顾海蓉,钱晓雍*,沈根祥*,赵庆节,白玉杰
1. 华东理工大学资源与环境工程学院,上海 200237;2. 上海市环境科学研究院,上海 200233
上海地处长江三角洲前缘,不仅是中国经济最发达的地区之一,也是都市现代农业全国领先的城市(陈林生等,2019)。但是,快速城市化、人口激增等,正在将粮食生产地区推向外围(Liu et al.,2015);高度集约化的农业生产导致的耕地健康问题也对粮食作物生产的可持续增长造成巨大障碍(Chang et al.,2021)。农田生态系统生产力的可持续性高度依赖于土壤特性的维护,而土壤微生物在有机质分解和养分循环中发挥主要作用,土壤的发育、生产力和养分平衡可能取决于土壤微生物区系组成和微生物活性(Salazar et al.,2011)。土壤酶主要来源于土壤微生物、动植物残体的腐烂、动物的渗出物和植物根系分泌物(Pausch et al.,2018),是各种生化过程、养分循环的活性成分,负责加速与养分循环和反应催化相关的多个过程(Xu et al.,2021)。土壤酶活性对于农田的管理利用方式、土壤养分特征高度敏感(Li et al.,2019),因而土壤酶活性作为反映土壤健康状况变化的敏感因子已受到国内外学者的广泛重视(Nanbeh et al.,2019;贡璐等,2015)。
目前,关于农田利用方式对土壤酶活性的影响研究已有很多。胡尧等(2018)认为相较于次生林、人工林、灌草丛,坡耕地的土壤蔗糖酶、脱氢酶、脲酶、酸性磷酸酶活性更低;张静等(2013)研究表明华南地区赤红壤中土壤酶活性分布特征排序为果园>灌木林和桉树林>新垦旱地;与荒地相比,江西红壤农田茶树园、柑橘园和花生地的土壤FDA水解酶活性、脱氢酶活性均呈上升趋势(周际海等,2020)。可见,由于土壤内部的自然变异性,用一种土壤得到的研究结果难以完全推广应用到其他土壤(Floch et al.,2009),且众多研究表明气候参数、土壤盐度、碱度以及相关理化特性均会对土壤酶活性产生影响;Gomez et al.(2020)发现土壤性质和气候参数通过决定土壤水分有效性和温度进而影响土壤酶活性;Singh(2016)的研究结果显示土壤盐度和碱度都会对微生物群落(结构、功能和多样性)产生不利影响,导致土壤酶活性降低;Bai et al.(2018)研究表明土壤酶活性与土壤有机碳、全氮和磷含量呈显著正相关。然而,针对不同农田利用方式研究土壤酶活性分布特征及其与生物和非生物因子间响应关系的研究则尚不多见。
因此,为评估不同农田利用方式对土壤酶活性的影响,本研究以上海地区果园、蔬菜大棚、水田为研究对象,研究其土壤酶活性的分布特征及关键影响因素,并从农田利用方式出发,分析人地关系的复杂性,进而为上海合理规划农田,有效利用养分,促进农业可持续发展提供理论依据。
1 材料与方法
1.1 研究区概况
研究区位于上海市(30°40′—31°53′N,120°52′—122°12′E),地处长江三角洲的前缘,区域内土壤以江海相成土母质发育而来的黄棕壤为主(图1),水热条件优越,自然肥力较高。农田利用以果园、蔬菜大棚、水田3种类型为主,年均气温17.7 ℃,年平均蒸散量 1129.6 mm,年均降雨量达 1407.9 mm,全年60%雨量集中于5—9月,属于亚热带季风气候。
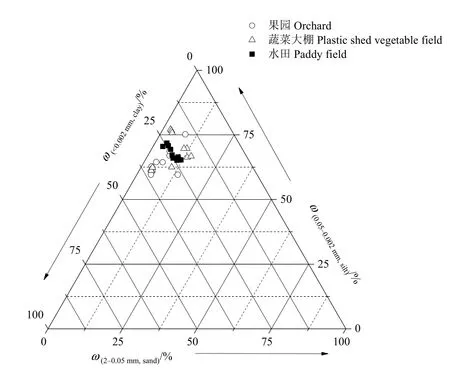
图1 典型农田土壤质地三角图Fig. 1 Texture triangles of typical agricultural soils
1.2 样地设置与取样
于2020年10—12月(作物收获之后),在上海市选取了果园(主要种植类型为葡萄)、蔬菜大棚(主要种植类型为鸡毛菜)、水田(主要种植类型为水稻)3类典型农田,共计10块样地,每块样地采集3个样本。采样区的田间管理基本情况见表1。采样点主要依据农田面积大小、种植品种设置,使用标准取土钻(直径5 cm)在每个样地对角线选取3点,每点采用梅花布点取5个深度为0—20 cm的非根际土壤,混合均匀并除去较大的动植物残体等杂质,分成两份,每份约 500 g。一份土样封于聚乙烯袋中,经自然条件风干、研磨、过筛,用于土壤理化性质和酶活性分析;另一份土样保存在4 ℃条件下,用于微生物群落多样性的测定。
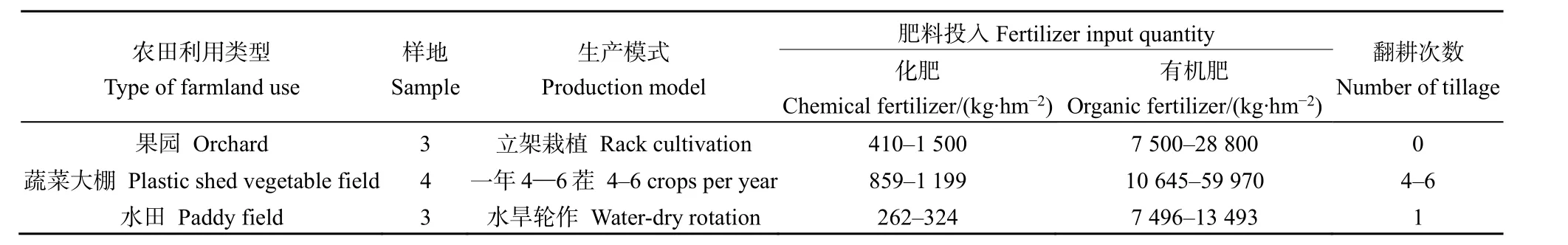
表1 典型农田2020年田间管理情况Table 1 Field management of typical farmlands in 2020
1.3 指标测定
1.3.1 理化指标
土壤基本理化性质测定参照《土壤农业化学分析方法》(鲁如坤,2000):pH 值采用电极电位法测定(1∶2.5土水比浸提液);有机质采用油浴加热-铬酸钾容量法测定;阳离子交换量采用乙酸铵交换法测定;土壤全盐量采用电导法测定;全磷采用钼锑抗比色法测定;有效磷采用碳酸氢钠浸提-钼锑抗比色法测定;土壤全氮采用半微量开氏法测定;水解性氮采用碱解扩散法测定;全钾采用火焰原子吸收分光光度计法测定;速效钾采用电感耦合等离子体发射光谱法(ICP-OES)测定;土壤机械组成采用密度计测定。
1.3.2 酶活性及生物指标
酶活性指标主要选取过氧化氢酶活性(S-CAT)、脲酶活性(S-UE)、水解酶活性(FDA)、中性磷酸酶活性(S-NP)四项指标(关松荫,1986),具体测定方法如下:脲酶活性采用南京建成生物工程研究所提供的试剂盒测定,其余酶的活性均采用Sinobestbio生产的试剂盒进行测定。S-CAT活性以每天每克风干土样催化1 μmol H2O2降解为1个酶活定义,FDA活性以每克土样每天产生1 μmol荧光素的量为1个酶活定义,S-NP活性以37 ℃下每克土样每天释放1 nmol酚为1个酶活定义,S-UE活性以每天每克土样中产生1 μg NH3-N为1个酶活定义。
土壤生物学特性主要选取土壤呼吸通量(SR)和孔的平均颜色变化率(Average well color development,AWCD)。前者使用LI-8100土壤CO2通量自动测量系统(LI-COR,Lincoln,NE,USA)测定土壤呼吸,每个样地选取2个样方进行现场测定(朱英等,2015)。后者采用 Biolog生态板(EcoPLATETM,Cat.No.1506)测定土壤微生物代谢活性,最终选取48 h的数据计算AWCD指标。
1.3.3 数据处理与统计方法
运用Excel 2019、IBM SPSS Statistics 26进行数据统计,采用单因素方差分析(One-way ANOVA),Duncan多重比较检验不同类型农田的土壤酶活性、理化性质和生物因子的显著差异性(P<0.05)。所有原始数据进行对数转换,在Canoco 4.5中以土壤酶活性为响应变量,土壤环境因子为解释变量进行冗余分析(Redundancy analysis,RDA)。运用Origin 2018软件作图。
2 结果与分析
2.1 土壤酶活性-土壤环境因子对不同农田利用方式的响应
2.1.1 3种类型农田的酶活性差异性分析
研究区不同利用方式下土壤酶活性的差异性分析如图 2所示,S-CAT活性整体偏低,平均为9.36—13.3 U·g−1,分布特征为蔬菜大棚<果园<水田,其中蔬菜大棚与果园、水田有显著性差异(P<0.05)。S-UE 活性在 966.07—1300.42 U·g−1范围内,分布特征为蔬菜大棚<水田<果园,与S-CAT差异性特征基本一致。FDA活性变化范围为435.04—542.18 U·g−1,3种耕作方式的酶活性接近无明显差异(P>0.05)。S-NP活性平均值为2295.70—7848.67 U·g−1,分布特征为水田<蔬菜大棚<果园,除平均值最低的水田外,其他两类酶活性之间无显著性差异(P>0.05)。4种土壤酶的变异系数依次为25.31%、19.13%、28.19%、48.16%,均大于16%,前3种酶属于中等变异,其中S-NP为强变异(管孝艳等,2012),说明不同农田利用方式对S-CAT、S-UE、FDA、S-NP活性影响较大。农田管理模式、翻耕次数、施肥强度等人为扰动因素可能是导致这类差异的主要原因。总体上,3种利用方式下农田土壤酶活性差异特征不尽相同,水田土壤酶活性数据范围较为稳定,蔬菜田的土壤酶活性波动较大,这可能与研究区蔬菜田中有机-无机肥料配施比例有关(王文锋等,2016)。
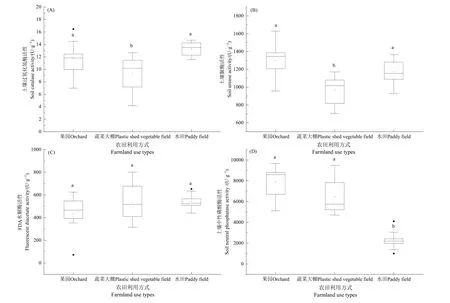
图2 典型农田利用类型的土壤酶活性分布Fig. 2 Distribution of soil enzyme activity of typical farmland use types
2.1.2 3种类型农田土壤环境因子差异性分析
土壤pH值在5.86—7.86范围内,分布特征为蔬菜大棚<果园<水田,3种利用方式间均有显著差异(P<0.05)(表 2)。土壤 SOM 平均质量分数为24.4—48.4 g·kg−1,分布特征为水田<果园<蔬菜大棚,其中蔬菜大棚显著高于其他两个(P<0.05)。土壤养分AP、HN、TK、AK,CEC和TS均表现为水田<蔬菜大棚<果园,仅与水田有显著差异(P<0.05)。TN 分布特征为水田<果园<蔬菜大棚,三者均存在显著性差异(P<0.05)。土壤粘粒质量分数不存在显著差异(P>0.05)。根据生物特性研究结果可知,蔬菜大棚的SR显著高于果园(P<0.05)、水田(P<0.05);水田AWCD显著高于果园、蔬菜大棚(P<0.05)。

表2 不同农田利用类型环境因子的多重比较Table 2 Multiple comparisons of environmental factors of different farmland use types
2.2 影响土壤酶活性的环境因子分析
不同农田利用方式对土壤养分质量分数及酶活性影响较大,通过对3种类型农田表层土壤酶活性与理化特性、生物特性的对应趋势及相关研究可知,土壤环境因子与土壤酶活性存在一定关联性。因此,选取这些环境因子作为解释变量在 Canoco 4.5中作进一步排序分析。
对研究区测定的4种土壤酶活性数据进行去趋势对应分析(Detrended correspondence analysis,DCA),结果显示研究区土壤酶活性在4个排序轴的梯度最大值为0.182,均小于3,因此选取RDA进行分析并进行蒙特卡洛置换检验(Monte Carlo permutation test),逐步筛选对土壤酶活性具有显著影响的环境因子。结果表明,在RDA的第Ⅰ和第Ⅱ排序轴 7个环境因子累计解释了土壤酶活性特征的71.1%,且对酶活性与环境因子关系的累计解释量达88.6%(表3)。可知,前两个排序轴能够很好地反映两者关系,且主要由第Ⅰ轴决定。短期效应显示,TK(P=0.008)解释了 36.4%的变化,而 HN(P=0.008)、SR(P=0.002)、pH(P=0.008)、AP(P=0.016)、TN(P=0.002)、和 CEC(P=0.040)分别解释了16.86%、8.69%、7.65%、4.76%、5.89%和2.69%。可见,土壤酶活性数据与环境因子均呈显著相关,且各因子对酶活性数据的累计解释量都较高。

表3 土壤酶活性特征值与解释量的RDA排序分析Table 3 Redundancy analysis of the characteristic values of soil enzyme activity and the amount of explanation
由图3可知,第Ⅰ排序轴主要由S-NP控制,与第Ⅰ排序轴显著负相关最高的是 TK,相关系数为−0.749,其次是AP,相关系数为−0.585,CEC、HN、TN也呈显著负相关,相关系数依次是−0.541、−0.423、−0.397;与第Ⅰ排序轴显著正相关的是pH,对应相关系数为 0.495,说明第Ⅰ排序轴主要反映了土壤酶活性分布在TK、AP等环境因子梯度上的变化,即沿排序轴第Ⅰ轴从左到右TK、AP、CEC、HN、TN减少,土壤pH值增加,SR基本不变的趋势。与此同时,土壤酶活性呈现S-NP、S-UE活性降低,FDA和S-CAT活性升高的趋势。第Ⅱ排序轴主要由 FDA控制,与第Ⅱ排序轴呈显著正相关的是HN和AP,相关系数是0.566和0.337,与第Ⅱ排序轴呈显著负相关的是TK、CEC,SR、pH值、TN,相关系数依次是−0.256、−0.227、−0.192、−0.115、−0.094。说明第Ⅱ排序轴主要反映了土壤酶活性在HN和AP等环境因子梯度上的变化,即沿排序轴第Ⅱ轴从左到右HN、TP增加,TK、CEC、SR、pH值减少、TN基本不变的趋势。与此同时,土壤酶活性呈现S-CAT活性升高,其他3种酶活性降低的趋势。
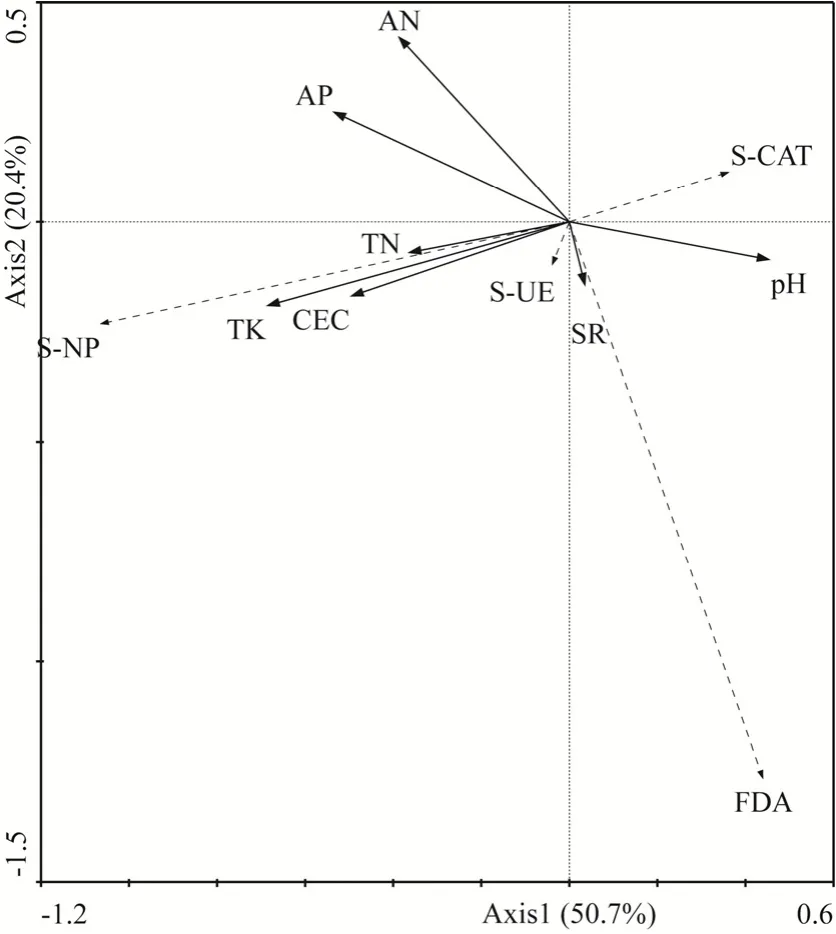
图3 土壤酶活性与环境因子的冗余分析(RDA)Fig. 3 Redundancy analysis of soil enzyme activity and environmental factors
综合前两轴,TK、AP、CEC、HN、TN、pH、SR对研究区土壤酶活性分布有显著影响。从箭头长短来看,箭头最长的是TK和AP,说明土壤TK和AP可能是影响研究区整体土壤酶活性分布特征的主要驱动因子。
结合样方二维排序结果可以看出(图4),研究区果园、蔬菜大棚、水田在排序图上呈现明显的聚集分布规律。果园和蔬菜大棚分布在全氮、全钾等土壤养分质量分数相对较高的区域,其中果园样方区域土壤S-NP活性较高,而蔬菜大棚样方区域土壤 FDA活性较高,主要位于排序图的第三象限;水田分布在土壤pH较高,氮、磷、钾养分含量都相对较低的区域,该区土壤S-CAT活性和FDA活性较高,主要位于排序图的第二象限。

图4 土壤样方分布与酶活性关系/环境因子的RDA排序Fig. 4 RDA ranking of soil sample distribution and enzyme activity/environmental factors
3 讨论
3.1 不同类型农田的土壤酶活性特征
在本研究中,上海郊区的农田土壤酶活性特征因果园、蔬菜大棚、水田不同管理模式(施肥、灌溉、耕作)导致土壤养分特征发生变化从而表现出显著差异。相较于果园、蔬菜大棚,水田S-CAT活性和FDA活性最高,S-NP最低,可能水田因还原性底物存在而产生典型刺激,导致S-CAT活性增强,以促进过氧化氢的加速分解转化为氧分子以氧化这些还原性物质(杨东伟等,2019)。FDA 水解酶在水田中显著高于其他,可能原因是FDA作为一种非特异性酶底物,可以被土壤中多种不同的胞外酶和胞内酶如酯酶、蛋白酶、脂肪酶等水解(Floch et al.,2009),表明3种农田利用方式下土壤中存在的可水解FDA的酶种类或数量存在显著差异(P<0.05)。此外,根据样地问卷调查显示,水田中化肥与有机肥的施用量远低于果园和设施大棚的施用量,尽管富含易分解为无机磷的有机肥作为中性磷酸酶的特定底物,刺激了土壤中性磷酸酶分泌(Salazar et al.,2011),但是不同土地利用类型施肥量差异较大,且水稻施肥中氮、磷、钾的需肥比例约2∶1∶3,磷元素所占比例较少,土壤中原有磷素仍处于消耗状态,导致水田磷含量显著低于其他两个。
此外,果园S-UE和S-NP最高,这与大量施用有机肥中酰胺态氮转化供应无机态氮、有机态磷矿化为无机态磷的能力有关。相关研究表明施用有机肥可对葡萄园土壤S-UE活性产生典型刺激,比不施肥的葡萄园土壤S-UE活性增加1175.25%(郭鹏飞等,2020);同理由于土壤磷肥用量增加,微生物受底物刺激分泌更多磷酸酶。蔬菜大棚的土壤S-CAT活性、S-UE活性显著低于其他(P<0.05)。蔬菜大棚因施用除草剂,不同浓度下除草剂对过氧化氢酶活性影响表现为低浓度促进,高浓度抑制(杨敏等,2008),因此S-CAT偏低。S-UE活性低可能原因是土壤pH可通过改变底物可利用性调节土壤酶活性(钟泽坤等,2021),S-UE的两个最佳pH 范围为 6.5—7.0 或 8.8—9.0(Fisher et al.,2017),蔬菜大棚土壤pH (5.86±0.89) 偏低,导致S-UE活性也低于其他两个。张华勇等(2005)研究表明水田改为大棚蔬菜后可引起土壤的酸化,高强度耕作并施用大量肥料导致S-UE活性无规律,和农田利用方式不存在明显的相关性。农业生产常以 S-UE抑制剂作为氮肥增效剂提高土壤肥力(张文学等,2019),因而导致大棚S-UE活性降低。
3.2 影响土壤酶活性的主要因素
通过对土壤酶活性和环境因子的冗余分析,发现在不同农田利用方式下,影响土壤酶活性的主要因子为全钾和有效磷,排序靠前的多为养分因子,说明土壤酶活性主要由养分驱动,与主要的微生物群相关性不显著(P>0.05)(Tan et al.,2021);土壤养分的富集和再分配,随人为干扰(施肥、翻耕等)程度而变化,从而对土壤酶活性及其空间分布产生影响(刘爽等,2019)。
从RDA二维排序图可以看出(图3),S-NP活性与土壤氮和磷关系密切,赵海燕等(2015)对秦岭地区华北落叶松人工林地酶活性的研究中也证明S-NP活性与AN、AP、AK呈极显著的正相关性(P<0.01),S-CAT活性与S-NP活性表现出相反的趋势,酶活性随土壤AP、HN的增加而降低,可能是由于土壤中有机质矿化以及肥料中的速效成分导致AP、HN充足,动植物、微生物受到负反馈机制调节使S-CAT分泌受到抑制(Luo et al.,2017)。土壤S-UE活性与TK、TN呈正相关。FDA活性与SR呈显著正相关(P<0.05),这与前人研究一致(朱英等,2015),深耕、翻耕等通过改善土壤通气条件、增加土壤水分,使土壤中有机质含量降低,从而影响土壤碳的利用、养分供给和微生物活动,进而影响酶活性。有研究认为土壤酶和底物相互作用在影响土壤呼吸强度进而推动土壤碳动态变化中发挥关键作用。但该研究中酶活性与土壤中活跃的主要微生物群落未呈现出显著相关性(P>0.05),表明研究区土壤中酶活性更多受动植物活动影响,土壤总呼吸也由土壤有机质分解呼吸、纯根呼吸主导(贡献率约80%),而非微生物呼吸(贡献率约20%)(Kelting et al.,1998;Xu et al.,2016)。FDA 活性与AP、HN呈负相关,可能是土壤中氮、磷元素的有效性高,导致土壤中微量元素相对缺乏,碳利用率降低,限制了碳水解酶活性(Jing et al.,2016),也可能是该农田生态系统中氮、磷的添加量超过了氮、磷的吸收能力。
研究结果表明,土壤全钾在养分元素中占比最高,且为4种土壤酶活性的首要影响因子,这与李琦等(2020)研究钾肥与有机肥配施对土壤酶活性的影响中得出根际土壤中磷酸酶、脲酶活性均在高量钾肥和高量有机肥施用条件下为最高结果一致。本研究中水稻、葡萄果树为喜钾作物,K+可通过参与根毛伸长和细胞生长转运外部K+,进而促进植物生长,提高植物对各种非生物胁迫的耐受性(Song et al.,2015)。另有研究认为钾等阳离子通常在分子水平上促进酶活性中发挥关键作用,植物分泌的很多酶均从生理性液体中或细胞内获取大量的钾,以促进底物结合和催化反应,进而影响根际土壤酶活性(Gohara et al.,2016),因此土壤全钾成为驱动这4种土壤酶活性的首要因子。
4 结论
(1)3种类型农田的土壤酶活性存在显著的空间差异性,4种土壤酶活性因农田利用方式不同呈现中等甚至强变异。因此在评价不同类型农田的土壤健康状况时,应合理选择相应的酶活性指标。
(2)不同类型农田土壤酶活性对养分及生化特性的响应并不总是一致,因此在构建农田土壤健康评价体系过程中,评价体系应区分不同农田利用方式。
(3)土壤SR是酶活性高低的重要表征,也可用于表示土壤健康水平,两者的相关性达极显著(P<0.01)。

