多汗症患者焦虑抑郁状态及睡眠情况研究
林雪霏 吴 楠 张海萍
(首都医科大学宣武医院皮肤性病科, 北京 100053)
多汗症是指躯体出汗超出体温调节需求,导致全身或局部出汗过多的综合征,可累及手足、腋窝、头面部等区域[1]。多汗症可分为原发性多汗症和继发性多汗症,超过90%的患者为原发性多汗症,其具体病因不明,可能与各种原因导致的交感神经异常兴奋有关[2]。多汗症严重影响患者的工作、生活及人际交往,还会带来一系列情绪及心理问题。本研究对多汗症患者焦虑、抑郁状态及睡眠情况进行了现况调查。
1 对象与方法
1.1 研究对象
本研究收集2019年1月至2020年12月就诊于首都医科大学宣武医院皮肤性病科门诊的多汗症患者。纳入的患者符合多汗症诊断标准[3]:出汗过多持续6个月以上,并至少满足以下6条中的2条:①双侧对称性出汗;②每周至少发作1次;③影响日常生活;④25岁前发病;⑤夜间睡眠时出汗停止;⑥有家族史。所有患者均自愿参加本研究,并已签署知情同意书。
1.2 研究工具
本研究使用医院焦虑抑郁量表(Hospital Anxiety and Depression Scale, HADS)及匹茨堡睡眠质量指数(Pittsburgh Sleep Quality Index,PSQI)量表进行评估。前者用于评估患者焦虑、抑郁情况,后者用于评估患者睡眠情况。
HADS可快速评估患者近1个月的焦虑、抑郁情绪,广泛应用于综合医院。全表按照Zigmond 原始的两因子结构模型进行分析,由14个条目组成,7个条目评定抑郁情况,7个条目评定焦虑情况。每个条目按照0~3分计分,焦虑、抑郁亚量表得分范围均为0~21分,0~7分属无症状,8~10分属可疑存在焦虑症状或抑郁症状,11~21分属肯定存在焦虑症状或抑郁症状[4]。患者得分以7分为界,得分>7分认定焦虑或抑郁症状阳性,若焦虑、抑郁量表得分均>7分则认为患者可能同时存在焦虑和抑郁症状,即焦虑抑郁共存的状态。
PSQI用于评定受试者近1个月的睡眠质量,PSQI由19个自评条目及5个他评条目组成,其中第19个自评条目和5个他评条目不参与计分,参与计分的18个自评条目组成了7个维度,分别为主观睡眠质量、入睡时间、睡眠时间、睡眠效率、睡眠障碍、安眠药物和日间功能。每个维度以0~3分计分,各维度的得分相加为测评总分,范围为0~21分,PSQI总分≤7分表示睡眠质量较好,总分>7分则存在睡眠障碍[5]。
1.3 阴性对照
本研究设立的阴性对照取自文献[6]中于综合医院内科门诊就诊的患者,共6 172例,患者使用HADS量表进行自评,其中焦虑平均得分为(3.3±2.4)分,抑郁平均得分为(2.6±2.2)分[6]。因该研究数据样本量大,专业性强,常被用作HADS 的国内常模,筛查住院、门诊患者及社区人群的焦虑抑郁状态。
1.4 统计学方法
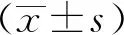
2 结果
2.1 一般情况
本研究共入组163名多汗症患者,其中男性87名,女性76名,年龄19~72岁,平均年龄(32.61±9.81)岁;学历方面,中学及以下学历21人(12.88%),大学学历96人(58.90%),研究生及以上学历46人(28.22%);工作环境方面,室内工作者152人(93.25%),室外工作者11人(6.75%);工作性质方面,脑力劳动者146人(89.57%),体力劳动者17人(10.43%)。出现焦虑或抑郁症状阳性者154人(94.48%),睡眠障碍者53人(32.52%)。
本研究的多汗症患者HADS焦虑评分为(6.47±2.89)分,高于国内常模(3.3±2.4)分(P<0.05);HADS抑郁评分为(10.29±2.22)分,显著高于国内常模(2.6±2.2)分(P<0.05);PSQI评分(6.21±3.16)分,整体睡眠质量尚好。
2.2 多汗症患者焦虑状态概况
本研究的多汗症患者中焦虑症状阳性者47人(28.83%),平均得分(9.81±2.55)分,其中可疑焦虑(8~10分)35人(21.47%),肯定焦虑(11~21分)12人(7.36%)。
焦虑症状阳性患者中PSQI得分(8.17±2.95)分,显著高于患者整体[(6.21±3.16)分]及焦虑症状阴性患者水平(P<0.05),详见表1。
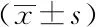
表1 多汗症患者焦虑状态及睡眠情况
2.3 多汗症患者抑郁状态概况
本研究的多汗症患者中抑郁症状阳性者共146人(89.57%),其中可疑抑郁(8~10分)71人(43.56%),肯定抑郁(11~21分)75人(46.01%),多汗症患者抑郁状态发病率(89.57%)高于焦虑阳性患者(28.83%)(P<0.05)。
抑郁症状阳性患者PSQI评分(6.04±3.20)分,与患者总体评分[(6.21±3.16)分]相比,差异无统计学意义(P>0.05)。详见表2。
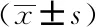
表2 多汗症患者抑郁状态及睡眠情况
2.4 多汗症患者焦虑抑郁症状共存情况
参与研究的多汗症患者同时存在焦虑、抑郁状态者41人(25.15%),焦虑评分(9.51±2.05)分,抑郁评分(10.00±1.57)分。焦虑抑郁症状共存患者PSQI评分(8.22±2.99)分,高于患者平均水平(P<0.01),其中存在睡眠障碍者24人(58.54%),提示同时存在焦虑、抑郁状态阳性者有一半以上存在睡眠障碍。
2.5 多汗症患者睡眠障碍概况
存在睡眠障碍的患者53人(32.52%),其焦虑症状阳性评分(8.13±3.49)分,显著高于患者整体焦虑得分(6.47±2.89)分(P<0.05),抑郁评分(9.51±2.22)分,与患者整体抑郁得分(10.29±2.22)分相比差异无统计学意义(P>0.05)。焦虑症状阳性者28人(52.83%),抑郁症状阳性者43人(81.13%),焦虑抑郁共存状态者24人(45.28%),无情绪问题者6人(11.32%)。详见表3。
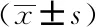
表3 睡眠障碍患者睡眠情况及焦虑、抑郁情况
2.6 不同人群焦虑、抑郁及睡眠评分比较
本研究分别对比了不同性别、年龄、学历、工作环境及工作性质的多汗症患者HADS焦虑、抑郁症状阳性评分及PSQI评分,结果发现室内工作者睡眠质量较室外工作者差(P<0.05),不同性别、年龄、学历、工作性质的多汗症患者组间评分差异均无统计学意义(P>0.05)。详见表4。
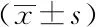
表4 不同人群焦虑、抑郁及睡眠评分比较
3 讨论
出汗在人类的日常生活中起着至关重要的作用,它可以维持体温、应对情绪压力和帮助新陈代谢。但多汗症患者会出现身体特定部位过度且不受控制地出汗,常使患者在日常社交中压力增大,缺乏自信,产生沮丧、自卑等不良情绪,极大地降低了患者的生活质量[7]。多汗症常在儿童期或青少年期起病,其在美国患病率约为4.8%[8],在中国特定地区15~22岁学生中的患病率达4.36%[9]。目前已发现原发性多汗症具有遗传基础,48%~65%的多汗症患者具有阳性家族史,58%的患者为父母-子女共患病例,由此支持该病为常染色体显性遗传模式的假说[10]。
人类的汗液分泌受中枢神经系统和自主神经系统的调节。目前研究[11-12]显示,多汗症的发生可能是由于某种神经系统障碍,导致汗腺被神经系统释放的乙酰胆碱过度刺激,而汗腺的大小、数量及组织学外观均没有明显变化[13]。当自主神经系统紊乱时,可引起反射回路的神经元兴奋性过高,破坏交感神经及副交感神经的正常调节作用。有研究[14]显示,多汗症患者瓦尔萨尔瓦(Valsalva)动作后反射性心动过缓减少,冷水浸泡手指后血管收缩增加,交感神经皮肤反应性增强,这些结果都提示多汗症患者存在自主神经系统功能障碍。情绪控制中枢异常也会导致多汗症的发生。情绪出汗是通过边缘系统的前扣带回与下丘脑精密调节完成[15],情绪性出汗主要影响腋窝、手掌、脚底、前额和头皮,与多汗症患者异常出汗部位吻合,由此推测,导致多汗的下丘脑调节中枢与一般体温调节中枢不同,它完全受皮质的影响而与体温信号无关。因此,多汗症可能由情绪导致的中枢神经系统调节异常引发[11]。
有研究[16]表明,多汗症患者更容易出现情绪问题,其中抑郁和焦虑在多汗症患者中十分常见。有报道[17]称,63%的多汗症患者感到不快乐或抑郁,Bahar等[18]的研究显示,多汗症患者抑郁的发病率更高,为27.2%,而健康患者则为9.7%,另一项研究[19]表明,多汗症患者焦虑的发生率是抑郁的4倍以上。本团队对多汗症患者焦虑、抑郁状态的调查显示,有94.48%的患者出现焦虑或抑郁症状阳性,提示多汗症患者情绪问题较普遍,其中焦虑症状阳性者占28.83%,HADS焦虑评分平均为(6.47±2.89)分,显著高于国内常模。笔者对患者抑郁状态的调查发现,多汗症患者抑郁状态阳性率高达89.57%,HADS抑郁评分平均为(10.29±2.22)分,超过可疑抑郁区间,可见多数多汗症患者呈现抑郁状态,本结果与Bahar等[18]的研究结果相似。另有47人出现焦虑抑郁症状共存,其发病机制可能与下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA)功能障碍及5-羟色胺能系统的级联变化有关[20]。目前尚不清楚是情绪问题导致的多汗症还是多汗症导致的情绪问题,但二者可以相互影响,加重患者病情。
笔者统计了多汗症患者的睡眠情况,有32.52%的患者出现了睡眠障碍。研究[21]表明,睡眠不足会使个人偏向消极情绪,更易发生焦虑、抑郁情况,并可以通过炎症途径对多种疾病造成影响。本研究的结果显示,睡眠障碍患者普遍存在焦虑、抑郁情况,仅有6人(11.32%)无情绪问题,另外焦虑患者的睡眠障碍情况相较抑郁患者人数占比多,评分高,睡眠质量更差,尤其焦虑抑郁症状共存患者睡眠障碍更为严重。情绪状况与睡眠障碍相互关联的具体机制尚不清楚,可能与应激相关的分子影响睡眠觉醒的调节有关。
本研究还对比了不同人群HADS焦虑、抑郁评分及PSQI评分,发现不同性别、年龄、学历、工作性质组间差异无统计学意义,但室内工作者睡眠质量较室外工作者差。本研究某些分组中样本量较小,故虽平均值差异明显,但并不能证实其差异有统计学意义,故今后将继续扩大样本量,以获得准确的组间差异。
多汗症患者常并发睡眠障碍、焦虑、抑郁等不良情绪,对生活产生多种负面影响,在临床工作中,医生在关注患者皮肤状态的同时,也应关注其情绪、睡眠等情况,必要时进行有针对性的心理干预和抗焦虑抑郁药物治疗,以改善皮肤疾病治疗效果,提高患者的生活质量。

