家蚕β-呋喃果糖苷酶基因BmSuc1表达特征及其对激素的响应
杨伟克 唐芬芬 刘增虎 董占鹏


摘要:【目的】探究BmSuc1基因在家蠶不同组织及不同时期的表达特征及经昆虫激素处理后的表达变化规律,明确昆虫激素对BmSuc1基因的调控作用,为深入解析BmSuc1基因的功能及其表达调控机制提供参考依据。【方法】利用实时荧光定量PCR检测BmSuc1基因在家蚕发育过程中不同时期和不同组织及外源激素处理后的表达特征,并通过双链RNA(dsRNA)干扰试验检测家蚕20-羟基蜕皮素(20E)受体基因(USP)干扰效果及BmSuc1基因的表达变化。【结果】BmSuc1基因在家蚕中肠中的相对表达量最高,其次是丝腺、表皮和血淋巴,在其他组织中的相对表达量很低或几乎不表达;BmSuc1基因呈脉冲型的表达模式,在家蚕每个龄期的将眠时、五龄后期(上簇前)及预蛹时的相对表达量较高。利用外源激素[20E和保幼激素(JH)]分别处理五龄第2 d发育良好的家蚕,发现经20E处理后12和18 h,BmSuc1基因相对表达量极显著高于注射0.1%二甲基亚砜(DMSO)的对照组(Ρ<0.01,下同),但在测定时间范围内JH处理组的BmSuc1基因相对表达量与对照组间无显著差异(Ρ>0.05)。以体外转录合成USP基因的dsRNA注射五龄第3 d家蚕,注射后24和36 h,USP基因相对表达量极显著下调,即dsRNA干扰成功。利用RNAi技术干扰USP基因能阻断20E信号转导,致使BmSuc1基因表达受抑制,其相对表达量在干扰USP基因后24和36 h显著下调(Ρ<0.05)。【结论】BmSuc1基因主要在家蚕蜕皮和变态时高表达,暗示其可能参与家蚕的变态发育过程。添加外源20E可诱导BmSuc1基因转录,而阻断20E信号转导途径会抑制BmSuc1基因表达,即BmSuc1基因作为20E信号转导通路中的下游靶基因,直接或间接受到20E信号调控。
关键词: 家蚕;β-呋喃果糖苷酶;BmSuc1基因;20-羟基蜕皮素;保幼激素;表达特征
中图分类号: S881.2 文献标志码: A 文章编号:2095-1191(2021)07-1991-07
Expression profiles and response to exogenous hormones of β-fructofuranosidase gene BmSuc1 in silkworm(Bombyx mori)
YANG Wei-ke1, TANG Fen-fen2, LIU Zeng-hu1, DONG Zhan-peng1*
(1 Sericulture and Apiculture Research Institute,Yunnan Academy of Agricultural Sciences,Mengzi, Yunnan 661101, China;2 College of Life Science and Technology, Honghe University, Mengzi, Yunnan 661101, China)
Abstract:【Objective】In order to clarify the regulatory effects of insect hormones on the expression of BmSuc1 and provide a reference for further analysis of the function and expression regulation mechanism of BmSuc1, this study explored the expression profiles of BmSuc1 in different tissues and periods of silkworm and the expression changes of BmSuc1 after treatment with exogenous hormones. 【Method】By using real-time fluorescence quantitative PCR technology, the expression characteristics of BmSuc1 were detected in different periods, different tissues and after treatment with ex-ogenous hormones during the development of silkworm larvae. The expression of BmSuc1 and 20E receptor gene USP were detected after RNA interference with double-stranded RNA(dsRNA) of USP. 【Result】The relative expression of BmSuc1 gene in midgut was the highest, followed by silk glands, epidermis and hemolymph. However, there was much lower or almost no expression in other tissues. In addition, the BmSuc1 expression profile exhibited a pulse-like pattern in silkworm larvae, the expression level of BmSuc1 was higher at each instar stage before molting, late fifth instar before cocooning and prepupal stage. The day 2 of fifth-instar silkworm larvae were treated with 20-hydroxyecdysone(20E) and juvenile hormone(JH), it was found that the expression of BmSuc1 was extremely significantly higher at 12 and 18 h after 20E treatment than the control group injected with 0.1% dimethyl sulfoxide(DMSO)(P<0.01, the same below). But there were no significant difference of the BmSuc1 expression between the JH treatment and the control group during the measurement time range(P>0.05). The dsRNA of USP was synthesized in vitro and injected into silkworm larvae at day 3 of the fifth instar. It was showed that the USP relative expression were extremely significantly down-regulated at 24 and 36 h after injection, which indicated that dsRNA interference was successful. RNAi of USP would block 20E signal transduction, and the expression of BmSuc1 was inhibited and significantly down-regulated at 24 and 36 h after injection of dsRNA of USP(P<0.05). 【Conclusion】The BmSuc1 expression peaks appear in the molting of silkworm larvae and the metamorphosis of larvae to pupae, which suggests that BmSuc1 may be involved in the metamorphic development process of the silkworm. Treatment with exogenous ecdysone 20E can activate the expression of BmSuc1, but blocking the 20E signal transduction pathway may suppress expression of BmSuc1. It indicates that BmSuc1 as a downstream target gene in 20E signal transduction pathway is directly or indirectly regulated by 20E signal.
Key words: Bombyx mori; β-fructofuranosidase; BmSuc1; 20-hydroxyecdysone; juvenile hormone; expression characteristics
Foundation item:Agricultural Basic Research Joint Special Project of Yunnan(2018FG001-042); Modern Agricultural Sericulture Industrial Technology System Construction Project of Yunnan(2019KJTX006); Applied Basic Research Project of Yunnan Academy of Agricultural Sciences(YJM201710)
0 引言
【研究意义】家蚕(Bombyx mori)是国际无脊椎动物协会唯一确定的鳞翅目模式昆虫,也是支撑蚕丝产业的生物基础,具有极高的经济价值(秦俭等,2010;朱文恺等,2018)。β-呋喃果糖苷酶(β-fructofuranosidase,β-FFase)是一种蔗糖水解酶,普遍存在于植物和微生物中,动物体内不存在β-FFase的观点长期存在,影响着人们的科学判断(Krasikov et al.,2001;Alberto et al.,2004;杨伟克等,2016)。BmSuc1基因是首个被克隆鉴定的动物型β-FFase基因,其酶活性不受桑叶生物碱1-脱氧野尻霉素(1-deoxynojirimycin,DNJ)的抑制影响(Gan et al.,2018)。BmSuc1基因在家蚕幼虫的中肠、前部及中部丝腺中高表达,其编码的β-Ffase可能在家蠶抵御桑叶生物碱的毒害作用中发挥重要生理作用(杨伟克等,2016)。因此,明确BmSuc1基因的转录表达特征及其对外源激素的响应,可为揭示BmSuc1基因在家蚕机体中发挥的生理功能及阐明昆虫激素对β-FFase基因的分子调控机制提供参考依据。【前人研究进展】Daimon等(2008)率先在家蚕基因组中克隆出编码β-FFase的BmSuc1基因,通过体外重组获得融合蛋白BmSuc1,并证实融合蛋白BmSuc1具有蔗糖水解酶活性,且其活性不受桑叶DNJ等生物碱的影响。此后,研究人员又从蓖麻蚕(Samia cynthia ricini)和柞蚕(Antherea pernyi)的基因组中克隆获得β-FFase同源基因(张蕾,2014),其中,蓖麻蚕有2个β-FFase同源基因(ScSuc1和ScSuc2),柞蚕有3个(ApSuc1a、ApSuc1b和ApSuc1c),但这些基因在非食桑昆虫蓖麻蚕和柞蚕幼虫体内几乎不被转录,且研究发现蓖麻蚕和柞蚕机体的蔗糖水解酶主要为α-葡萄糖苷酶,不具β-FFase活性(张蕾,2014)。李静(2014)从桑螟中克隆获得5个β-FFase同源基因片段(DpSuc1a、DpSuc1b、DpSuc2a、DpSuc2b和DpSuc2c),其中DpSuc1a和DpSuc2c基因在前肠、中肠、丝腺和脂肪体等组织中高表达,而DpSuc1b、DpSuc2a和DpSuc2b基因在桑螟所有组织中几乎不表达;桑螟中肠的β-FFase具有分解蔗糖的活力,且其活性不受DNJ影响。桑螟是以桑叶为寄主的桑树害虫,尽管与家蚕亲缘关系较远,但其机体存在β-FFase同源基因,且具有β-FFase活性,说明β-FFase在食桑昆虫的糖代谢途径中发挥着重要的生物功能作用,可帮助食桑昆虫正常水解蔗糖,避开桑叶生物碱的毒性通路(李鑫,2016)。昆虫的蜕皮与变态发育过程是在蜕皮激素(Molting hormone,MH)和保幼激素(Juvenile hormone,JH)的协同调控下,大量基因按照一定的时间和空间次序被诱导或抑制表达而实现(程道军,2008;唐芬芬和杨伟克,2020)。JH对保持昆虫幼虫的形态、性状及促进生殖腺成熟等起重要作用;而昆虫的蜕皮、变态发育和繁殖受MH的严格调控(Liu et al.,2018;Zhang et al.,2018)。MH作为控制昆虫变态发育最关键的内在因子之一,任何受其直接或间接调控的基因均有可能参与昆虫的蜕皮和变态发育过程(刘素宁等,2019)。【本研究切入点】BmSuc1基因是第一个被克隆鉴定的动物型β-FFase基因,但其在家蚕整个生命周期的转录表达特征及昆虫激素对BmSuc1基因表达调控的相关研究至今鲜见报道。【拟解决的关键问题】以鳞翅目模式昆虫家蚕为研究对象,通过实时荧光定量PCR检测BmSuc1基因在家蚕不同组织及不同时期的表达特征及经昆虫激素[20-羟基蜕皮素(20E)和JH]处理后的表达变化规律,明确昆虫激素对BmSuc1基因的调控作用,为深入解析BmSuc1基因的功能及其表达调控机制提供参考依据。
1 材料与方法
1. 1 试验材料
供试家蚕品系为湘晖,由云南省农业科学院蚕桑蜜蜂研究所家蚕资源研究室提供。组织表达谱取材为五龄第3 d家蚕的头、马氏管、血淋巴、表皮、中肠、气管、脂肪体、丝腺、精巢和卵巢;时期表达谱取材为一龄起蚕至化蛹各时期的整蚕。20E(Y0002054)和JH(33375)购自Sigma公司;高纯总RNA快速提取试剂盒(RP1202)购自北京百泰克生物技术有限公司;反转录试剂盒(RR047A)和实时荧光定量PCR试剂盒TB Green? Premix Ex Taq?(RR42LR)购自TaKaRa公司;RiboMAX Large Scale System-T7体外转录试剂盒(P1300)购自Promega公司。
1. 2 外源激素处理
参照张捷等(2018)的方法,选用五龄第2 d发育良好的家蚕,以微量注射器(10 μL)在每头家蚕第2个气孔注射2 μL的20E(1.0 μg/μL)或JH(0.5 μg/μL),分别在注射后6、12、18和24 h取样,-80 ℃保存备用。以注射等量的0.1%二甲基亚砜(DMSO)为对照。每处理设4个重复,每次取样设3次重复。
1. 3 总RNA提取及cDNA制备
根据高纯总RNA快速提取试剂盒操作说明,提取家蚕总RNA,以1.0%琼脂糖凝胶电泳检测总RNA完整性,采用SimpliNano超微量核酸蛋白定量仪检测其浓度和纯度;然后按反转录试剂盒说明将RNA反转录合成cDNA,用于实时荧光定量PCR检测。
1. 4 实时荧光定量PCR检测
以NCBI已公布的家蚕BmSuc1基因(GenBank登录号NM_001126249.1)为靶标基因,核糖体蛋白基因Rp49(GenBank登录号NM_001098282)为内参基因,利用Primer Premier 5.0设计实时荧光定量PCR扩增引物(表1),委托生工生物工程(上海)股份有限公司合成。按照TB Green? Premix Ex Taq? 说明配制实时荧光定量PCR反应体系20.0 μL:2×TB Green Premix Ex Taq 10.0 μL,上、下游引物(10 μmol/L)各0.5 μL,cDNA模板1.5 μL,无菌水7.5 μL。扩增程序:95 ℃预变性5 min;95 ℃ 10 s,60 ℃ 30 s,进行40个循环。根据CFX-96实时荧光定量PCR仪记录数据,通过2-△△Ct法换算目的基因相对表达量。利用Excel 2016和SPSS 21.0对试验数据进行统计分析及制图。
1. 5 dsRNA干扰试验
RNA干扰(RNA interference,RNAi)是通过双链 RNA(dsRNA)介导特异性降解靶标基因mRNA,导致转录后水平的基因沉默现象。利用siDirect v2.0(http://sidirect2.rnai.jp/)在线预测家蚕20E受体基因(USP)CDS序列潜在的siRNA位点,选择siRNA位点集中且特异性较好的片段为dsRNA干扰片段,以家蚕红色荧光蛋白基因(RFP)为内参基因。利用Pri-mer 5.0设计RNAi引物(表2),并在各引物的5'端分别添加T7接头序列(下划线部分)。根据RiboMAX Large Scale System-T7试剂盒说明体外转录合成USP和RFP基因的dsRNA片段,于家蚕五龄第3 d按每头家蚕30 μg的剂量,利用玻璃毛细管针注射dsRNA。分别在注射后24、36、48和60 h取材,通过实时荧光定量PCR检测dsRNA干涉效果及BmSuc1基因的表达变化。
2 结果与分析
2. 1 BmSuc1基因的组织及时期表达特征
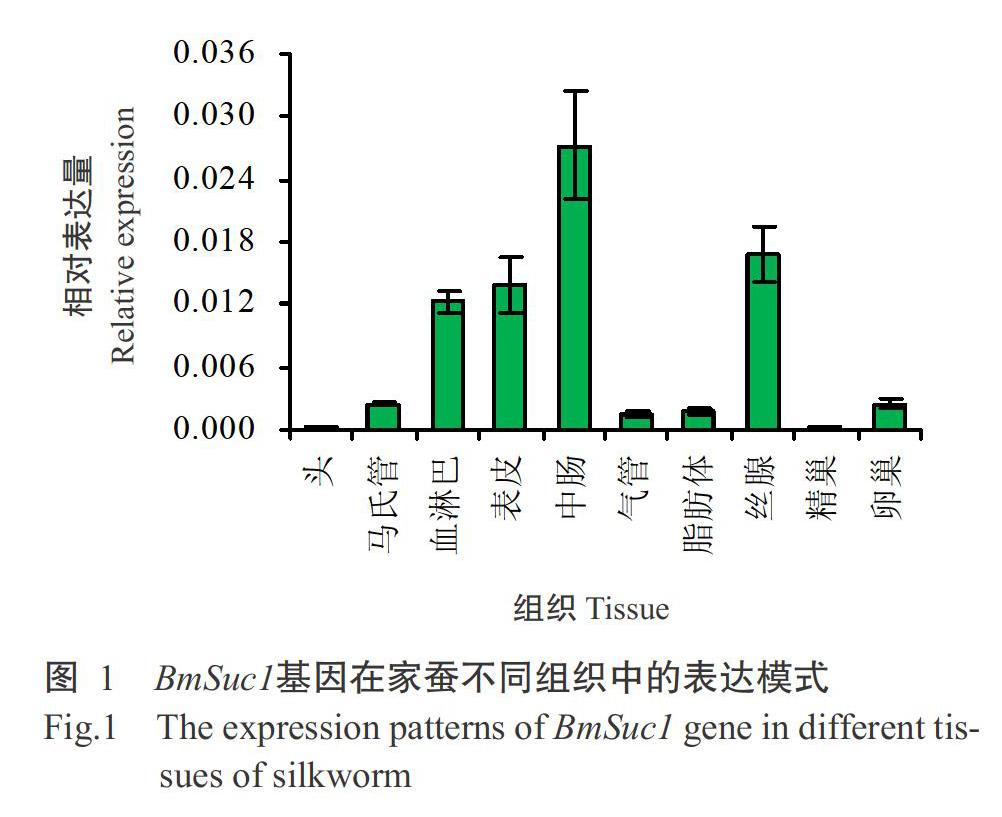
利用实时荧光定量PCR检测BmSuc1基因在五龄第3 d家蚕10个组织中的表达情况,结果(图1)显示,BmSuc1基因在家蚕中肠的相对表达量最高,其次是丝腺、表皮和血淋巴,在其他组织中的相对表达量很低或几乎不表达。BmSuc1基因在一龄起蚕至化蛹各时期的表达模式如图2所示。BmSuc1基因呈脉冲型的表达模式,一龄至四龄的每个龄期起蚕的BmSuc1基因相对表达量均较低;随着家蚕开始进食桑叶,BmSuc1基因相对表达量逐渐增加,至将眠时其相对表达量升至最高值(红色箭头标注),随后开始降低,眠期结束时的相对表达量最低,之后又開始下一个循环。此外,在五龄后期(上簇前)及预蛹时均存在一个表达高峰(红色箭头标注)。
2. 2 外源激素对BmSuc1基因表达的影响
20E和JH协同调控昆虫的蜕皮及变态过程,家蚕进入将眠和变态期,20E含量逐渐增加,而JH含量逐渐降低(程道军,2008)。根据BmSuc1基因的时期表达谱(图2),推测BmSuc1基因受20E和JH的协同调控,因此选用20E和JH分别处理五龄第2 d家蚕,检测处理后不同时间点BmSuc1基因的表达变化规律,结果(图3)表明,20E处理后12和18 h,BmSuc1基因相对表达量极显著高于对照组(Ρ<0.01,下同);但在测定的时间范围内,JH处理组的BmSuc1基因相对表达量与对照相间无显著差异(Ρ>0.05),说明BmSuc1基因受20E的诱导表达,对JH处理则无明显应答反应。
2. 3 阻断20E信号对BmSuc1基因表达的影响
20E通过其受体EcR/USP转导信号,即干扰EcR基因或USP基因均能有效阻断20E信号转导。以体外转录合成USP基因的dsRNA注射五龄第3 d家蚕,采用实时荧光定量PCR检测USP基因干扰效果及BmSuc1基因的表达变化,结果(图4)显示,注射USP基因的dsRNA后24和36 h,USP基因相对表达量极显著下调,说明dsRNA干扰成功。由图5可看出,利用RNAi技术干扰USP基因能阻断20E信号转导,致使BmSuc1基因表达受抑制,其相对表达量在注射USP基因的dsRNA后24和36 h显著下调(Ρ<0.05),推测BmSuc1基因作为20E信号转导通路中的下游靶基因,受20E信号调控。
3 讨论
随着越来越多昆虫基因组测序的完成,在许多昆虫中发现有β-FFase同源基因存在。Pauchet等(2008)在棉铃虫(Helicoverpa armigera)中肠cDNA文库中发现编码β-FFase的转录产物。随后又在烟草天蛾(Manduca sexta)的转录组测序数据库中发现2个编码β-FFase的基因重叠群(MsSuc1和MsSuc2),说明鳞翅目昆虫基因组中普遍存在β-FFase基因(Pauchet et al.,2009)。此外,在鞘翅目昆虫山松甲虫(Dendroctonus ponderosae)、甘蔗象鼻虫(Sphenopho-rus levis)和白蜡窄吉丁虫(Agrilus planipennis)的基因组中也发现编码β-FFase的基因序列(Pedezzi et al.,2014;Zhao et al.,2014)。家蚕作为鳞翅目的模式昆虫,BmSuc1基因是第一个被克隆鉴定的动物型β-FFase基因,但BmSuc1基因在家蚕整个生命周期及不同组织器官的表达特征并不清晰,其转录调控机理尚未被解析。本研究全面系统分析BmSuc1基因的组织和时期表达规律,结果显示,BmSuc1基因不仅在家蚕中肠高表达,在表皮和丝腺中的相对表达量也较高。昆虫的蜕皮和变态均涉及到新旧表皮更替,而BmSuc1基因在表皮中高表达,暗示其可能参与蜕皮和变态的生理过程。Daimon等(2008)利用半定量PCR检测BmSuc1基因在不同组织的表达情况,结果发现BmSuc1基因在中肠和丝腺中的表达水平较高,但在表皮组织中检测不到BmSuc1基因。本研究的实时荧光定量PCR检测结果与Daimon等(2008)的研究结果存在一定差异,可能是检测方法差异所造成,半定量PCR是通过琼脂糖凝胶电泳条带的明亮程度判断基因表达情况,影响因素较多,而实时荧光定量PCR的灵敏度和精准度均高于半定量PCR。
在家蚕体内,USP基因的RNAi效率较EcR基因的RNAi效率高(Masumoto et al.,2009)。本研究通过体外转录合成家蚕USP基因的dsRNA,注射五龄第3 d家蚕后能显著下调USP基因表达,从而阻断20E信号转导;同时发现BmSuc1基因表达受抑制,暗示BmSuc1基因作为20E信号转导通路中的下游靶基因,受20E信号的直接或间接调控。昆虫20E信号转导途径已基本明晰:在分子伴侣复合物的协助下,20E先与异源二聚体受体EcR-USP结合,再与靶基因调控序列上的20E反应元件(Ecdysone receptor response element,EcRE)结合,募集共激活因子,在RNA聚合酶作用下启动20E初级应答基因(转录因子E74、E75、E93和Br-C)转录(Nishita,2014;Li et al.,2016;Liu et al.,2018)。20E信号由初级应答基因编码的转录因子诱导次级应答基因表达而被级联放大,进而实现对昆虫生长发育、蜕皮变态及免疫防御的调控(刘素宁等,2019)。
关于20E对家蚕基因表达调控方面已有较多研究报道。赵国栋等(2012)用20E浸泡过的桑叶喂食家蚕,其中肠、脂肪体和马氏管组织中的谷胱甘肽-S-转移酶基因(BmGSTs1和BmGSTs2)转录水平显著上升,表明这2个基因参与了家蚕蜕皮激素的代谢过程。Yang等(2014)研究表明,添加外源20E能显著上调家蚕卵黄原蛋白基因(Vg)表达。杨欢欢(2016)研究发现,20E能调控五龄家蚕丝腺磷酸吡哆醇氧化酶基因(PNPO)和磷酸吡哆醛激酶基因(PLK)的表达,而JH对PNPO基因和PLK基因的表达无明显影响。Mai等(2017)通过研究家蚕抗菌肽基因(Lebocin)在中肠的表达调控机制,发现20E可通过上调转录因子基因(BmBR-CZ4和BmEts),而启动Lebocin基因表达。此外,20E可通过BrC-Z4顺式作用元件调控几丁质酶基因(BmCHT5)参与家蚕的蜕皮和变态过程(Zhang and Zheng.,2017)。20E通过作用于EcRE或介导E74、E75、E93和Br-C等相关转录因子应答基因,实现对靶标基因的转录调控作用(洪芳等,2016)。本研究的外源激素注射试验结果表明,BmSuc1基因的表达受20E调控,但具体调控机制尚未明确,BmSuc1基因启动子序列是否存在EcRE或相关转绿因子结合位点均有待后续进一步探究。
4 结论
BmSuc1基因主要在家蚕蜕皮和变态时高表达,暗示其可能参与家蚕的变态发育过程。添加外源20E可诱导BmSuc1基因转录,而阻断20E信号转导途径会抑制BmSuc1基因表达,即BmSuc1基因作为20E信号转导通路中的下游靶基因,直接或间接受到20E信号调控。
参考文献:
程道軍. 2008. 家蚕激素信号通路及其对变态发育期基因表达的调控研究[D]. 重庆:西南大学. doi:10.7666/d.y1264282. [Cheng D J. 2008. Hormone-related pathway and its regulation on gene exprssion during metamorphosis in the silkworm,Bombyx mori[D]. Chongqing:Southwest University.]
洪芳,宋赫,安春菊. 2016. 昆虫变态发育类型与调控机制[J]. 应用昆虫学报,53(1):1-8. doi:10.7679/j.issn.2095-1353.2016.001. [Hong F,Song H,An C J. 2016. Introduction to insect metamorphosis[J]. Chinese Journal of Applied Entomology,53(1):1-8.]
李静. 2014. 桑螟β-呋喃果糖苷酶基因的克隆与功能研究[D]. 合肥:安徽农业大学. [Li J. 2014. Molecular cloning and functional analysis of β-fructofuranosidase genes in Diaphania pyloalis Walker[D]. Hefei:Anhui Agricultural University.]
李鑫. 2016. 家蚕β-呋喃果糖苷酶的定点突变与功能性活性位点研究[D]. 合肥:安徽农业大学. [Li X. 2016. Site-directed mutagenesis of β-fructofuranosidase of Bombyx mori and analyses on the active residues[D]. Hefei:Anhui Agricultural University.]
刘素宁,任充华,李胜. 2019. 昆虫变态发育的激素和营养调控研究进展与展望[J]. 应用昆虫学报,56(4):639-651. doi:10.7679/j.issn.2095-1353.2019.074. [Liu S N,Ren C H,Li S. 2019. Progress in research on hormonal and nutritional regulation in insect metamorphosis[J]. Chinese Journal of Applied Entomology,56(4):639-651.]
秦俭,何宁佳,向仲怀. 2010. 家蚕模式化研究进展[J]. 蚕业科学,36(4):645-649. doi:10.3969/j.issn.0257-4799.2010. 04.011. [Qin J,He N J,Xiang Z H. 2010. Advances in silkworm modeling research[J]. Science of Sericulture,36(4):645-649.]
唐芬芬,杨伟克,2020. 昆虫激素对家蚕ALP活性及其基因表达水平的影响[J]. 河南农业科学,49(11):153-158. doi:10.15933/j.cnki.1004-3268.2020.11.020. [Tang F F,Yang W K. 2020. Effects of insect hormone on ALP activity and its gene expression level in Bombyx mori[J]. Journal of Henan Agricultural Sciences,49(11):153-158.]
楊欢欢. 2016. 外源激素对家蚕磷酸吡哆醛合成酶转录水平的影响及转录组学分析[D]. 合肥:安徽农业大学. [Yang H H. 2016. The study of the transtriptional level of synthetase of Pyridoxal-5?-phosphate and the transcriptomics analysis in the silkworm,Bombyx mori[D]. Hefei:Anhui Agricultural University.]
杨伟克,唐芬芬,刘增虎,钟健,董占鹏. 2016. 5龄家蚕中肠β-呋喃果糖苷酶基因转录表达分析[J]. 南方农业学报,47(5):721-725. doi:10.3969/j:issn.2095-1191.2016.05.721. [Yang W K,Tang F F,Liu Z H,Zhong J,Dong Z P. 2016. Transcriptional expression of β-fructofuranosidase gene in midgut of the 5th instar Bombyx mori larvae[J]. Journal of Southern Agriculture,47(5):721-725.]
张捷,丁洋,郑思春. 2018. 家蚕表皮型几丁质合成酶基因BmCHSA-2a的鉴定及其对激素的响应[J]. 华南师范大学学报(自然科学版),50(1):65-71. doi:10.6054/j.jscnun.2018039. [Zhang J,Ding Y,Zheng S C. 2018. Identification of epidermal chitin synthase BmCHSA-2a in Bombyx mori and its responses to hormones[J]. Journal of South China Normal University(Natural Science Edition),50(1):65-71.]
张蕾. 2014. 非食桑昆虫蓖麻蚕和柞蚕β-FFase的体内外表达与活性分析[D]. 合肥:安徽农业大学. [Zhang L. 2014. In vivo and in vitro expression and activity analysis of β-FFase in two non-mulberry feeding silkworm—Samia cynthia ricini and Antheraea pernyi[D]. Hefei:Anhui Agricultural University.]
赵国栋,卫正国,高瑞娜,王瑞娴,张婷,李兵,沈卫德. 2012. 蜕皮激素诱导下家蚕Sigma家族GST基因的表达变化[C]//中国蚕学会. 中国蚕学会第七届青年学术研讨会论文集. [Zhao G D,Wei Z G,Gao R N,Wang R X,Zhang T,Li B,Shen W D. 2012. Changes in the expression of the Sigma-class GST genes under the induction of ecdysone in Bombyx mori[C]//Chinese Society of Sericultu-ral Science. Proceedings of the 7th Youth Symposium of Chinese Society of Sericultural Science.]
朱文恺,甘泉,贺伟,张新伟,周跃,吴梦雪,孙同同,江松,孟艳. 2018. 家蚕β-呋喃果糖苷酶基因BmSuc1的CRISPR敲除载体的构建与导入[J]. 应用昆虫学报,55(2):208-216. doi:10.7679/j.issn.2095-1353.2018.029. [Zhu W K,Gan Q,He W,Zhang X W,Zhou Y,Wu M X,Sun T T,Jiang S,Meng Y. 2018. Construction of a CRISPR vector to edit the β-fructofuranosidase gene BmSuc1 and its incorporation in the silkworm Bombyx mori[J]. Chinese Journal of Applied Entomology,55(2):208-216.]
Alberto F,Bignon C,Sulzenbacher G,Henrissat B,Czjzek M. 2004. The three-dimensional structure of invertase(beta-fructosidase)from Thermotoga maritima reveals a bimo-dular arrangement and an evolutionary relationship between retaining and inverting glycosidases[J]. Journal of Biological Chemistry,279(18):18903-18910. doi:10.1074/jbc.M313911200.
Daimon T,Taguchi T,Meng Y,Katsuma S,Mita K,Shimada T. 2008. Beta-fructofuranosidase genes of the silkworm,Bombyx mori: Insights into enzymatic adaptation of B. mori to toxic alkaloids in mulberry latex[J]. Journal of Biological Chemistry,283(22):15271-15279. doi:10.1074/ jbc.M709350200.
Gan Q,Zhang X W,Zhang D B,Shi L,Zhou Y,Sun T T,Jiang S,Gao J S,Meng Y. 2018. BmSUC1 is essential for glycometabolism modulation in the silkworm,Bombyx mori[J]. Biochimica et Biophysica Acta. Gene Regulatory Mechanisms,1861(6):543-553. doi:10.1016/j.bbagrm.2018. 04.002.
Krasikov V V,Karelov D V,Firsov L M. 2001. Alpha-glucosidases[J]. Biochemistry(Moscow),66(3):267-281. doi:10.1023/a:1010243611814.
Li K,Tian L,Guo Z J,Guo S Y,Zhang J Z,Gu S H,Palli S R,Cao Y,Li S. 2016. 20-hydroxyecdysone(20E) primary response gene E75 isoforms mediate steroidogenesis autoregulation and regulate developmental timing in Bombyx[J]. The Journal of Biological Chemistry,291(35):18163- 18175. doi:10.1074/jbc.M116.737072.
Liu S N,Li K,Gao Y,Liu X,Chen W T,Ge W,Feng Q L,Palli S R,Li S. 2018. Antagonistic actions of juvenile hormone and 20-hydroxyecdysone within the ring gland determine developmental transitions in Drosophila[J]. Proceedings of the National Academy of Sciences of the United States of America,115(1):139-144. doi:10.1073/pnas.1716897115.
Mai T Y,Chen S N,Lin X Y,Zhang X J,Zou X P,Feng Q L,Zheng S C. 2017. 20-hydroxyecdysone positively regulates the transcription of the antimicrobial peptide,lebocin,via BmEts and BmBR-C Z4 in the midgut of Bombyx mori during metamorphosis[J]. Developmental & Comparative Immunology,74:10-18. doi:10.1016/j.dci.2017. 04.002.
Masumoto M,Yaginuma T,Niimi T. 2009. Functional analysis of ultrabithorax in the silkworm,Bombyx mori,using RNAi[J]. Development Genes and Evolution,219(10):437-444. doi:10.1007/s00427-009-0305-9.
Nishita Y. 2014. Ecdysone response elements in the distal promoter of the Bombyx broad-complex gene,BmBR-C[J]. Insect Molecular Biology,23(3):341-356. doi:10.1111/imb.12085.
Pauchet Y,Muck A,Svatos A,Heckel D G,Preiss S. 2008. Mapping the larval midgut lumen proteome of Helicoverpa armigera,a generalist herbivorous insect[J]. Journal of Proteome Research,7(4):1629-1639. doi:10.1021/pr 7006208.
Pauchet Y,Wilkinson P,Vogel H,Nelson D R,Reynolds S E,Ffrench-Constant R H. 2009. Pyrosequencing the Manduca sexta larval midgut transcriptome:Messages for digestion,detoxification and defence[J]. Insect Molecular Bio-logy,19(1):61-75. doi:10.1111/j.1365-2583.2009.00936.x.
Pedezzi R,Fonseca F P P,Júnior C D S,Kishi L T,Terra W R,Henrique-Silva F. 2014. A novel β-fructofuranosidase in Coleoptera:Characterization of a β-fructofuranosidase from the sugarcane weevil,Sphenophorus levis[J]. Insect Biochemistry & Molecular Biology,55:31-38. doi:10. 1016/j.ibmb.2014.10.005.
Yang C W,Lin Y,Liu H L,Shen G W,Luo J,Zhang H Y,Peng Z X,Chen E X,Xing R M,Han C S,Xia Q Y. 2014. The broad-complex isoform 2 (BrC-Z2) transcriptional factor plays a critical role in vitellogenin transcription in the silkworm Bombyx mori[J]. Biochimica et Biophysica Acta,1840(9):2674-2684. doi:10.1016/j.bbagen.2014.05.013.
Zhang T L,Song W,Li Z,Qian W L,Wei L,Yang Y,Wang W N,Zhou X,Meng M,Peng J,Xia Q Y,Perrimon N,Cheng D J. 2018. Krüppel homolog 1 represses insect ecdysone biosynthesis by directly inhibiting the transcription of steroidogenic enzymes[J]. Proceedings of the National Academy of Sciences of the United States of America,115(15):3960-3965. doi:10.1073/pnas.1800 435115.
Zhang X,Zheng S. 2017. 20-hydroxyecdysone enhances the expression of the chitinase 5 via groad-complex zinc-finger 4 during metamorphosis in silkworm,Bombyx mori[J]. Insect Molecular Biology,26(2):243-253. doi:10. 1111/imb.12288.
Zhao C,Doucet D,Mittapalli O. 2014. Characterization of horizontally transferred β-fructofuranosidase(ScrB) genes in Agrilus planipennis[J]. Insect Molecular Biology,23(6):821-832. doi:10.1111/imb.12127.
(責任编辑 兰宗宝)

