植物挥发性有机化合物的研究进展
李娟娟 张怿 秦凯伟 王立华 戴余军
摘要:植物在生長发育过程中释放大量的挥发性有机化合物(Volatile organic compounds,VOCs),这类物质为亲脂性小分子化合物。VOCs参与植物信号交流、授粉、生物与非生物胁迫应答等过程;作为植物芳香形成的重要原因,VOCs还影响植物果实及植物加工产品的风味和品质。文章归纳总结了VOCs的合成途径分类、合成部位、催化特征和影响其合成的因素(遗传背景差异、不同的生长阶段和部位及外界环境因素),VOCs参与植物应对逆境胁迫中的作用和机制(直接防御、间接防御和提高植物应对胁迫能力)以及基因调控手段(导入外源基因、提高自身基因的表达量和抑制内源基因的表达),指出目前基因调控存在目的产物不稳定和效果不确定的问题。提出今后应加强减少非必需VOCs的合成、深入探讨VOCs与其他次级代谢产物相互影响的机制和重视合成后修饰对VOCs的影响等基础理论研究,以及VOCs改变对农产品品质的影响和有效利用VOCs提高植物应对胁迫能力的农业用途趋势研究,为深入研究VOCs及其应用提供理论参考。
关键词: 挥发性有机化合物;生物合成;胁迫;基因工程
中图分类号: S184 文献标志码: A 文章编号:2095-1191(2021)07-1969-11
Volatile organic compounds in plant: A review
LI Juan-juan1, ZHANG Yi1, QIN Kai-wei1, WANG Li-hua2, DAI Yu-jun1*
(1College of Life Science and Technology/Hubei Province Research Center of Engineering Technology for Utilization of Botanical Functional Ingredients, Hubei Engineering University, Xiaogan, Hubei 432000, China;
2Hubei Key Laboratory of Quality Control of Characteristic Fruits and Vegetables, Hubei
Engineering University, Xiaogan, Hubei 432000, China)
Abstract:In the process of development,plants release a large number of volatile organic compounds(VOCs),which are lipophilic compounds with low molecular weight. VOCs are involved in plant signal communication,pollination,biotic and abiotic stress response. As the cause of floral fragrance,VOCs also affect the flavor and quality of fruits and processed products. This paper mainly summarized the VOCs synthetic pathway classification and biosynthesis tissues,catalytic characteristics and factors for its synthesis(genetic background,different growth stages and plant tissues,environmental factor),role and mechanism of stress responsible in plants(direct and indirect defense,improvement of the ability for stress),methods of genetic engineering in the regulation of VOCs(introduction of exogenous gene,improvement the expression of biosynthesis gene and repression of endogenous gene). Meanwhile,this review pointed out the instability of the product and uncertain effect for genetic engineering. Proposed that basic research should be strengthened such as reduction of non-essential VOCs,the mechanism of interaction between VOCs and other secondary metabolites, post-synthesis modification. In addittion,the effect on the quality of agricultural product and the trend for improvement of the ability for stress when taking advantage of VOCs were discussed. Those researches provided theoretical reference for VOCs study and application.
Key words: volatile organic compounds; biosynthesis; stress response; gene engineering
Foundation item: Hubei Technology Innovation Special Project(2018ABA098); Research Project of Hubei Provincial Department of Education(Q20202702)
0 引言
植物挥发性有机化合物(Volatile organic compounds,VOCs)是一类通过植物次生途径产生的亲脂性小分子化合物,具有沸点低、蒸气压高及挥发性强等特点(Abbas et al.,2017),以上特征有助于VOCs向周围环境释放并扩散。目前研究认为VOCs参与植物组织内部、植物间及植物与昆虫间的信号交流(?impraga et al.,2016;Kong et al.,2018),参与植物授粉(Hoe et al.,2016),减轻或避免外界生物对植物造成的伤害(Kos et al.,2013;Li et al.,2019;Chen et al.,2020a),提高植物对非生物逆境胁迫抵御能力(Song et al.,2018;Zhao et al.,2020)等重要生命过程。作为形成植物花香的关键因素(Johnson et al.,2016;Han et al.,2019;Tian et al.,2019),VOCs对于植物特别是花卉的经济价值起着重要作用,正是VOCs在含量和种类的差异形成植物各具特色的香味,以满足人们的不同喜好。同时,VOCs参与并影响果实芳香及其加工产品风味的形成(Mastello et al.,2015;Wang et al.,2016;Bianchi et al.,2017)、影响茶的加工和最终品质(Zhou et al.,2017;Chen et al.,2020b)等。随着生活水平的不断提高,人们对天然健康风味物质的要求日益增多,利用天然VOCs制作香料、精油和香水等方式也备受关注。近年来,检测手段的更新、生物技术分析手段的多元化及人们日益增长的需求促使对VOCs的研究更加广泛和深入,VOCs在植物中的功能和潜在的农业应用前景得到进一步明确。本研究重点总结VOCs的分类、合成部位和特点,影响合成的因素,VOCs如何参与到植物应对各种生物和非生物胁迫中,同时探讨目前对于VOCs的基因调控手段及存在的问题,并对其基础理论研究和潜在的农业用途趋势进行讨论,以期为VOCs的下一步研究提供理论参考。
1 VOCs的生物合成
1. 1 VOCs的合成途径分类
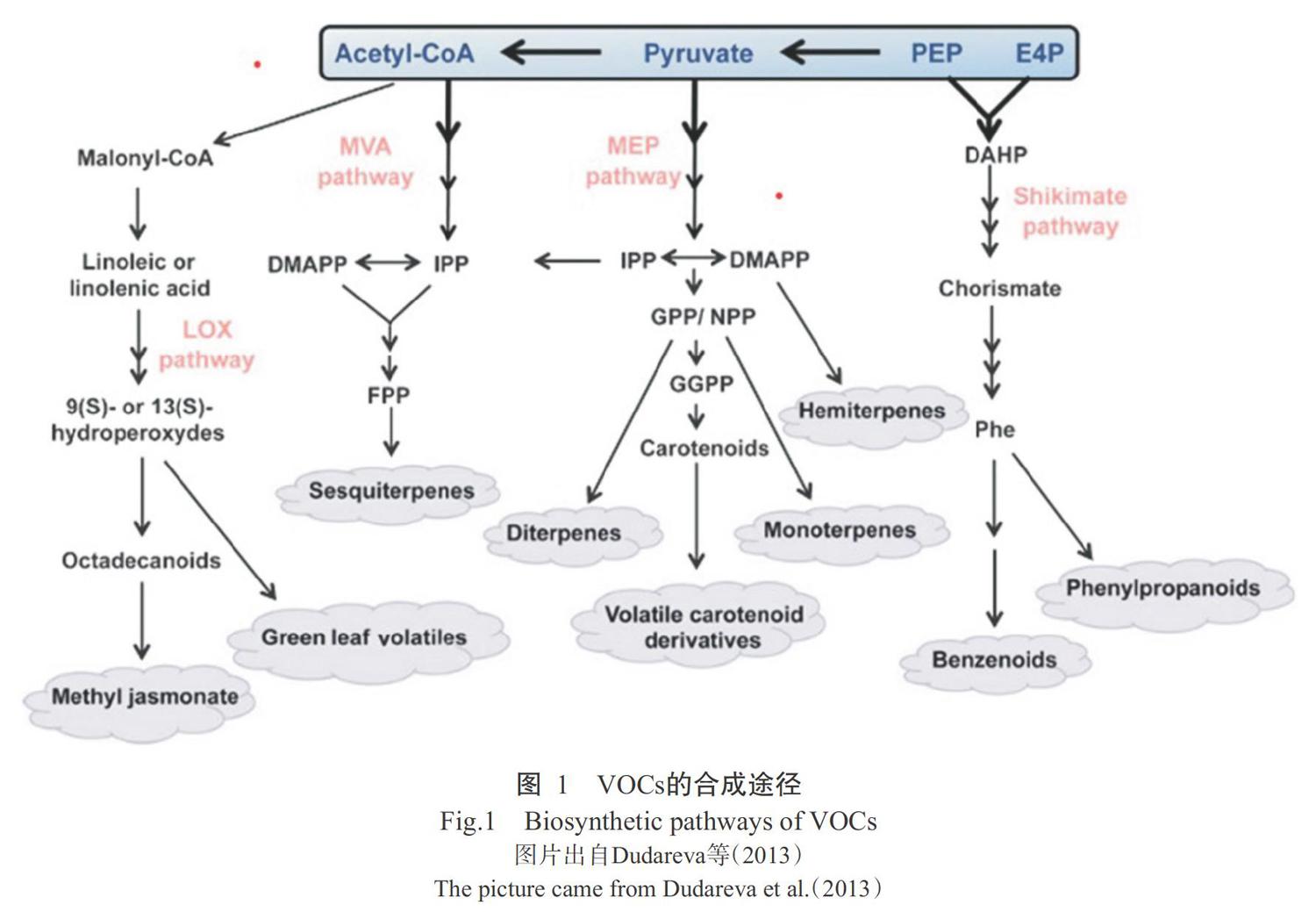
目前,已鉴定的VOCs种类超过1700种,覆盖90种不同植物家族(Dudareva et al.,2013)。根据植物体内生物合成途径的不同,VOCs主要分为三大类(图1):萜类、类苯基丙烷/苯环型和脂肪酸衍生物,其他少数部分则由支链氨基酸衍生而来(Abbas et al.,2017)。VOCs中萜类最多,其中单萜和倍半萜烯研究最广泛和深入(Abbas et al.,2017)。萜类拥有2条合成途径:甲羟戊酸(Mevalonic acid,MVA)途径和甲基赤藓糖醇磷酸(Ethylerythritol phosphate,MEP)途径,MVA途径合成的产物为倍半萜烯,MEP最终合成的挥发性物质为单萜和二萜,其中单萜占整个挥发性萜类的比例超过50%,以上2条不同的生物合成途径通过中间产物IPP(Isopentenyl diphosphate)从质体向细胞质的“流通”而联系在一起(Dudareva et al.,2013;Abbas et al.,2017)。类苯基丙烷/苯环型是第二大类植物VOCs,利用莽草酸酯(Shikimate)途径产生的芳香族氨基酸苯丙氨酸(Phe)为原料进行生物合成,该过程发生在质体内,根据碳骨架结构又可分为3个子类:类苯基丙烷类(包括1个C6-C3骨架)、类苯基丙烷类相关化合物(C6-C2)和苯环型(C6-C1)(Muhlemann et al.,2014)。脂肪酸衍生物类是以亚油酸和亚麻酸为前体,在脂氧合酶(Lipoxygenase,LOX)催化下开始合成,这类VOCs通常自带绿叶味道,又称GLVs(Green leaf volatiles)。
1. 2 VOCs的合成和释放部位
植物表面有特殊结构承担着VOCs的合成和释放功能,包括腺毛、脂腺和腺体等,不同植物在这些结构形态上存在一定差异(Han et al.,2019;Hua et al.,2020)。植物营养组织中的VOCs通常储存在与草食动物接触而破裂的体表腺体中(Pichersky and Gershenzon,2002),有助于植物组织在破损后快速释放VOCs。但并非所有植物都具有以上结构,如桂花没有典型的分泌结构,整个花瓣充当芳香腺的作用,花瓣细胞有向外突出结构且表面有高度规则的刷状毛,这些特殊的结构用于VOCs的合成和释放,因此花瓣表面这些特殊结构的数量可反映不同桂花品种合成VOCs的能力(Han et al.,2019)。
1. 3 VOCs的合成特点
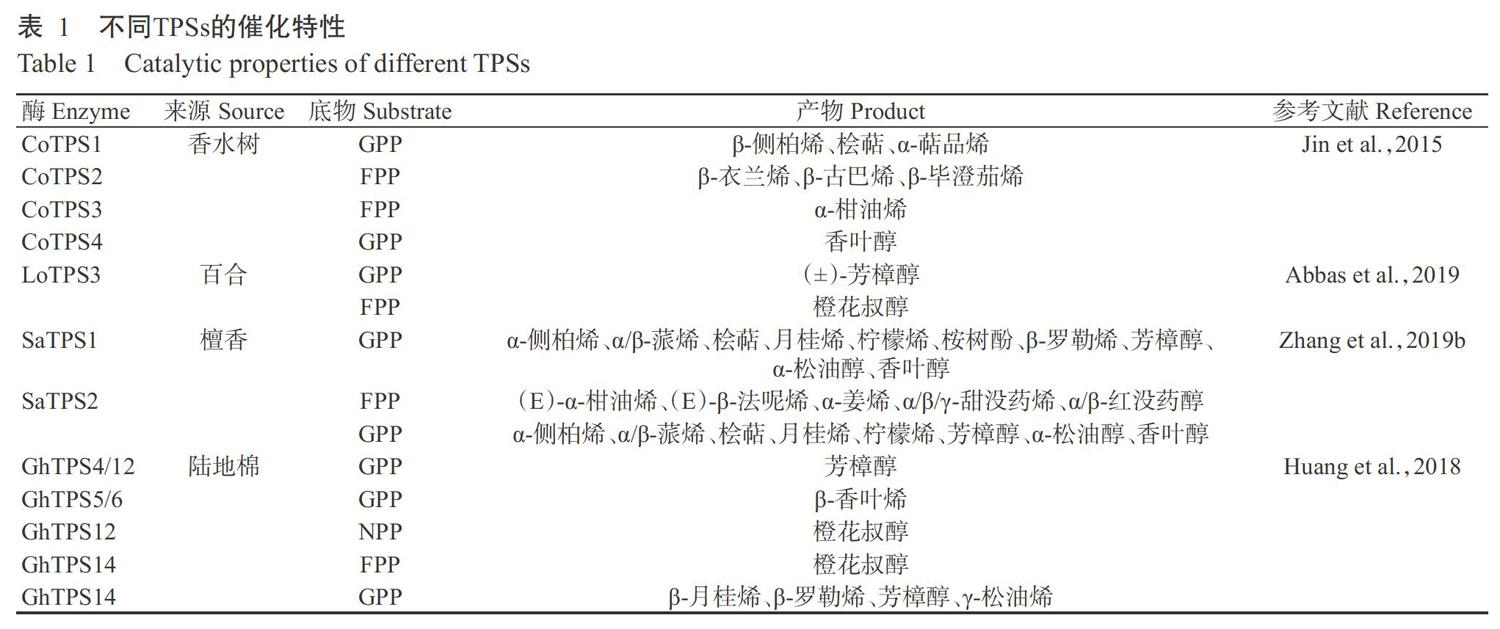
1. 3. 1 催化多样 除了合成途径的多样性外,催化酶的功能多样性也是产生不同特征VOCs的重要原因,其中萜烯合酶(Terpene synthases,TPSs)的作用最突出。TPSs是萜类VOCs生物合成途徑中的最后一个催化酶,研究发现拟南芥利用2个TPSs(TPS21和TPS11)就能合成体内约20种倍半萜烯产物(Tholl et al.,2005),体现了这类酶强大的催化能力。TPSs的突出催化特性主要体现在:TPSs可利用相同底物形成差异产物,还能接受不同底物进行催化形成具有不同特征的产物,且植物体内不同TPSs催化产物也有明显差异(表1)。
1. 3. 2 合成后修饰 对于不少植物来说,VOCs合成途径最后一步的完成并不意味着整个合成结束,VOCs通常还会被修饰进一步加工。修饰后的VOCs可产生相反的效果,VOCs在合成后可被羟基化、脱氢和酰化等,以上修饰有助于提高VOCs的挥发性,同时改变其香味特性(Dudareva et al.,2013;Muhlemann et al.,2014),而糖基化修饰使VOCs丧失香味,以非挥发性状态(Glycosidically bound volatiles,GBVs)儲存在细胞内(Song et al.,2018)。植物细胞内糖基化的修饰程度差异明显,柑橘果皮中共鉴定出56种VOCs的糖基化产物,明显多于草莓(11种)和番茄(21种)(Gao et al.,2018)。另外,能被糖基化的成分并非均以糖基化形式存在细胞中,如桃子中的芳樟醇大部分以挥发性状态存在,40%为GBVs形式(Wu et al.,2019)。在合适的条件下,GBVs可被糖苷酶催化恢复到其挥发性结构(Song et al.,2018;Zhao et al.,2020)。
2 影响VOCs合成的因素
2. 1 遗传背景差异
遗传背景差异对VOCs的影响主要是针对同种植物的不同品种,这些品种通常在VOCs成分和含量上存在明显差异。薄皮甜瓜白玉满堂和网纹甜瓜C51的香气成分虽然均以脂类为主,但前者只检测到54种成分,后者则多达92种(赵光伟等,2015)。不同品种的猕猴桃果实中萜类VOCs含量相差超过140倍(Nieuwenhuizen et al.,2015)。张涵等(2017)检测4种不同柑橘果实的香气成分,VOCs成分和含量不完全相同,且都具有各自的特有成分。在46种百合中只检测到1种共有成分——苯甲酸甲酯,但百合中VOCs差异形成了6组不同类型的香味,分别为淡雅、清凉、果香、麝香、水果蜂蜜和百合(Du et al.,2019)。桂花Yingui花瓣芳香成分主要为茉莉酮,Dangui花瓣芳香成分则以芳樟醇及其氧化物为主(Han et al.,2019)。
遗传背景差异可从基因和蛋白等不同水平得到体现。邻氨基苯甲酸甲酯MA赋予葡萄特殊的foxy香气,甲醇酰基转移酶AMAT是形成foxy香气的关键因素,在超过1300种葡萄中验证发现:AMAT基因启动子中缺少1个426 bp、1个42 bp或同时缺失以上2个序列与AMAT基因的高表达和MA大量积累高度相关(Yang et al.,2020)。类似现象在百合中也存在,不同的是导致单萜类物质合成差异的原因与TPSs基因中第230位点的突变相关(Du et al.,2019)。在茶树中还发现萜烯合酶基因CsLIS/NES 2种剪切体(CsLIS/NES-1/2)的出现,导致CsLIS/NES-1/2的定位发生改变,从而出现不同的催化产物(Liu et al.,2018)。葡萄果香的组成和浓度在很大程度上取决于遗传背景,我国种植的酿酒葡萄与美洲葡萄的杂交品种成熟时主要香气物质为乙酸乙酯、丁酸乙酯等脂类,这些成分在酿酒葡萄发育早期才能检测到或在整个发育时期基本检测不到,以上现象可能是由于酿酒葡萄品种中醇酰基转移酶活性AAT缺失所导致(Ji et al.,2019)。
2. 2 不同的生长阶段和部位
就植物本身而言,总的VOCs合成趋势与其发育过程相一致。一般认为发育早期(未张开的叶片、未成熟的果实和授粉前的花朵)合成和释放的VOCs少,待果实成熟、花朵开放及授粉时等达到最高峰,之后则大幅减少(Abbas et al.,2017)。这种合成模式既有利于满足植物在授粉和繁殖时对VOCs的需求,又能避免过多的VOCs吸引无用昆虫或植食者后对自身造成的伤害。需要说明的是,并非VOCs中所有成分都与植物发育保持一致,王洁等(2018)研究发现茶梅冬玫瑰的4个不同时期(花蕾期、初花期、盛花期和末花期)中,芳香烃类相对含量呈先降低后升高的变化趋势,醇类和烯类则呈完成相反的变化趋势,苯乙酮和芳樟醇氧化物随着花朵生长持续升高,末花期含量达峰值。尽管植物各组织都能合成VOCs,但花朵被认为是合成和释放VOCs总量最多的部位(Muhlemann et al.,2014),因为花朵释放足够的VOCs能有效吸引昆虫等进行授粉,是保证植物繁殖成功的关键因素。不同组织间的VOCs差异除了含量外,还体现在VOCs成分上(杨再波和杨冰,2011),与植物不同器官承担的功能有关。研究发现,黄瓜的根、花朵和果肉中均有组织特异性TPSs,结合TPSs特殊的催化特性,也充分说明为什么能在黄瓜不同部位检测到特异性VOCs(Wei et al.,2016)。
2. 3 外界环境因素
植物生长处于一个不稳定的外界环境中,VOCs作为植物合成的重要次级代谢产物,外界环境是导致其发生改变的重要因素之一,主要包括光照、温度和各类胁迫。对于植物而言,光照改变直接影响植物细胞的光合作用,从而引起包括VOCs在内的大量代谢物发生改变。研究发现,减少光照可显著提高茶叶中类苯基丙烷/苯环型这类VOCs的含量(Yang et al.,2012),可能是由于光照减弱导致茶叶光合作用中有机物积累减少,促使细胞内蛋白分解加快,增加Phe等氨基酸的积累,为类苯基丙烷/苯环型这类VOCs的合成提供充足原料。套袋是果实栽培常用的技术措施,对葡萄和桃子进行套袋处理能显著改变VOCs,充分体现光照对VOCs的影响(Wang et al.,2010;Shen et al.,2014;Ji et al.,2019)。套袋处理对不同果实VOCs影响的程度还与套袋颜色相关(Ji et al.,2019),考虑到光照对VOCs合成的影响,可能是由于不同参数的袋子影响植物对光照的吸收。
温度过高或过低均会形成胁迫环境,此时VOCs的快速合成则与其参与植物非生物胁迫应对有关(Zhou et al.,2017)。值得注意的是,温度对VOCs的影响促进了植物对于VOCs的合成,也可能是温度的升高加快这类物质的挥发,进而更有效地被检测或感知到。植物利用VOCs在抑菌和信号传导等方面的作用,进化形成了一套以VOCs为基础的应对和调控机制,因此机械损伤、干旱、病原菌侵害和植食者啃食等生物或非生物胁迫均能影响植物VOCs的合成(Loreto and Schnitzler,2010;Zhou et al.,2017;Li et al.,2019;Zhao et al.,2020)。逆境胁迫条件对植物VOCs的影响包括2个方面:改变已合成成分的含量和诱导合成正常生长条件下不产生的成分(Huang et al.,2018)。此外,光照中的UV-B/C可作为胁迫因子分别影响桃子和草莓中芳樟醇及法呢烯的合成(Liu et al.,2017;Xu et al.,2019)。
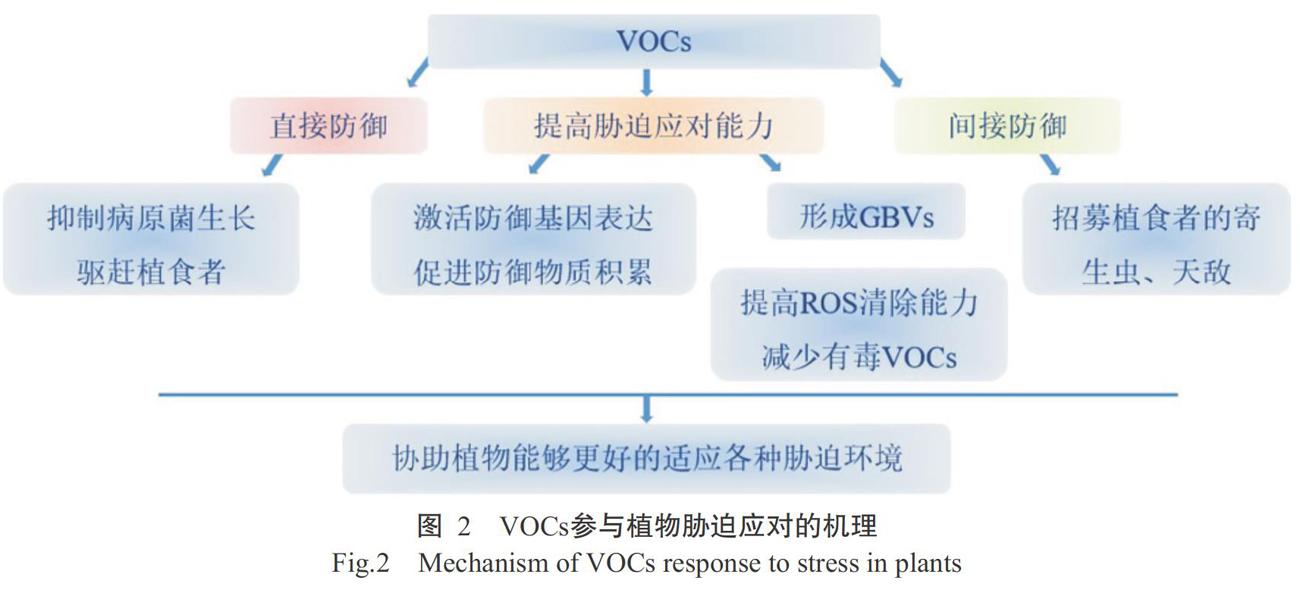
3 VOCs在植物应对胁迫中的作用
VOCs可通过多种途径参与到植物应对胁迫环境中(图2),不同植物采取的方式有所差异。在直接防御中,植物利用VOCs抑制病原菌生长和驱赶害虫,VOCs可吸引植食者的寄生生物或天敌,从而达到间接防御的目的。同时,这类物质能有效激活防御基因的表达,促进防御化合物积累,并加快清除有害成分。
3. 1 直接防御
体外试验发现芳樟醇、水杨酸甲酯、香叶醇、苯甲醇和2-苯乙醇等表现出较强的抗细菌和抗真菌活性(Shimada et al.,2014),经Z-3-己烯醇处理后的番茄能降低粉虱在其叶片上的生存能力,进一步减弱番茄黄化曲叶病毒(TYLCV)借助粉虱进行传播的能力(Su et al.,2020)。Shimada等(2017)将外源的芳樟醇合成基因CuSTS3-1导入到对柑桔黄单孢菌敏感的柑橘品种后可提高转基因植物的抗性,转基因植株叶片上该病原菌的生长受到明显抑制。植物花朵营养丰富、水分充足,昆虫访花频度高,易受病原菌的侵袭,在拟南芥中超量表达(E)-β-石竹烯合成酶基因TPS21后,产生的(E)-β-石竹烯能有效抑制丁香假单胞菌的生长,减少病原菌对拟南芥花朵的伤害(Huang et al.,2012)。将棉花中的GhTPS12转入烟草后产生预期的目的产物——(3S)-芳樟醇,并提高对棉铃虫和桃蚜2种不同摄食行为害虫驱避能力,抗虫能力更强的转基因烟草能抑制棉铃虫产卵和减少桃蚜对叶片的啃食(Huang et al.,2018)。拟南芥中的芳樟醇同样对桃蚜具有直接驱赶作用,蚜虫更偏好产生芳樟醇含量少的野生型拟南芥(Aharoni et al.,2003),将草莓中的萜烯合酶基因FaNES1在拟南芥中超量表达,转基因材料产生比野生型更强的驱赶效应(Kos et al.,2013)。
3. 2 间接防御
间接防御的方式在植物中非常常见。当拟南芥受到粉虱攻击时快速激活体内的水杨酸(Salicylic acid,SA)信号传导途径,诱导产生的大量月桂烯能吸引粉虱的寄生物,从而达到抑制粉虱生长的目的(Zhang et al.,2013)。除虫菊的花朵开放时释放一种特殊的警报信息素——(E)-β-法呢烯(EbF),这种VOCs能吸引蚜虫的天敌瓢虫,使其充当除虫菊的“护花使者”(Li et al.,2019)。通过人为调控,改变植物释放的VOCs能有效提高转基因材料对害虫天敌的吸引力,从而抑制这些有害生物的生长。害虫二化螟严重危害水稻生长,青豆中的PlTPS3和PlTPS4能在水稻中正常表达并催化产生(S)-芳樟醇,(S)-芳樟醇能提高转基因水稻对二化螟天敌(二化螟绒茧蜂)的吸引力,从而增强对二化螟的抵御能力(Li et al.,2018)。
3. 3 提高植物应对胁迫的能力
3. 3. 1 储备防御物质 植物受到植食者攻击时,诱导产生大量的VOCs又称HIPVs(Herbivore-induced plant volatiles)(Huang et al.,2018)。HIPVs可快速激活植物体内的茉莉酸(Jasmonic acid,JA)途径,诱导防御基因大量表达,同时向未受损组织或邻近植物中发出即将受到攻击的信号,促使植物提前做好应对准备(Taniguchi et al.,2014;Chen et al.,2020a)。在番茄中发现JA也可快速诱导毛状体中TPS1、TPS5和TPS12基因的表达,进而提高2-蒈烯、β-水芹烯和α-蛇麻烯含量(Hua et al.,2020),外源添加JA等植物激素能高效促进VOCs合成(Taniguchi et al.,2014),植物激素与VOCs间的正反馈调节有助于提高植物通过VOCs积累防御物质的能力。E-橙花叔醇是茶树主要的防御性VOCs,该物质能在激活JA和脱落酸(Bscisic acid,ABA)信号通路后,促使茶树储备苯丙氨酸氨裂解酶、几丁质酶和多酚氧化酶等防御相关的化合物,同时大量积累的木质素有助于茶树通过增强物理屏障的方式减少有害昆虫和病原菌对植物的伤害(Chen et al.,2020a)。地瓜产生的(E)-4,8-二甲基-1,3,7-壬三烯(DMNT)诱导植物产生的防御物质还包括有毒代谢物——蛋白酶抑制剂(Meents et al.,2019)。
3. 3. 2 清除有害物质 活性氧(Reactive oxygen species,ROS)的大量积累是植物在非生物胁迫条件下常见的不良后果,诱导抗氧化机制进行ROS清除是保护细胞的重要途径(Hazman et al.,2015)。植物能以VOCs为媒介,通过糖基化修饰后改變VOCs的特征,增强植物对ROS的清除能力。低温胁迫下茶树加快橙花叔醇的糖基化,使修饰后的橙花叔醇具有更强的抗氧化和清除ROS能力,从而增强茶树的抗寒性(Zhao et al.,2020)。此外,为确保植物提供足够的VOCs而不毒害自身,植物细胞还可利用对VOCs的糖基化将其转变为无挥发性、无毒的糖苷形式保存于细胞内,糖基化的清毒机制对于由火灾和杀虫剂等形成的外源有毒VOCs同样适用(Song et al.,2018)。
4 VOCs的基因调控
4. 1 调控VOCs的方式
4. 1. 1 导入外源基因 将外源基因导入到烟草、拟南芥等模式植物中是基因工程上常用的操作手段。棉花GhTPS12基因在烟草中的表达使烟草中检测到大量野生型中不存在的(3S)-芳樟醇(Huang et al.,2018)。烟草中超量表达猕猴桃MEP途径中单个或多个合成基因,均能显著提高芳樟醇、异松油烯和松萜等萜类物质的含量,同时提高多个基因表达量所产生的效果高于单个基因(Nieuwenhuizen et al.,2015)。将草莓中的萜烯合酶基因FaNES1导入拟南芥中表达能产生符合预期的目的产物(Kos et al.,2013)。Jin等(2015)将香水树MVA途径中的CoTPS2和CoTPS2基因在烟草中超量表达时并未产生目的产物,但与该途径的3-羟基-3-甲基戊二酸单酰辅酶A还原酶AtHMGR基因共表达时,烟草叶片中分别产生β-衣兰烯、β-古巴烯、β-毕澄茄烯和α-柑油烯。由于HMGR基因为MVA途径中的限速酶,将该基因导入到烟草后可能通过解除底物缺乏的限制保证转基因烟草能合成目的产物。番茄中导入外源的萜烯合酶基因LIS后,转基因番茄不仅按照预期发生VOCs改变,还不影响番茄的其他表型(Lewinsohn et al.,2001)。
4. 1. 2 提高自身基因表达 对于转基因体系成熟的植物来说,直接提高自身基因的表达量能避免缺少底物等问题,更直接地判断基因功能是否符合预期。甜橙的CitTPS16催化产生E-香叶醇,超量表达CitTPS16基因后,转基因植物的果皮和叶片中香叶醇显著高于空白对照(Li et al.,2017)。除了合成基因外,利用调控因子同样能达到改变VOCs的目的。草莓中的2,5-二甲基-4-羟基-3(2H)-呋喃酮(HDMF)是影响其果香的主要成分,醌氧化还原酶FaQR蛋白为HDMF合成途径中的最后一个催化酶,FaQR基因的表达受乙烯反应因子FaERF#9的正调控,研究表明FaERF#9基因表达量的提高可促进FaQR基因高表达,转基因草莓中HDMF含量提高了近10倍(Zhang et al.,2018)。
4. 1. 3 抑制内源基因表达 除了提高VOCs合成基因的表达量外,还抑制内源基因表达,改变植物细胞内的物质合成和代谢流向,同样能达到调控VOCs的目的。矮牵牛中BPBT以苯甲酰辅酶A和苯甲醇为底物生成苯甲酸甲酯,利用RNAi干扰技术沉默矮牵牛中的BPBT基因时,在不影响其他VOCs 成分的前提下让植物丧失合成苯甲酸甲酯的能力(Orlova et al.,2006)。此外,降低矮牵牛花中ODORANT1(ODO1)基因的表达同样可达到抑制VOCs合成的目的(Verdonk et al.,2005)。反义抑制康乃馨中的黄酮3-羟化酶F3H基因的表达,封锁花青素合成的同时有效提高了苯甲酸甲酯含量,转基因植株香气明显优于对照(Zuker et al.,2002),以上结果对于同时进行植物花色和花香的改良具有重要意义。
4. 2 基因调控存在的问题
4. 2. 1 目的产物的不稳定性 目的产物的不稳定性是调控VOCs面临的主要问题之一,以芳樟醇为例进行说明。芳樟醇是一类重要的单萜类VOCs,开花期间植物花器官释放大量芳樟醇用于吸引昆虫协助授粉,同时该物质具有抑制细菌和真菌生长的作用,在参与植物应对胁迫中发挥着重要作用(Shimada et al.,2014;Huang et al.,2018)。超量表达芳樟醇合酶基因CuSTS3-1后转基因甜橙叶片中产生大量的挥发性芳樟醇,其含量为野生型的10倍以上(Shimada et al.,2017),然而拟南芥中超量表达该基因后生成的产物大部分以非挥发性的糖基化产物和羟基化衍生物存在(Aharoni et al.,2003),转基因矮牵牛中合成的芳樟醇在内源糖基转移酶的催化下则全部转化为GBVs形式(Lücker et al.,2001)。VOCs作为形成植物花香的关键因素,导入或提高VOCs合成相关基因是进行花香品质改良的直接和有效手段。由于底物限制等因素,并非所有转基因植株都能产生对应的产物,即使植物能合成所需要的目的产物,部分VOCs含量的提高也并未达到人所能感知的程度(Jin et al.,2015)。因此,考虑包括VOCs在内的次生代谢物在生物合成过程中的多样性和复杂性,在如何提高目的产物合成的同时减少非必要产物的积累是基因工程调控VOCs必须克服的问题。另外,相同基因在不同植物间表达时产物会发生改变(Li et al.,2018),进而增加基因调控VOCs的难度。
4. 2. 2 效果的不确定性 植物花朵释放的VOCs既需要吸引足够的授粉者,又要避免过多植食者带来的危害。番茄释放的β-水芹烯、α-蒎烯、对异丙基甲苯和(+)-2-蒈烯等成分能有效驱赶植食者,然而这些物质同样对授粉者蜜蜂“不友好”(Abbas et al.,2017),若通过基因工程方式进行改良,提高上述物质含量可能导致番茄无法正常完成授粉并结实,如何平衡防御和授粉的不兼容性也增加了定向改变VOCs的不确定性。尽管不少转基因植物能有效影响VOCs含量和种类,吸引植食者的天敌,提高植物对生物胁迫的抗性,但同时可能吸引大量无用或有害的昆虫(Li et al.,2019)。过量产生的VOCs还可造成植物的非正常生长,如过量产生的芳樟醇导致转基因拟南芥出现开花延迟和叶片颜色变浅的现象(Aharoni et al.,2003)。VOCs是植物间重要的信号分子,植物能感知相邻植物释放的这一类代谢物并作出回应,对于植物共存发挥着非常重要的作用(Kong et al.,2018)。同时,植物可利用这一特性,为可能面对的不利条件提前做好应对准备,如被草食动物啃食后组织中释放的(Z)-3-己烯醇可诱导邻近植物的防御反应(Sugimoto et al.,2014)。然而,Huang等(2019)研究发现,将矢车菊与西洋蒲公英紧邻种植时,矢车菊根部释放的重要萜类物质(E)-β-石竹烯反而促进以西洋蒲公英根部为食的金龟子幼虫生长。因此,决定植物VOCs代谢工程策略时还必须考虑其对植物造成的不良影响和潜在危害。
5 展望
理想状态下,定向调控VOCs的生物合成,可达到提高花卉植物香气、增强果实芳香、提高花朵授粉效率和植物应对各种胁迫能力等目的,进而扩大改良植物在园林绿化和农业生产上的应用范围。近年来,分析手段的丰富和完善促使对VOCs的研究逐渐从简单的成分鉴定转向其合成和调控机理上。尽管存在VOCs作用途径不明确、目的产物不稳定和抑制植物生长等不良影响,但目前的研究仍证明利用VOCs进行植物改良是有效的途径。结合已取得的理论研究成果,在今后的研究中可加強以下方面的探索和研究。
5. 1 理论基础研究
5. 1. 1 减少非必需VOCs的合成 目前,对于VOCs合成主要集中在如何提高目的产物的含量。植物能产生众多的VOCs,但并非所有的VOCs都参与植物授粉及抵御外界胁迫等生命过程,部分VOCs甚至对植物细胞生长产生不良影响(Wu et al.,2019)。减少非必需或有害成分的积累同样是进行VOCs调控的途径之一,不仅有利于植物更高效地进行物质合成,还可减少多余VOCs对自身的伤害。尽管在植物中鉴定到大量VOCs,但已明确其功能的仍是少数。同种VOCs在不同植物中功能也会产生差异,如何选择可减少或不合成的成分还有诸多未知的问题需要研究。
5. 1. 2 深入探讨VOCs与其他次级代谢产物相互影响的机制 研究发现,抑制康乃馨花青素合成导致花朵变白,转基因植株苯甲酸甲酯含量显著提高(Zuker et al.,2002),可能是由于花青素和苯甲酸甲酯具有部分相同的合成途径(shikimate途径),当花青素合成通路被阻断后促使合成前体大量流向类苯基丙烷/苯环型VOCs合成的下游途径,从而出现苯甲酸甲酯大量合成的现象。然而在矮牵牛花中通过MYB转录因子ODO1减少shikimate途径前体的合成,只能影响VOCs的积累,并不改变转基因植株的花色(Verdonk et al.,2005),以上结果既说明植物次级代谢产物间的相互影响,也表明不同植物在合成和调控通路间的差异。VOCs的改变可同时引起植物细胞内其他代谢物改变,导致预期外的后果,因此充分了解这些次级代谢物的合成流向,才能高效准确地调控VOCs,促使有用产物大量产生,并避免其他代谢物改变导致的副作用。
5. 1. 3 重视合成后修饰对VOCs的影响 一方面,细胞内的甲基化、乙酰化等修饰可增强VOCs的挥发性或改变其对人的嗅觉特性,产生积极效应;另一方面,糖基化等修饰可消除VOCs挥发性,转变为GBVs(Dudareva et al.,2013;Song et al.,2018)。尽管GBVs的产生减少了VOCs含量,但糖基化在植物解毒、贮藏和物质运输等方面发挥着重要作用(Chen et al.,2020b)。低温下茶树利用GBVs提高对ROS的清除能力,当恢复至室温后,GBVs转化为橙花叔醇,该物质及其修饰产物DMNT对植物生长具有重要作用(Zhao et al.,2020)。植物花朵等细胞内储存了丰富的GBVs,这类物质可充当VOCs的储备物质(Zeng et al.,2015)。充分利用这些潜在的活性物质,可为提高植物应对胁迫的能力提供新的见解。由于VOCs的修饰对植物影响具有多面性,且不同植物体内修饰方式和程度迥异,如何充分了解并采取合适的手段进行操控还需大量深入探究。
5. 2 农业应用
5. 2. 1 VOCs改变对农产品品质的影响 果实套袋作为一项重要的技术措施,在农业种植上发挥重要作用。经套袋处理后有助于减少果实病虫害、降低农药残留和果实裂果率等(魏志峰等,2018),并能加快果实成熟(Wang et al.,2010)。套袋处理也可减少VOCs合成,导致果实风味变差(Wang et al.,2010)。另外,套袋对于植物果实风味的影响与套袋颜色等参数相关(Ji et al.,2019)。如何在保持现有农业操作优势的基础上,避免VOCs改变对果实品质的影响还有不少问题需要克服。尹燕雷等(2011)研究发现,温室栽培凯特杏释放的VOCs种类减少,但同时发现在温室培养的果实中检测到在室外条件下没有的成分,以上结果为人为操控VOCs改变果实品质并满足实际生产需求提供了新思路。
5. 2. 2 利用VOCs提高植物对胁迫的应对能力 目前大量的研究表明,VOCs在协助植物应对各类胁迫中发挥着重要作用(Taniguchi et al.,2014;Li et al.,2019;Chen et al.,2020a;Zhao et al.,2020)。通过基因工程手段提高目的VOCs的含量,轉基因植株通过有效抑制病原菌生长和提高对植食昆虫天敌吸引力等方式提高生存能力(Huang et al.,2018;Li et al.,2018)。不同植物间对于VOCs的反应有明显差异。植物受到昆虫啃食时主要依赖JA途径诱导植物进行防御,然而未受到攻击的番茄感知到周围环境释放的DMNT,利用不依赖JA途径来增加蛋白酶抑制剂SPI的含量(Meents et al.,2019)。番茄受到粉虱感染后则激活SA途径用于应对,在这个过程中被感染植株释放的HIPVs却抑制未受感染番茄中的JA途径,导致这些番茄更容易受到粉虱攻击(Zhang et al.,2019a)。除了番茄外,矢车菊中释放的(E)-β-石竹烯也对其周围生长的西洋蒲公英产生不利影响,促进以西洋蒲公英根部为食的金龟子幼虫生长(Huang et al.,2019)。VOCs在植物应对各种不利条件下产生的不良影响是需要明确的问题,也为有效利用VOCs进行作物改良带来了一定挑战。
参考文献:
王洁,李辛雷,殷恒福,范正琪,李纪元. 2018. 茶梅品种‘冬玫瑰不同花期及花器官的香气组成成分分析[J]. 植物资源与环境学报,27(1):37-43. doi:10.3969/j.issn.1674-7895.2018.01.05. [Wang J,Li X L,Yin H F,Fan Z Q,Li J Y. 2018. Analysis on aroma components of Camellia sasanqua ‘Dongmeigui at different flowering stages and floral organs[J]. Journal of Plant Resources and Environment,27(1):37-43.]
魏志峰,李秋利,高登涛,杨文佳,刘军伟,韩园园. 2018. 果实套袋对果实品质影响研究进展[J]. 江苏农业科学,46(24):36-41. doi:10.15889/j.issn.1002-1302.2018.24.008. [Wei Z F,Li Q L,Gao D T,Yang W J,Liu J W,Han Y Y. 2018. Research progress on effect of fruit bagging on fruit quality[J]. Jiangsu Agricultural Sciences,46(24):36-41.]
杨再波,杨冰. 2011. 黔产大叶樟叶片和果实中香味化学成分分析[J]. 北方园艺,(15):68-70. [Yang Z B,Yang B. 2011. Analysis of the aroma of chemical composition from the leaves and fruits of Cinnamomum parthenoxylon(Jack) Nees[J]. Northern Horticulture,(15):68-70.]
尹燕雷,苑兆和,冯立娟,招雪晴,王金政,王超. 2010. 不同栽培条件下凯特杏果实发育过程中香气成分的GC/MS分析[J]. 林业科学,46(7):92-98. [Yin Y L,Yuan Z H,Feng L J,Zhao X Q,Wang J Z,Wang C. 2010. GC/MS analysis of aromatic components in Katy apricot fruit in various developmental periods under different cultivation condition[J]. Scientia Silvae Sinicae,46(7):92-98.]
张涵,鲁周民,王锦涛,郭旭. 2017. 4种主要柑橘类香气成分比较[J]. 食品科学,38(4):192-196. doi:10.7506/spkx1002-6630-201704031. [Zhang H,Lu Z M,Wang J T,Guo X. 2017. Comparative aroma components of fruits of four main citrus varieties[J]. Food Science,38(4):192-196.]
趙光伟,徐志红,孔维虎,张健,徐永阳. 2015. 3个甜瓜品种果实香气成分的 HS-SPEM/GC-MS比较分析[J]. 果树学报,32(2):259-266. doi:10.13925/j.cnki.gsxb.20140220. [Zhao G W,Xu Z H,Kong W H,Zhang J,Xu Y Y. 2015. Analysis of aromatic compounds in three melon cultivars (Cucumis melo L.) by solid phase microextracion with GC-MS[J]. Journal of Fruit Science,32(2):259-266.]
Abbas F,Ke Y G,Yu R C,Fan Y P. 2019. Functional characterization and expression analysis of two terpene syntha-ses involved in floral scent formation in Lilium ‘Siberia[J]. Planta,249(1):71-93. doi:10.1007/s0042 5-018-3006-7.
Abbas F,Ke Y G,Yu R C,Yue Y C,Amanullah S,Jahangir M M,Fan Y P. 2017. Volatile terpenoids:Multiple functions,biosynthesis,modulation and manipulation by genetic engineering[J]. Planta,246(5):803-816. doi:10.1007/ s00425-017-2749-x.
Aharoni A,Giri A P,Deuerlein S,Griepink F,de Kogel W J,Verstappen F W A,Verhoeven H A,Jongsma M A,Schwab W,Bouwmeester H J. 2003. Terpenoid metabolism in wild-type and transgenic Arabidopsis plants[J]. The Plant Cell,15(12):2866-2884. doi:10.1105/tpc.016253.
Bianchi T,Weesepoel Y,Koot A,Iglesias I,Eduardo I,Gratacos-Cubarsi M,Guerrero L,Hortos M,van Ruth S. 2017. Investigation of the aroma of commercial peach(Prunus persica L. Batsch) types by Proton Transfer Reaction-Mass Spectrometry(PTR-MS) and sensory analysis[J]. Food Research International,99(1):133-146. doi:10.1016/ j.foodres.2017.05.007.
Chen S L,Zhang L P,Cai X M,Li X,Bian L,Luo Z X,Li Z Q,Chen Z M,Xin Z J. 2020a. (E)-Nerolidol is a volatile signal that induces defenses against insects and pathogens in tea plants[J]. Horticulture Research,7(1):52. doi:10. 1038/s41438-020-0275-7.
Chen Y X,Guo X Y,Gao T,Zhang N,Wan X C,Schwab W,Song C K. 2020b. UGT74AF3 enzymes specifically catalyze the glucosylation of 4-hydroxy-2,5-dimethylfuran-3(2H)-one,an important volatile compound in Camellia sinensis[J]. Horticulture Research,7:25. doi:10.1038/s41438-020-0248-x.
Du F,Wang T,Fan J M,Liu Z Z,Zong J X,Fan W X,Han Y H,Grierson D. 2019. Volatile composition and classification of Lilium flower aroma types and identification,polymorphisms,and alternative splicing of their monoterpene synthase genes[J]. Horticulture Research,6:110. doi:10.1038/s41438-019-0192-9.
Dudareva N,Klempien A,Muhlemann J K,Kaplan I. 2013. Biosynthesis,function and metabolic engineering of plant volatile organic compounds[J]. New Phytologist,198(1):16-32. doi:10.1111/nph.12145.
Gao J,Wu B P,Gao L X,Liu H R.,Zhang B,Sun C D,Chen K S. 2018. Glycosidically bound volatiles as affected by ripening stages of Satsuma mandarin fruit[J]. Food Che-mistry,240:1097-1105. doi:10.1016/j.foodchem.2017.07. 085.
Han Y J,Wang H Y,Wang X D,Li K,Dong M F,Li Y,Zhu Q,Shang F D. 2019. Mechanism of floral scent production in Osmanthus fragrans and the production and regulation of its key floral constituents,β-ionone and linalool[J]. Horticulture Research,6(1):106. doi:10.1038/s41438-019-0189-4.
Hazman M,Hause B,Eiche E,Nick P,Riemann M. 2015. Increased tolerance to salt stress in OPDA-deficient rice ALLENE OXIDE CYCLASE mutants is linked to an increased ROS-scavenging activity[J]. Journal of Experimental Botany,66(11):3339-3352. doi:10.1093/jxb/erv142.
Hoe Y C,Gibernau M,Maia A C D,Wong S Y. 2016. Flowering mechanisms,pollination strategies and floral scent analyses of syntopically co-flowering Homalomena spp.(Araceae) on Borneo[J]. Plant Biology,18(4):563-576. doi:10.1111/plb.12431.
Hua B,Chang J,Wu M L,Xu Z J,Zhang F Y,Yang M N,Xu H M,Wang L J,Chen X Y,Wu S. 2020. Mediation of JA signaling in glandular trichomes by the woolly/SlMYC1 regulatory module improves pest resistance in tomato[J]. Plant Biotechnology Journal,19(2):375-393. doi:10.1111/pbi.13473.
Huang M S,Sanchez-Moreiras A M,Abel C,Sohrabi R,Lee S,Gershenzon J,Tholl D. 2012. The major volatile organic compound emitted from Arabidopsis thaliana flowers,the sesquiterpene (E)-β-caryophyllene,is a defense against a bacterial pathogen[J]. New Phytologist,193(4):997-1008. doi:10.1111/j.1469-8137.2011.04001.x.
Huang W,Gfeller V,Erb M. 2019. Root volatiles in plant-plant interactions II: Root volatiles alter root chemistry and plant-herbivore interactions of neighbouring plants[J]. Plant Cell and Environment,42(6):1964-1973. doi:10.1111/pce.13534.
Huang X Z,Xiao Y T,K?llner T G,Jing W X,Kou J F,Chen J Y,Liu D F,Gu S H,Wu J X,Zhang Y J,Gao Y Y. 2018. The terpene synthase gene family in Gossypium hirsutum harbors a linalool synthase GhTPS12 implicated in direct defence responses against herbivores[J]. Plant Cell and Environment,41(1):261-274. doi:10.1111/pce. 13088.
Ji X H,Wang B L,Wang X D,Shi X B,Liu P P,Liu F Z,Wang H B. 2019. Effects of different color paper bags on aroma development of Kyoho grape berries[J]. Journal of Integrative Agriculture,18(1):70-82. doi:10.1016/S2095-3119(18)62008-8.
Jin J J,Kim M J,Dhandapani S,Tjhang J G,Yin J L,Wong L,Sarojam R,Chua N H,Jang I C. 2015. The floral transcriptome of ylang ylang(Cananga odorata var. fruticosa) uncovers biosynthetic pathways for volatile organic compounds and a multifunctional and novel sesquiterpene synthase[J]. Journal of Experimental Botany,66(13):3959-3975. doi:10.1093/jxb/erv196.
Johnson T S,Schwieterman M L,Kim J Y,Cho K H,Clark D G,Colquhoun T A. 2016. Lilium floral fragrance:A biochemical and genetic resource for aroma and flavor[J]. Phytochemistry,122:103-112. doi:10.1016/j.phytochem. 2015.11.010.
Kong C H,Zhang S Z,Li Y H,Xia Z C,Yang X F,Meiners S J,Wang P. 2018. Plant neighbor detection and allelochemical response are driven by root-secreted signaling chemicals[J]. Nature Communications,9(1):3867. doi:10. 1038/s41467-018-06429-1.
Kos M,Houshyani B,Overeem A J,Bouwmeester H J,Weldegergis B T,van Loon J J,Dicke M,Vet L E M. 2013. Genetic engineering of plant volatile terpenoids:Effects on a herbivore,a predator and a parasitoid[J]. Pest Management Science,69(2):302-311. doi:10.1002/ps.3391.
Lewinsohn E,Schalechet F,Wilkinson J,Matsui K,Tadmor Y,Nam K H,Amar O,Lastochkin E,Larkov O,Ravid U,Hiatt W,Gepstein S,Pichersky E. 2001. Enhanced levels of the aroma and flavor compound S-linalool by metabo-lic engineering of the terpenoid pathway in tomato fruits[J]. Plant Physiology,127(3):1256-1265. doi:10.1104/pp.010293.
Li F Q,Li W,Lin Y J,Pickett J A,Birkett M A,Wu K M,Wang G R,Zhou J J. 2018. Expression of lima bean terpene synthases in rice enhances recruitment of a beneficial enemy of a major rice pest[J]. Plant Cell and Environment,41(1):111-120. doi:10.1111/pce.12959.
Li J J,Hu H,Mao J,Yu L,Stoopen G,Wang M Q,Mumm R,de Ruijter N C A,Dicke M,Jongsma M A,Wang C Y. 2019. Defense of pyrethrum flowers:Repelling herbivores and recruiting carnivores by producing aphid alarm phero-mone[J]. New Phytologist,223(3):1607-1620. doi:10. 1111/nph.15869.
Li X,Xu Y Y,Shen S L,Yin X R,Klee H,Zhang B,Chen K S,Hancock R . 2017. Transcription factor CitERF71 activates the terpene synthase gene CitTPS16 involved in the synthesis of E-geraniol in sweet orange fruit[J]. Journal of Experimental Botany,68(17):4929-4938. doi:10.1093/ jxb/erx316.
Liu G F,Liu J J,He Z R,Wang F M,Yang H,Yan Y F,Gao M J,Gruber M Y,Wan X C,Wei S. 2018. Implementation of CsLIS/NES in linalool biosynthesis involves transcript splicing regulation in Camellia sinensis[J]. Plant Cell and Environment,41(1):176-186. doi:10.1111/pce. 13080.
Liu H R,Cao X M,Liu X H,Xin R,Wang J J,Gao J,Wu B P,Gao L X,Xu C J,Zhang B,Grierson D,Chen K S. 2017. UV-B irradiation differentially regulates terpene synthases and terpene content of peach[J]. Plant Cell and Environment,40(10):2261-227. doi:10.1111/pce.13029.
Loreto F,Schnitzler J P. 2010. Abiotic stresses and induced BVOCs[J]. Trends in Plant Science,15(3):154-166. doi:10.1016/j.tplants.2009.12.006.
Lücker J,Bouwmeester H J,Schwab W,Blaas J,van der Plas L H W,Verhoeven H A. 2001. Expression of Clarkia S-linalool synthase in transgenic petunia plants results in the accumulation of S-linalyl-β-D-glucopyranoside[J]. The Plant Journal,27(4):315-324. doi:10.1046/j.1365-313x.2001.01097.x.
Mastello R B,Janzantti N S,Monteiro M. 2015. Volatile and odoriferous compounds changes during frozen concentra-ted orange juice processing[J]. Food Research International,77:591-598. doi:10.1016/j.foodres.2015.10.007.
Meents A K,Chen S P,Reichelt M,Lu H H,Bartram S,Yeh K W,Mith?fer A. 2019. Volatile DMNT systemically induces jasmonate-independent direct anti-herbivore defense in leaves of sweet potato(Ipomoea batatas) plants[J]. Scientific Reports,9(1):17431. doi:10.1038/s41598-019-53946-0.
Muhlemann J K,Klempien A,Dudareva N. 2014. Floral volatiles:From biosynthesis to function[J]. Plant Cell and Environment, 37(8):1936-1949. doi:10.1111/pce.12314.
Nieuwenhuizen N J,Chen X Y,Wang M Y,Matich A J,Perez R L,Allan A C,Green S A,Atkinson R G. 2015. Natural variation in monoterpene synthesis in kiwifruit:Transcriptional regulation of terpene synthases by NAC and ETHYLENE-INSENSITIVE3-like transcription factors[J]. Plant Physiology,167(4):1243-1258. doi:10.1104/pp.114.254367.
Orlova I,Marshall-Colón A,Schnepp J,Wood B,Varbanova M,Fridman E,Blakeslee J J,Ann Peer W,Murphy A S,Rhodes D,Pichersky E,Dudareva N. 2006. Reduction in the synthesis of benzenoids in petunia flowers reveals multiple pathways to benzoic acid and an unexpected enhancement in auxin transport[J]. The Plant Cell,18(12):3458-3475. doi:10.1105/tpc.106.046227.
Pichersky E,Gershenzon J. 2002. The formation and function of plant volatiles:Perfumes for pollinator attraction and defense[J]. Current Opinion in Plant Biology,5(3):237-243. doi:10.1016/S1369-5266(02)00251-0.
Shen J Y,Wu L,Liu H R,Zhang B,Yin X R,Ge Y Q,Chen K S. 2014. Bagging treatment influences production of C6 aldehydes and biosynthesis-related gene expression in peach fruit skin[J]. Molecules,19(9):13461-13472. doi:10.3390/molecules190913461.
Shimada T,Endo T,Fujii H,Rodríguez A,Pe?a L,Omura M. 2014. Characterization of three linalool synthase genes from Citrus unshiu Marc. and analysis of linalool-mediated resistance against Xanthomonas citri subsp. Citri and Peni-cilium italicum in citrus leaves and fruits[J]. Plant Scien-ce,229:154-166. doi:10.1016/j.plantsci.2014.09. 008.
Shimada T,Endo T,Rodríguez A,Fujii H,Goto S,Matsuura T,Hojo Y,Ikeda Y,Mori I C,Fujikawa T,Pe?a L,Omura M. 2017. Ectopic accumulation of linalool confers resistance to Xanthomonas citri subsp. Citri in transgenic sweet orange plants[J]. Tree Physiology,37(5):654-664. doi:10.1093/treephys/tpw134.
?impraga M,Takabayashi J,Holopainen J K. 2016. Language of plants:Where is the word?[J]. Journal of Integrative Plant Biology,58(4):343-349. doi:10.1111/jipb.12447.
Song C K,H?rtl K,McGraphery K,Hoffmann T,Schwab W. 2018. Attractive but toxic:Emerging roles of glycosidically bound volatiles and glycosyltransferases involved in their formation[J]. Molecular Plant,11(10):1225-1236. doi:10.1016/j.molp.2018.09.001.
Su Q,Yang F B,Zhang Q H,Tong H,Hu Y,Zhang X Y,Xie W,Wang S L,Wu Q J,Zhang Y J. 2020. Defence pri-ming in tomato by the green leaf volatile(Z)-3-hexenol reduces whitefly transmission of a plant virus[J]. Plant Cell and Environment. doi:10.1111/pce.13885.
Sugimoto K,Matsui K,Iijima Y,Akakabe Y,Muramoto S,Ozawa R,Uefune M,Sasaki R,Alamgir K M,Akitake S,Nobuke T,Galis I,Aoki K,Shibata D,Takabayashi J. 2014. Intake and transformation to a glycoside of (Z)-3-hexenol from infested neighbors reveals a mode of plant odor reception and defense[J]. Proceedings of the National Academy of Sciences of the United States of Ame-rica,111(19):7144-7149. doi:10.1073/pnas.1320660111.
Taniguchi S,Hosokawa-Shinonaga Y,Tamaoki D,Yamada S,Akimitsu K,Gomi K. 2014. Jasmonate induction of the monoterpene linalool confers resistance to rice bacterial blight and its biosynthesis is regulated by JAZ protein in rice[J]. Plant Cell and Environment,37(2):451-461. doi:10.1111/pce.12169.
Tholl D,Chen F,Petri J,Gershenzon J,Pichersky E. 2005. Two sesquiterpene synthases are responsible for the complex mixture of sesquiterpenes emitted from Arabidopsis flowers[J]. The Plant Journal,42(5):757-771. doi:10.1111/ j.1365-313X.2005.02417.x.
Tian J P,Ma Z Y,Zhao K G,Zhang J,Xiang L,Chen L Q. 2019. Transcriptomic and proteomic approaches to explore the differences in monoterpene and benzenoid biosynthesis between scented and unscented genotypes of wintersweet[J]. Physiologia Plantarum,166(2):478-493. doi:10.1111/ppl.12828.
Verdonk J C,Haring M A,van Tunen A J,Schuurink R C. 2005. ODORANT1 regulates fragrance biosynthesis in petunia flowers[J]. The Plant Cell,17(5):1612-1624. doi:10.1105/tpc.104.028837.
Wang J J,Liu H R,Gao J,Huang Y J,Zhang B,Chen K S. 2016. Two ω-3 FADs are associated with peach fruit vo-latile formation[J]. International Journal of Molecular Sciences,17(4):464. doi:10.3390/ijms17040464.
Wang Y J,Yang C X,Liu C Y,Xu M,Li S H,Yang L,Wang Y N. 2010. Effects of bagging on volatiles and polyphenols in “Wanmi” peaches during endocarp hardening and final fruit rapid growth stages[J]. Journal of Food Science,75(9):S455-S460. doi:10.1111/j.1750-3841.2010.01817.x.
Wei G,Tian P,Zhang F X,Qin H,Miao H,Chen Q W,Hu Z Y,Cao L,Wang M J,Gu X F,Huang S W,Chen M S,Wang G D. 2016. Integrative analyses of nontargeted vo-latile profiling and transcriptome data provide molecular insight into VOC diversity in cucumber plants(Cucumis sativus)[J]. Plant Physiology,172(1):603-618. doi:10. 1104/pp.16.01051.
Wu B P,Cao X M,Liu H R,Zhu C Q,Klee H,Zhang B,Chen K S. 2019. UDP-glucosyltransferase PpUGT85A2 controls volatile glycosylation in peach[J]. Journal of Experimental Botany,70(3):925-936. doi:10.1093/jxb/ery419.
Xu Y Q,Charles M T,Luo Z S,Mimee B,Tong Z C,Véronneau P Y,Roussel D,Rolland D. 2019. Ultraviolet-C priming of strawberry leaves against subsequent Mycosphaerella fragariae infection involves the action of reactive oxygen species,plant hormones,and terpenes[J]. Plant Cell and Environment,42(3):815-831. doi:10.1111/pce. 13491.
Yang Y Z,Cuenca J,Wang N,Liang Z C,Sun H H,Gutierrez B L,Xi X J,Arro J,Wang Y,Fan P G,Londo J,Cousins P,Li S H,Fei Z J,Zhong G Y. 2020. A key ‘foxy aroma gene is regulated by homology-induced promoter indels in the iconic juice grape ‘Concord[J]. Horticulture Research,7:67. doi:10.1038/s41438-020-0304-6.
Yang Z Y,Kobayashi E,Katsuno T,Asanuma T,Fujimori T,Ishikawa T,Tomomura M,Mochizuki K,Watase T,Nakamura Y,Watanabe N. 2012. Characterisation of volatile and non-volatile metabolites in etiolated leaves of tea (Camellia sinensis) plants in the dark[J]. Food Chemistry,135(4):2268-2276. doi:10.1016/j.foodchem.2012.07.066.
Zeng X L,Liu C,Zheng R R,Cai X,Luo J,Zou J J,Wang C Y. 2015. Emission and accumulation of monoterpene and the key terpene synthase(TPS) associated with monoterpene biosynthesis in Osmanthus fragrans Lour[J]. Frontiers in Plant Science,6:1232. doi:10.3389/fpls.2015.01232.
Zhang P J,Wei J N,Zhao C,Zhang Y F,Li C Y,Liu S S,Dicke M,Yu X P,Turlings T C J. 2019a. Airborne host-plant manipulation by whiteflies via an inducible blend of plant volatiles[J]. Proceedings of the National Academy of Sciences of the United States of America,116(15):7387-7396. doi:10.1073/pnas.1818599116.
Zhang P J,Xu C X,Zhang J M,Lu Y B,Wei J N,Liu Y Q,David A,Boland W,Turlings T. 2013. Phloem-feeding whiteflies can fool their host plants,but not their parasi-toids[J]. Functional Ecology,27(6):1304-1312. doi:10. 1111/1365-2435.12132.
Zhang X H,Niu M Y,Teixeira da Silva J A,Zhang Y Y,Yuan Y F,Jia Y X,Xiao Y Y,Li Y,Lin F,Zeng S J,Ma G H. 2019b. Identification and functional characterization of three new terpene synthase genes involved in chemical defense and abiotic stresses in Santalum album[J]. BMC Plant Biology,19(1):115. doi:10.1186/s12870-019- 1720-3.
Zhang Y Y,Yin X R,Xiao Y W,Zhang Z Y,Li S J,Liu X F,Zhang B,Yang X F,Grierson D,Jiang G H,Klee H J,Chen K S. 2018. An ethylene response factor-MYB transcription complex regulates furaneol biosynthesis by activating quinone oxidoreductase expression in strawberry[J]. Plant Physiology,178(1):189-201. doi:10.1104/pp. 18.00598.
Zhao M Y,Zhang N,Gao T,Jin J Y,Jing T T,Wang J M,Wu Y,Wan X C,Schwab W,Song C K. 2020. Se-squiterpene glucosylation mediated by glucosyltransferase UGT91Q2 is involved in the modulation of cold stress tolerance in tea plants[J]. New Phytologist,226(2):362-372. doi:10.1111/nph.16364.
Zhou Y,Zeng L T,Liu X Y,Gui J D,Mei X,Fu X M,Dong F,Tang J C,Zhang L Y,Yang Z Y. 2017. Formation of (E)-nerolidol in tea(Camellia sinensis) leaves exposed to multiple stresses during tea manufacturing[J]. Food Chemistry,231:78-86. doi:10.1016/j.foodchem.2017.03. 122.
Zuker A,Tzfira T,Ben-Meir H,Ovadis M,Shklarman E,Itzhaki H,Forkmann G,Martens S,Neta-Sharir I,Weiss D,Vainstein A. 2002. Modification of flower color and fragrance by antisense suppression of the flavanone 3-hydroxylase gene[J]. Molecular Breeding,9(1):33-41. doi:10.1023/A:1019204531262.
(責任编辑 罗 丽)

