广西剑麻黑斑病病原菌鉴定及其生防菌筛选
王丽萍 陈涛 方石桂 施国驹 陈禄 龙凌云 黄秋伟 黄惠芳 毛立彦 谢红辉
摘要:【目的】分離、鉴定一种在广西剑麻叶片上产生圆形、近圆形或长椭圆形黑色凹陷斑块病害的病原菌,并针对该病原菌筛选具有较好防治效果的生防菌,为病害防治提供科学依据。【方法】从广西5个剑麻种植农场采集具有圆形、近圆形或长椭圆形黑色凹陷斑块的病叶,采用组织分离法分离病原菌;采用叶片针刺法接种,进行病原菌致病性测定;通过病原菌形态特征观察和分子生物学方法鉴定病原菌。采用平板对峙培养法和载玻片孢子萌发法研究哈茨木霉(Trichoderma harzianum)菌株GZ-5、深绿木霉(T. atroviride )菌株ST-1、枯草芽孢杆菌(Bacillus subtilis)菌株B11和解淀粉芽孢杆菌(B. amyloliquefaciens)菌株YZ14-3对剑麻黑斑病病原菌菌丝生长和孢子萌发的抑制效果。【结果】从病叶组织中分离出6种真菌,其中编号为JMHB1的菌株分离率最高,达96%;致病性测定结果表明菌株JMHB1为致病菌;依据形态特征和分子生物学方法,将菌株JMHB1鉴定为新暗色柱节孢(Neoscytalidium dimidiatum)。对峙培养结果显示,生防菌菌株B11和YZ14-3可显著抑制菌株JMHB1的菌丝生长(P<0.05),抑菌圈半径分别为12.14和13.22 mm,且2株生防菌株的培养滤液均可导致菌株JMHB1的菌丝隘缩、断裂;生防菌菌株ST-1和GZ-5对菌株JMHB1的拮抗系数为Ⅲ级和Ⅳ级,但其培养滤液对菌株JMHB1的菌丝无抑制作用。菌株JMHB1的孢子可在菌株YZ14-3、B11、ST-1和GZ-5的培养滤液中的萌发,萌发率分别为31.67%,32.37%,68.63%和76.63%。【结论】引起广西剑麻叶片产生圆形、近圆形或长椭圆形黑色凹陷斑块病害的病原菌为新暗色柱节孢[N. dimidiatum (Penz.) Crous & Slipper],这是我国首次报道新暗色柱节孢侵染剑麻引起黑斑病。病害名称暂定为剑麻Neoscytalidium黑斑病。剑麻生产上可选择和搭配使用解淀粉芽孢杆菌、枯草芽孢杆菌、深绿木霉及其商品制剂防治剑麻Neoscytalidium黑斑病。
关键词: 剑麻黑斑病;新暗色柱节孢;生物防治;广西
中图分类号: S432.1 文献标志码: A 文章编号:2095-1191(2021)07-1912-11
Pathogen identification and biocontrol microbes screening of sisal black spot in Guangxi
WANG Li-ping1, CHEN Tao1, FANG Shi-gui2, SHI Guo-ju3, CHEN Lu2, LONG Ling-yun1, HUANG Qiu-wei1, HUANG Hui-fang1, MAO Li-yan1, XIE Hong-hui1*
(1Guangxi Subtropical Crops Research Institute, Nanning 530001, China; 2 Guangxi State Farms Dongfang Farm Co., Ltd., Qinzhou, Guangxi 535319, China; 3 Guangxi State Farms Xinguang Farm Co., Ltd., Qinzhou, Guangxi 535400, China)
Abstract:【Objective】To isolate and identify the pathogen that caused round, subround or long oval hollow black spots on sisal leaves in Guangxi, and to screen out biocontrol microbes with better control effect on the pathogen, and provide scientific basis for the control of this disease. 【Method】The diseased leaves with round, subround or long oval hollow black spots were collected from 5 farms in Guangxi. The pathogen was isolated by tissue isolation method. The pathogenicity of pathogen was determined by leaf acupuncture inoculation. The pathogen was identified by observing morphological characteristics and molecular biological methods. The inhibitory effects of Trichoderma harzianum GZ-5, T. atroviride ST-1, Bacillus subtilis B11, B. amyloliquefaciens YZ14-3 and their filtrate on mycelial growth and spores germination of the pathogen were studied by plate confrontation culture method and slide spore germination method. 【Result】Six kinds of fungi were isolated from diseased tissues,the isolation rate of strain JMHB1 was the highest(96%). JMHB1 was the pathogenic bacteria according to the pathogenicity test, which was identified as Neoscytalidium dimidiatum based on morphological characteristics and molecular identification. Biocontrol strains B11 and YZ14-3 could significantly inhibit the mycelia growth of JMHB1(P<0.05) according to plate confrontation culture method, the radius of inhibition zone were 12.14 mm and 13.22 mm respectively, and their culture filtrates could lead to constriction and break of JMHB1 mycelia. The antagonistic coefficients of ST-1 and GZ-5 against JMHB1 were Ⅲ and Ⅳ respectively, but their culture filtrates had no inhibition effects on JMHB1 mycelia. Spores of JMHB1 could germinate in the culture filtrates of strains YZ14-3, B11, ST-1, GZ-5, the spore germination rates were 31.67%, 32.37%, 68.63%, and 76.63%, respectively. 【Conclusion】The pathogen that causes round, subround or long oval hollow black spots on sisal leaves in Guangxi is identified as N. dimidiatum (Penz.) Crous & Slipper. This is the first report of sisal black spot caused by N. dimidiatum in China. The disease is temporarily named as Neoscytalidium black spot. B. amyloliquefaciens, B. subtilis, T. atroviride and their commercial preparations can be selected and used to control Neoscytalidium black spot disease in sisal production.
Key words: sisal black spot; Neoscytalidium dimidiatum; biocontrol; Guangxi
Foundation item: National Hemp Plants Industry Technology System Construction Project(CARS-16-S14);Project of Agricultural Reclamation Bureau of Ministry of Agriculture and Rural Affairs(18210015)
0 引言
【研究意义】剑麻(Agave sisalana Perr. ex Engelm.)主要在热带地区栽培,为龙舌兰科龙舌兰属(Agave)多年生肉质旱生草本植物,也是一种具有重要经济价值的硬质叶纤维作物,其纤维被广泛应用于渔业、航海、工矿、运输、油田等行业(陈士伟和李栋宇,2016),剑麻渣可用作饲料、肥料,还可用于生物制药领域(Pereira et al.,2017)。广西、广东、海南、福建及云南等是我国剑麻主产区(汪佳滨,2016)。据统计,2018年我国剑麻种植面积约2.13万ha,纤维总产量8.17万t(孙娟等,2020)。近10年来,受病虫害和自然灾害频发以及劳动力不足等因素影响,我国剑麻种植面积总体呈下降趋势(孙娟等,2020)。病害是导致剑麻叶片产量和纤维质量下降的主要原因之一。2019年,本课题组在广西的剑麻园中发现一种叶部病害,其症状为在叶片上形成圆形、近圆形或长椭圆形黑色斑块,病部中央稍凹陷,有时有红褐色至黑色胶状分泌物,病健交界处红褐色至黄色,病斑可穿透叶片,病部叶肉组织及纤维变红褐色至黑色坏死,病部纤维易断裂,严重降低纤维的质量和商品价值。经查阅国内外剑麻病害相关文献资料,未发现有关于该类症状病害的报道。为此,分离、鉴定该病害的病原菌并筛选出对其抑制效果好的生防菌对于科学、有效防治该病害具有重要意义。【前人研究进展】20世纪60年代初开始有关于剑麻斑马纹病的报道(Clinton and Peregrine,1963)。1970年,剑麻斑马纹病在我国广东省东方红农场发生,并逐渐暴发流行(张燕梅等,2016)。从20世纪90年代至今,我国陆续有学者调查剑麻病害发生情况,记载的剑麻病害主要有茎腐病、斑马纹病、紫色卷叶病、条纹病、炭疽病、褐斑病、黑斑病、叶斑病、溃疡病、根结线虫病及各种缺素病害等(周少霞,1998;谢红辉等,2012;王会芳等,2018)。赵艳龙等(2007)描述了一种剑麻黑斑病,其主要症状为叶面散生黑色小斑点,圆形,下陷,病斑可贯穿叶片,但未说明该病害的病原种类。王会芳等(2018)报道了一种由蒂腐色二孢(Diplodia natalensis)引起的剑麻黑斑病,其主要症状为叶片上出现近椭圆形小病斑,后期病斑边缘黑褐色,中间灰白色,病斑可贯穿叶面。剑麻茎腐病的病原菌除了黑曲霉(Aspergillus niger)外,Duarte等(2018)研究发现威氏曲霉(A. welwitschiae)也能侵染剑麻引发茎腐病。剑麻茎腐病、斑马纹病和紫色卷叶病是剑麻生产上发生面积大、为害较为严重的三大病害(赵艳龙等,2020)。刘巧莲等(2010)通过菌丝生长速率法研究了55%敌克松可湿性粉剂等13种化学药剂对剑麻斑马纹病菌烟草疫霉(Phytophthora nicotianae)的抑制效果,發现68%精甲霜·锰锌可湿性粉剂、55%敌克松可湿性粉剂和70%甲基托布津可湿性粉剂的抑菌效果最好。田间试验结果表明,55%敌克松可湿性粉剂和70%甲基托布津可湿性粉剂对剑麻斑马纹病的防治效果达85%以上,可在生产上推广使用(郑金龙等,2011)。郑金龙等(2012)对比了6种杀菌剂对剑麻茎腐病的田间防治效果,发现50%咪鲜胺锰盐可湿性粉剂和10%苯醚甲环唑水分散粒剂的防治效果达60%上。剑麻紫色卷叶病由新菠萝灰粉蚧(Dysmicoccus neobrevipes)引起,研究发现通过喷施48%毒死蜱800倍液+亩旺特2800倍液控制新菠萝灰粉蚧为害,可有效降低紫色卷叶病的发病率(赵艳龙等,2020)。由于剑麻叶片的蜡质层厚,化学药剂较难附着或渗透至叶片内部,致使药效时间短。近几年来,陆续有关于剑麻病害生物防治的研究报道。秦士维(2017)研究发现,葡萄有孢汉逊酵母(Hanseniaspora uvarum)对黑曲霉菌菌丝生长的抑制效果达76%以上。Magalhaes等(2017)从沙丘落叶层中分离出16株伯克氏菌(Burkholderia sp.),其挥发性有机化合物对黑曲霉菌菌丝生长的抑制率达72%以上,参试菌株的田间防治效果达54%~76%。Barbosa等(2018)研究了类芽孢杆菌(Paenibacillus sp.)、短杆菌(Brevibacterium sp.)和芽孢杆菌(Bacillus sp.)单菌株和不同菌株联合对黑曲霉菌菌丝的抑制效果及对剑麻茎腐病的田间防治效果,结果表明,参试菌株能显著抑制黑曲霉菌的菌丝生长,降低剑麻茎腐病田间发病率44%~75%。黄雪兰等(2019)研究了哈茨木霉(Trichoderma harzianum)、深绿木霉(T. atroviride)和寡雄腐霉(Pythium oligandrum)对剑麻茎腐病病原菌黑曲霉菌的抑制效果,发现深绿木霉和哈茨木霉对黑曲霉菌菌落生长的拮抗系数分别为Ⅱ级(木霉菌丝占据平皿2/3以上)和Ⅲ级(木霉菌丝占据平皿1/3~2/3),寡雄腐霉菌菌丝能快速覆盖病原菌菌落,深绿木霉、哈茨木霉和寡雄腐霉的培养滤液能显著抑制黑曲霉菌的孢子萌发。【本研究切入点】目前,国内外尚未有关于剑麻叶片上形成圆形、近圆形或长椭圆形黑色斑块,病部中央凹陷,偶有红褐色至黑色胶状分泌物等类似症状病害的相关报道。【拟解决的关键问题】采用常规组织分离法、分离菌致病性测定、致病菌形态特征观察和分子生物学方法鉴定广西剑麻叶片黑斑病的致病菌,并采用平板对峙培养法和载玻片孢子萌发法研究4种不同生防菌对剑麻黑斑病致病菌菌丝生长和孢子萌发的抑制效果,以期筛选出抑菌效果好,能在生产上推广应用的生防菌种类,为指导剑麻种植企业有效开展该病害防治提供参考依据。
1 材料与方法
1. 1 试验材料
供试生防菌:枯草芽孢杆菌(B. subtilis)菌株B11由广西大学农学院植物保护系黎起秦教授惠赠;解淀粉芽孢杆菌(B. amyloliquefaciens)菌株YZ14-3、哈茨木霉菌株GZ-5和深绿木霉菌株ST-1由广西大学农学院植物保护系韦继光教授惠赠。供试剑麻苗:品种为H.11648,来源于广西壮族自治区亚热带作物研究所剑麻基地。
1. 2 试验方法
1. 2. 1 病原菌分离与纯化 于2019年5月先后在广西农垦红山农场有限公司、广西农垦山圩农场有限公司、广西农垦东方农场有限公司、广西农垦新光农场有限公司和广西农垦东风农场有限公司剑麻地采集带有圆形或长椭圆形黑色凹陷斑块的病叶,采用组织分离法分离病原菌(方中达,1998)。将病叶剪成约15 cm长的小段,用浸透75%酒精的脱脂棉反复擦拭叶片表面3次,然后用灭菌的解剖刀削去病部表面组织,取病健交界处的叶肉组织块(约0.5 cm×0.5 cm)置于PDA培养基上,28 ℃培养3 d,待組织块长出菌物后,立即挑取不同菌落边缘的菌丝转接至新的PDA培养基上进行培养。采用单孢分离法(董娟华等,2009)纯化各分离物。获得的纯菌株在PDA斜面试管中培养2 d后于4 ℃冰箱中保存备用。
1. 2. 2 病原菌致病性测定 将保存的菌株转接至PDA培养基上,28 ℃活化培养3 d后用于接种试验。选取长势一致的健康3龄剑麻苗作为接种对象。采用叶片针刺法接种,试验设3个处理:处理1(有伤接种),用浸透75%酒精的脱脂棉反复擦拭叶片后用无菌水冲洗,灭菌滤纸吸干叶表水分,以灭菌解剖针刺伤叶片表皮,取培养好的菌丝块,将菌丝面贴合针刺伤口处,用湿润的无菌脱脂棉覆盖在接种处,然后用无菌保鲜膜包裹好;处理2(无伤接种),叶片不做刺伤处理,直接接种菌丝块,其余操作方法同处理1;处理3(对照),用无菌琼脂块代替菌丝块接种,其余操作方法同处理1。每个菌株每处理接种5株剑麻苗(5次重复)。各处理剑麻苗放置在(28±1)℃,相对湿度约50%的环境培养5 d后观察记录发病情况。
1. 2. 3 病原菌形态特征观察和测量 分别在病原菌培养初期和后期挑取菌丝及孢子制成临时玻片,于徕卡生物显微镜下观察、测量菌丝及孢子形态、大小并拍照。
1. 2. 4 病原菌分子鉴定 用Ezup柱式真菌基因组DNA 抽提试剂盒[生工生物工程(上海)股份有限公司]提取病原菌基因组DNA,分别用ITS引物(ITS1:5'-TCCGTAGGTGAACCTGCGG-3',ITS4:5'-TCCT CCGCTTATTGATATGC-3')(White et al.,1990)和EF1-α引物(EFl-728F:5'-CATCGAGAAGTTCGAG AAGG-3',EF1-986R:5'-TACTTGAAGGAACCCTT ACC-3')(Carbone and Kohn,1999)进行PCR扩增。引物由生工生物工程(上海)股份有限公司合成。PCR反应体系20.0 ?L:10×PCR Buffer 2.0 ?L,Taq Plus DNA Polymerase(5 U/μL)0.5 ?L,正、反向引物(10 ?mol/L)各0.5 ?L,dNTP(10 mmol/L)0.5 ?L,DNA模板2.0 ?L,ddH2O 14.0 ?L。扩增程序:95 ℃预变性5 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 90 s,进行30个循环;72 ℃延伸8 min。PCR产物经1.5%琼脂糖凝胶电泳检测(150 V,100 mA,20 min)后,委托生工生物工程(上海)股份有限公司测序。利用http://www.ncbi.nlm.nih.gov/ 网站(NCBI)的BLAST程序比对分析序列。采用MEGA 5.0分析序列,利用邻接法(Neighbor-joining,NJ)构建系统发育进化树,自展数据重复抽样1000次。
1. 2. 5 生防菌对病原菌菌丝生长的影响 采用平板对峙法(张俊杰等,2019),先将供试拮抗真菌菌株和细菌菌株分别在PDA培养基和NA培养基上活化。用灭菌打孔器(直径0.5 cm,下同)取活化好的病原菌菌丝块放置在PDA培养基中央,再取同等大小的生防菌菌落块对称放置在距离病原菌菌丝块2 cm的位置,使3个菌落块成一条直线。对照以灭菌琼脂块代替生防菌菌落块。每处理5次重复,置于28 ℃培养箱中培养。培养3 d后,观察记录菌丝生长情况。
通过测量菌株B11和YZ14-3对病原菌的抑菌圈半径评价其抑菌效果。通过测定菌株GZ-5和ST-1对病原菌菌丝生长的拮抗系数评定其对病原菌菌丝生长的抑制效果。
1. 2. 6 生防菌培养滤液对病原菌菌丝生长的影响
用灭菌打孔器取活化培养的生防菌菌块转接入含有100 mL PD液体培养基的三角瓶(250 mL)中振荡培养(28 ℃,130 r/min),培养3 d后,用细菌过滤器(直径0.22 ?m)过滤除去菌体,保留滤液备用。用灭菌打孔器取病原菌菌丝块置于PDA培养基中央,在其周围不同角度2 cm处放置3片浸透生防菌滤液的滤纸片(直径0.5 cm),对照用无菌水代替生防菌滤液,每处理5次重复,于28 ℃培养箱中培养,培养3 d后观察记录菌丝生长情况。
1. 2. 7 生防菌培养滤液对病原菌孢子萌发的影响
利用1.2.6中获得的生防菌培养滤液配制病原菌孢子悬浮液(浓度约为106个/mL)。用移液枪取100.0 ?L孢子悬浮液置于干净的载玻片上,将载玻片放入垫有湿润滤纸的培养皿中于28 ℃培养箱中培养,对照用无菌水配制孢子悬浮液,每处理3次重复。培养24 h后,在显微镜下观察孢子萌发情况,每个重复随机观察200个孢子,计算萌发率。
1. 3 统计分析
试验数据采用Excel 2016和SPSS v19.0进行统计分析,应用Duncan氏新复极差法进行差异显著性检验。
2 结果与分析
2. 1 病原菌分离及致病性测定结果
从5个农场剑麻地的150个黑斑病病组织块中共分离出6种不同的菌物,依据菌落形态、颜色、大小将分离物分别编号为JMHB1、JMHB2、JMHB3、JMHB4、JMHB5和JMHB6。其中,编号为JMHB1的菌株分离率最高,达96%。
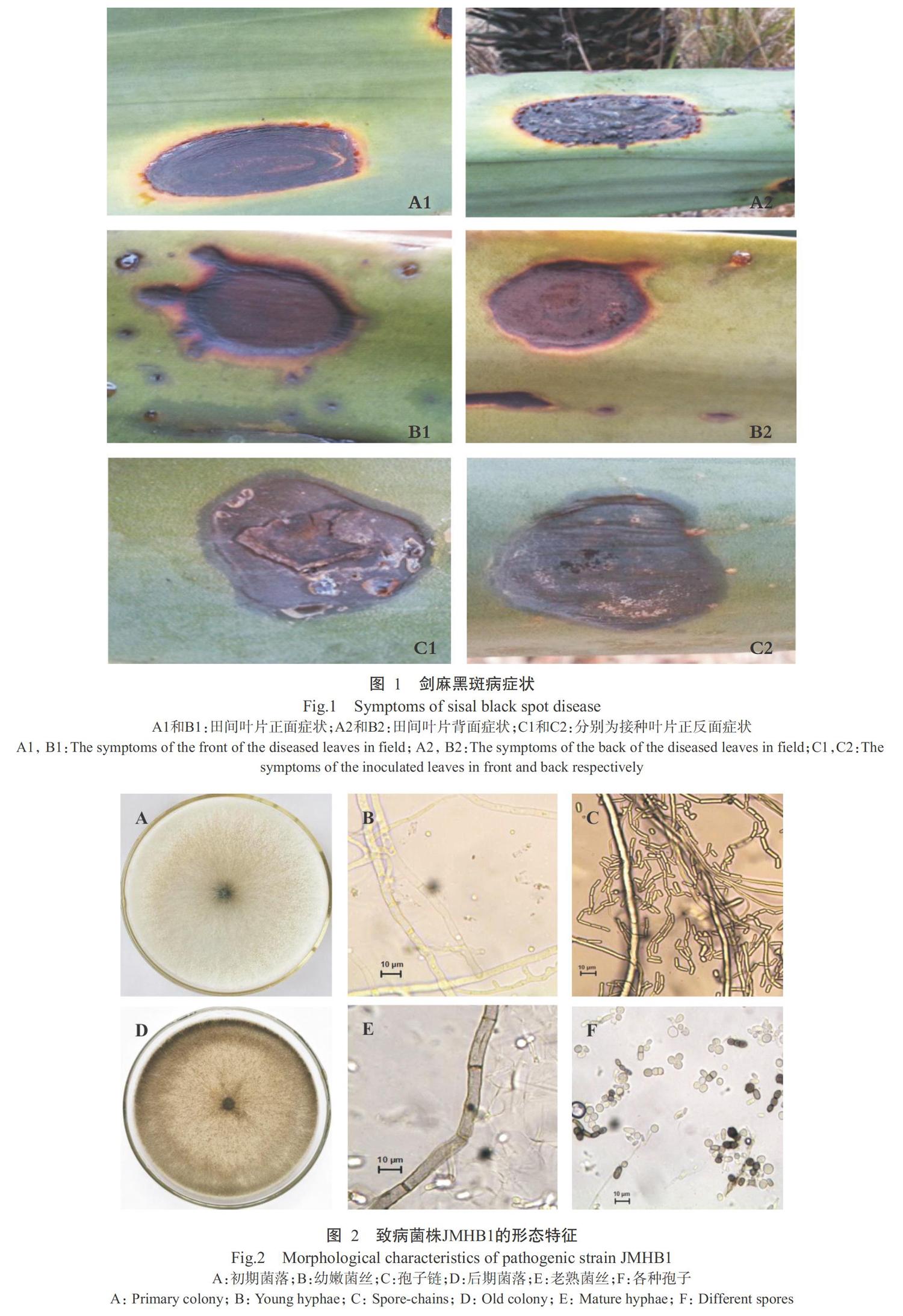
根据柯赫氏法则,将不同菌株接种至长势一致的健康3龄剑麻苗叶片,5 d后发现接种菌株JMHB1的剑麻苗叶片表现出与田间病害相似的症状(图1),且能从接种叶片的发病部位分离出与JMHB1相同的菌物,而其他菌株处理的剑麻苗未表现出症状或表现的症状与田间不一致。由此说明,菌株JMHB1是剑麻黑斑病害的致病菌。
2. 2 病原菌菌株JMHB1形态特征
病原菌菌株JMHB1在PDA培养基上生长迅速,直径为0.5 cm的菌丝块在28 ℃培养箱中培养3 d后即可长满整个平板(直径9 cm)。菌落初期灰白色,贴近平板表面的菌丝较致密,气生菌丝较稀疏(图2-A),幼嫩菌丝有分支和分隔(图2-B),菌落边缘有大量白色粉末状物,即分生孢子及孢子链(图2-C),随着培养时间延长,菌落逐渐变深灰色至橄榄绿色(图2-D),老熟菌丝颜色较深,分隔较多(图2-E)。共产生3种孢子,即分生孢子、节孢子和厚垣孢子(图2-F),分生孢子圆形至椭圆形,无色透明,0~1个隔膜,大小为4.4~13.8 ?m×2.2~5.6 ?m;节孢子短柱状,无色透明,单生或多个连接形成孢子链,大小为5.5~17.9 ?m×2.1~3.5 ?m;厚垣孢子深褐色,圆形或椭圆形,单生或多个连接成孢子链,大小为4.5~9.6 ?m×4.5~8.6 ?m。在PDA培养基上未见产生分生孢子器。菌株JMHB1的形态特征与Crous等(2006)描述的新暗色柱节孢(Neoscytalidium dimidiatum)相一致。
2. 3 菌株JMHB1的ITS和EF1-α序列擴增及分析
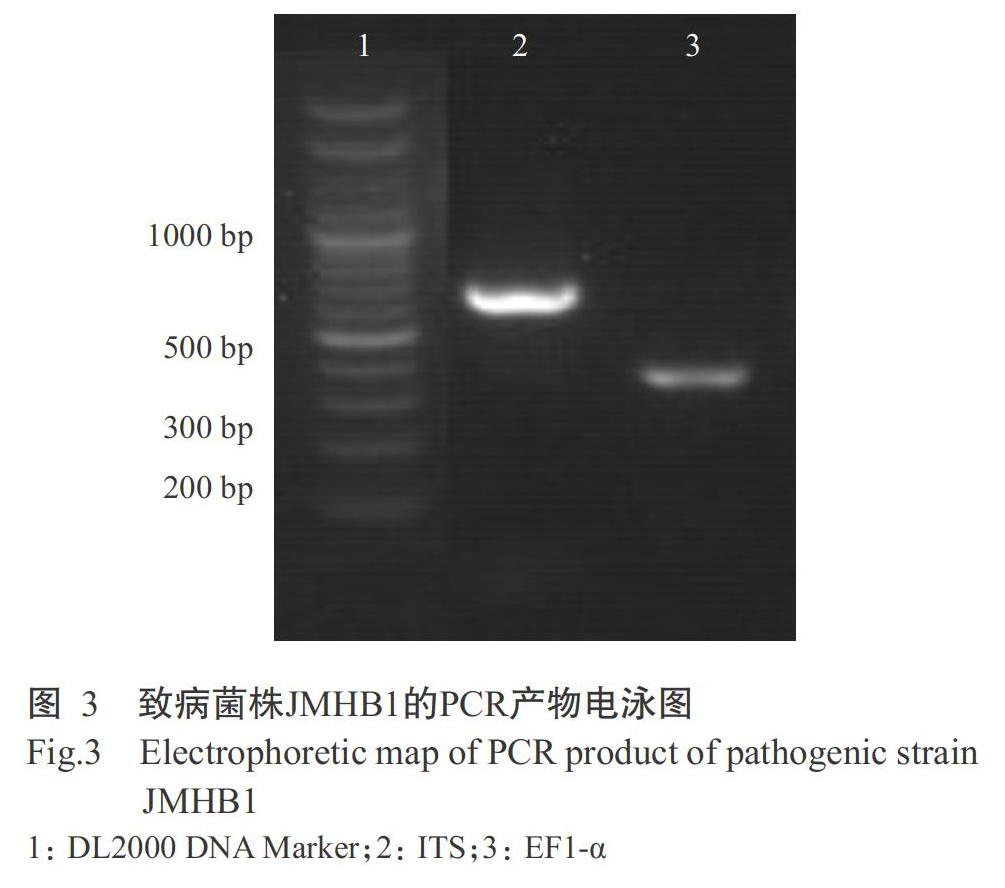
菌株JMHB1的ITS和EF1-α PCR产物测序后分别获得长度为555和293 bp的序列片段(图3)。将获得的序列在NCBI中进行BLAST比对分析,发现获得的ITS序列(MT705646)/EF1-α序列(MT733516)与GenBank中N. dimidiatum的模式菌株CBS 499.66的ITS序列(AY819727)和EF1-α序列(EU144063)的同源性高,分别为100%和99.65%。
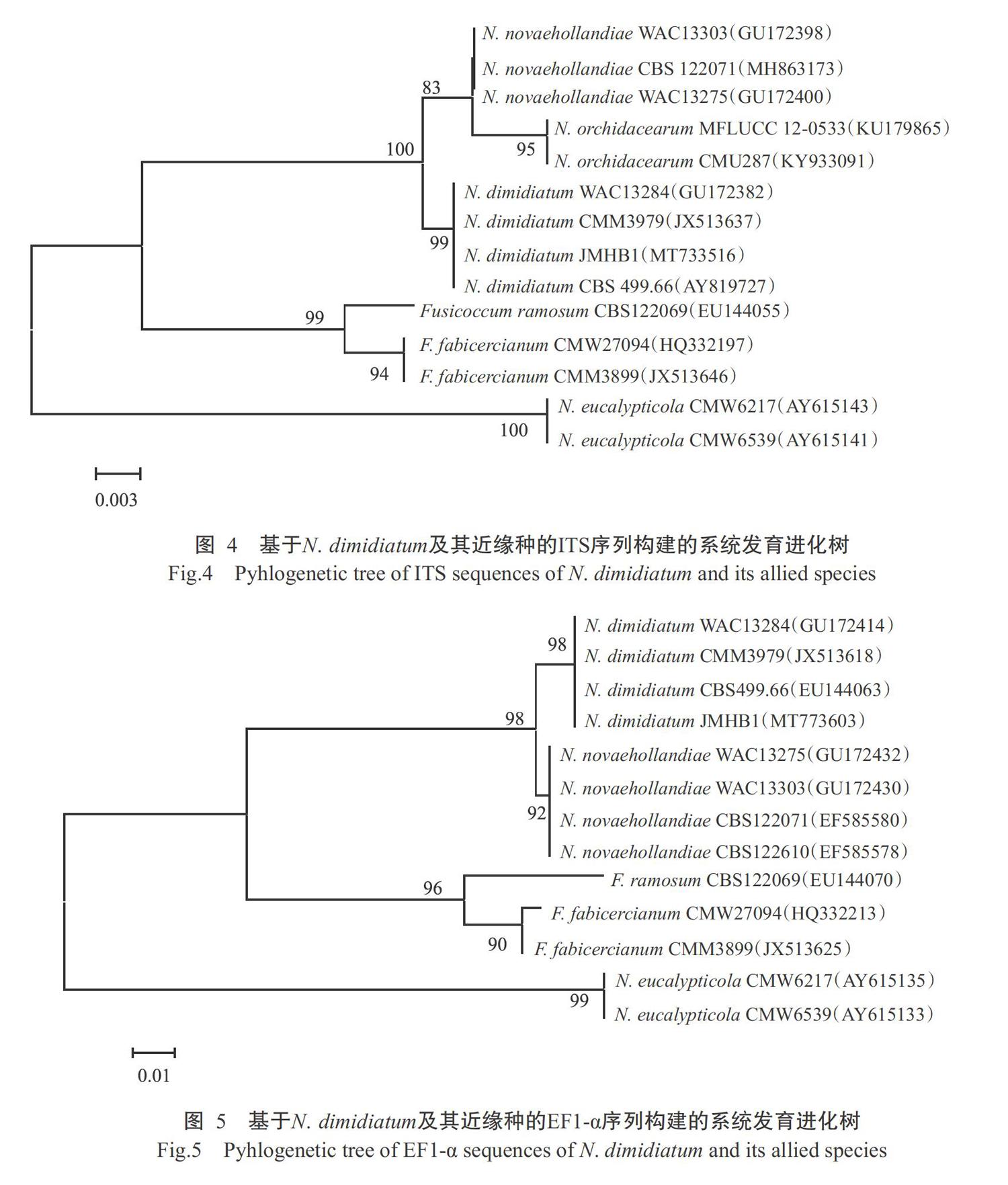
从GenBank中分别下载N. dimidiatum及其近似种菌株的ITS序列和EF1-α序列,以Neofusicoccum vitifusiforme为外群构建系统发育进化树。基于ITS和EF1-α序列构建的系统发育进化树显示,菌株JMHB1与N. dimidiatum的模式菌株CBS 499.66及其他已公开发表的N. dimidiatum菌株聚为一类(图4和图5)。
综合致病性测定、形态特征观察和分子鉴定结果表明,引起广西剑麻叶片黑斑病的病原菌为新暗色柱节孢[N. dimidiatum (Penz.) Crous & Slippers]。
2. 4 生防菌对菌株JMHB1菌丝生长的抑制效果
对峙培养发现,4种生防菌均能抑制菌株JMHB1的菌丝生长(图6)。其中,菌株YZ14-3和B11的抑制效果最好,其抑菌圈半径分别为13.22和12.14 mm,二者间差异不显著(P>0.05,下同),且均显著高于对照(P<0.05,下同)。菌株ST-1和 GZ-5对JMHB1菌丝生长的拮抗系数分别为Ⅲ级和Ⅳ级,即菌株ST-1和GZ-5的菌落分别占据平板的1/3~2/3和1/3以下(表1)。对照菌株JMHB1的菌丝能正常长满整个PDA平板。菌株JMHB1菌落与生防菌菌落交接处的菌丝变黑,挑取变黑的菌丝镜检,发现菌丝隘缩、断裂(图7)。
2. 5 生防菌培养滤液对菌株JMHB1菌丝生长的抑制效果
试验结果表明,菌株ST-1和GZ-5的培养滤液对菌株JMHB1的菌丝无抑制作用(图8-B和图8-E),与对照(图-C和图8-F)无显著差异,而菌株YZ14-3和B11的培养滤液可抑制菌株JMHB1的菌丝生长(图8-A和图8-D)。挑取菌株YZ14-3和B11的培养滤液处理的菌株JMHB1菌丝镜检发现菌丝隘缩、断裂(图7)。
2. 6 生防菌培养滤液对菌株JMHB1孢子萌发的抑制效果
观察发现,菌株JMHB1的孢子可在菌株YZ14-3、B11、ST-1和GZ-5的培养滤液中萌发,但萌发率存在差异,平均萌发率分别为31.67%、32.37%,68.63%和76.63%,各生防菌处理的孢子萌发率均显著小于对照(表2)。
3 讨论
王会芳等(2018)研究发现,蒂腐色二孢和新暗色柱节孢侵染剑麻叶片分别引起黑斑病和溃疡病。由蒂腐色二孢引起的剑麻黑斑病病斑圆形至长条形,中间灰白色,边缘黑褐色;由新暗色柱节孢引起的剑麻溃疡病病斑为圆形小斑点,红褐色至黑褐色,稍凹陷,有时病部开裂,病部有黑褐色颗粒物。本研究描述的剑麻黑斑病病原菌为新暗色柱节孢,其症状不同于王会芳等(2018)报道的剑麻黑斑病和溃疡病,也不同于赵艳龙等(2007)描述的剑麻黑斑病。由此可见,新暗色柱节孢侵染剑麻后可表现出不同的症状。为与剑麻其他黑斑病相区分,本研究发现的剑麻叶片黑色凹陷斑块病害暂命名为剑麻Neoscytalidium黑斑病(剑麻新暗色柱节孢黑斑病)。新暗色柱节孢除侵染剑麻引起不同症状的病害外,也侵染芒果(Padin et al.,2005)和柑橘类果树(Polizzi et al.,2009),表现出不同的症状。
新暗色柱節孢是Crous等(2006)在研究葡萄座腔菌科18个属100多个种的系统发育时重新建立的一个新组合,其包含有多个异名,常见的有双分圆酵母(Torula dimidiate)、双间柱顶孢(Scytalidium dimidiatum)、芒果那特拉斯菌(Nattrassia mangiferae)、圆酵母样亨德逊霉(Hendersonula toruloidea)和双间壳梭孢菌(Fusicoccum dimidiatum)。新暗色柱节孢寄主广泛,可引起多种植物病害,如火龙果(Hylocereus undulatus Britt)褐斑病(Lan and He,2012)、麻风树(Jatropha curcas L.)根腐病(Machado et al.,2012)和溃疡病(陆志翔等,2015)、垂叶榕(Ficus benjamina L.)梢枯病(Fernández-Herrera et al.,2017)、虎尾兰(Sansevieria trifasciata Prain)叶枯病(Kee et al.,2017)。此外,新暗色柱节孢还能引起人类皮下组织感染(Sigler et al.,1997)、皮肤癣病和鼻窦炎(Bakhshizadeh et al.,2014)、肺部感染(Dionne et al.,2015),以及灰海豚(Grampus griseus G.)肺部感染(Elad et al.,2011)。本研究中,菌株JMHB1的ITS序列(MT705646)和EF1-α序列(MT733516)均与GenBank中新暗色柱节孢模式菌株CBS 499.66的相关序列高度同源,构建的系统发育树显示菌株JMHB1与模式菌株CBS 499.66及其他已公开发表的新暗色柱节孢菌株聚在一起。结合菌株的致病性测定结果和形态特征,将广西剑麻叶片上黑色凹陷斑块病害的病原菌鉴定为新暗色柱节孢(N. dimi-diatum),该研究结果为我国首次报道。
关于新暗色柱节孢所致病害的防治,国内外已有报道。陈静等(2015)从土壤中筛选出1株皮氏类芽孢杆菌(Paenibacillus peoriae),对峙培养发现皮氏类芽孢杆菌对新暗色柱节孢的抑菌带宽度为0.9 cm。李界秋等(2016)测定8种杀菌剂对火龙果溃疡病菌新暗色柱节孢菌丝的抑制作用,结果表明,苯醚甲环唑、咪鲜胺、苯甲·丙环唑和克菌·戊唑醇对新暗色柱节孢菌丝生长具有良好的抑制效果,离体防治效果均在90%以上。王会会等(2016)研究了13种化学药剂对火龙果溃疡病菌新暗色柱节孢的室内抑菌效果,发现50%多菌灵可湿性粉剂、40%氟硅唑乳油和12.5%烯唑醇乳油对病菌菌丝生长的抑制效果较好。Luong等(2016)研究发现弗氏链霉菌(Streptomyces fradiae)和多发酵芽孢杆菌(B. polyfermenticus)对新暗色柱节孢菌丝生长的抑菌效果好,对峙培养结果表明抑菌圈直径达2 cm以上。张振华等(2019)从火龙果不同生境中分离到5株火龙果溃疡病菌新暗色柱节孢强拮抗性菌株,温室盆栽防效测定结果表明,7-6-1和10-4-6对火龙果溃疡病的平均防效较高,分别为50.41%和48.85%。
植物病害生物防治是近年来的研究热点。Gotor-Vila等(2017)研究了解淀粉芽孢杆菌CPA-8的挥发性有机化合物(1,3-戊二烯、3-羟基-2-丁酮和噻吩)对桃灰霉病菌(Botrytis cinera)、桃褐腐病菌(Moni-linia fructicola)和樱桃核果链核盘菌(M. laxa)菌丝生长的抑制效果,发现1.35 ?L/mL的噻吩对参试病菌菌丝生长的抑制率均达82%以上,挥发性有机化合物能显著降低果实腐烂率。哈茨木霉微生物肥与化肥配施可提高番茄果实的总可溶性糖和维生素C含量,降低硝酸盐积累量,提高土壤微生物种群数量,改善土壤肥力(赵政等,2018)。利用深绿木霉作为种子包衣剂处理玉米种子,可显著降低玉米猝倒病菌燕麦镰刀菌(Fusarium avenaceum)和黄色镰刀菌(F. culmorum)的感染率(Coninck et al.,2020)。谢红辉(2016)研究发现,哈茨木霉、深绿木霉、枯草芽孢杆菌和解淀粉芽孢杆菌能使桑树根腐病病菌可可毛色二孢(Lasiodiplodia theobromae)的菌丝畸形膨大、断裂;哈茨木霉和深绿木霉的菌丝紧紧缠绕可可毛色二孢菌丝;可可毛色二孢的分生孢子在枯草芽孢杆菌和解淀粉芽孢杆菌的培养滤液中不能萌发,且发生孢子解体。本研究中,深绿木霉ST-1、枯草芽孢杆菌 B11和解淀粉芽孢杆菌YZ14-3对新暗色柱节孢菌丝生长均有较强的抑制作用,且能导致新暗色柱节孢菌丝隘缩、断裂,推断其对新暗色柱节孢的抑菌机制主要是生长竞争和产生抗生物质。本研究中未观察到木霉菌丝缠绕新暗色柱节孢菌丝,且新暗色柱节孢的孢子在芽孢杆菌培养滤液未发生解体,究其原因可能是同一种生防菌对不同病原菌的抑菌机制存在差异。哈茨木霉GZ-5、深绿木霉ST-1、枯草芽孢杆菌B11和解淀粉芽孢杆菌YZ14-3对剑麻Neoscytalidium黑斑病的田间防治效果有待在后续研究中评价。
4 结论
广西剑麻叶片上症状为圆形、近圆形或长椭圆形黑色凹陷斑块病害的病原菌为新暗色柱节孢[N. dimidiatum(Penz.) Crous & Slipper],这是我国首次报道新暗色柱节孢侵染剑麻引起黑斑病。剑麻生产上可选择和搭配使用解淀粉芽孢杆菌、枯草芽孢杆菌、深绿木霉及其商品制剂防治剑麻Neoscytalidium黑斑病(剑麻新暗色柱节孢黑斑病)。
参考文献:
陈静,李少梅,许小玲,苏桐洁,许耀杰,邢益原,易润华. 2015. 火龙果溃疡病菌拮抗细菌的鉴定和发酵培养基优化[J]. 热带农业科学,35(10):64-69. doi:10.3969/j.issn. 1009-2196.2015.10.012. [Chen J,Li S M,Xu X L,Su T J,Xu Y J,Xing Y Y,Yi R H. 2015. Identification of antagonistic bacterium against Neoscytalidium dimidiatum causing pitaya canker and fermentation medium optimization[J]. Chinese Journal of Tropical Agriculture,35(10):64-69.]
陳士伟,李栋宇. 2016. 我国剑麻产业发展现状及展望[J]. 中国热带农业,(3):10-12. doi:10.3969/j.issn.1673-0658. 2016.03.003. [Chen S W,Li D Y. 2016. Development status and prospect of sisal industry in China[J]. China Tropical Agriculture,(3):10-12.]
董娟华,罗丽,王彩霞,冷伟锋,李桂舫,李保华. 2009. 一种强寄生病原真菌的分离方法:毛细管打孔单孢分离法[J]. 中国农学通报,25(3): 210-212. [Dong J H,Luo L,Wang C X,Leng W F,Li G F,Li B H. 2009. Isolating strongly parasitic fungi by single-spore isolation aided with capillary stiletto[J]. Chinese Agricultural Science Bulletin,25(3): 210-212.]
方中达. 1998. 植病研究法[M]. 第3版. 北京: 中国农业出版社. [Fang Z D.1998. Plant pathology methods[M]. The 3rd Edition. Beijing: China Agriculture Press.]
黄雪兰,李菊馨,周海兰,谢红辉. 2019. 3种生防真菌对剑麻茎腐病病菌黑曲霉的抑制效果[J]. 农业研究与应用,32(1): 16-20. doi:10.3969/j.issn.2095-0764.2019.01.004. [Huang X L,Li J X,Zhou H L,Xie H H. 2019. Inhibitory effects of three biocontrol fungi on Aspergillus niger,the pathogen of bole rot pathogen of sisal[J]. Agricultural Research and Application,32(1):16-20.]
李界秋,李杨秀,吴凡. 2016. 火龙果溃疡病菌病的室内药剂筛选[J]. 广西植保,29(4):16-18. doi:10.3969/j.issn.1003- 8779.2016.04.008. [Li J Q,Li Y X,Wu F. 2016. Scree-ning of fungicides for pitaya canker[J]. Guangxi Plant Protection,29(4):16-18.]
刘巧莲,郑金龙,张世清,高建民,陈河龙,江程记,易克贤. 2010. 13种药剂对剑麻斑马纹病病原菌的室内毒力测定[J]. 热带作物学报,31(11):2010-2014. doi:10.3969/j.issn.1000-2561.2010.11.026. [Liu Q L,Zheng J L,Zhang S Q,Gao J M,Chen H L,Jiang C J,Yi K X. 2010. The indoor toxicity determination of 13 fungicides against Phytophthora nicotianae isolates from sisal[J]. Chinese Journal of Tropical Crops,31(11):2010-2014.]
陆志翔,陆小平,秦斌华,成美华,黄林丹,陈保善,廖咏梅. 2015. 广西防城港市火龙果茎溃疡病病原鉴定[J]. 南方农业学报,46(9): 1606-1612. doi:10.3969/j:issn.2095-1191.2015.09.1606. [Lu Z X,Lu X P,Qin B H,Cheng M H,Huang L D,Chen B S,Liao Y M. 2015. Identification of pathogen of pitaya stem canker disease in Fangchenggang city of Guangxi[J]. Journal of Southern Agriculture,46(9):1606-1612.]
秦士维. 2017. 蓝莓果实潜伏侵染病原真菌分离鉴定及生物防治研究[D]. 大连:大连理工大学.[Qin S W. 2017. Identification and biocontrol of latent pathogenic fungi in blueberry fruits[D]. Dalian: Dalian University of Techno-logy.]
孙娟,钟鑫,郑红裕,马晨雨,陈河龙,易克贤. 2020. 我国剑麻产业概况及对策研究[J]. 中国热带农业,(5):27-32. doi:10.3969/j.issn.1673-0658.2020.05.008. [Sun J,Zhong X,Zheng H Y,Ma C Y,Chen H L,Yi K X. 2020. Overview and strategy research of sisal industry in China[J]. China Tropical Agriculture,(5):27-32.]
王会芳,芮凯,曾向萍,肖敏,符美英,陈绵才. 2018. 剑麻病害调查及其主要病原种类鉴定[J]. 南方农业学报,49(10): 1988-1994. doi:10.3969/j.issn.2095-1191.2018.10.13. [Wang H F,Rui K,Zeng X P,Xiao M,Fu M Y,Chen M C. 2018. Investigating report of diseases and indentification of major pathogens on Agave sisalana[J]. Journal of Southern Agriculture,49(10): 1988-1994.]
王会会,符碧海,戴俊,徐倩,王萌,陶挺燕,谢昌平,朱朝华. 2016. 火龙果溃疡病菌的鉴定及室内药剂筛选[J]. 中国南方果树,45(1):8-12. doi:10.13938/j.issn.1007-1431. 20150231. [Wang H H,Fu B H,Dai J,Xu Q,Wang M,Tao T Y,Xie C P,Zhu C H. 2016. Identification of dragon fruit canker pathogen and indoor screening of fungicides[J]. South China Fruits,45(1):8-12.]
汪佳滨. 2016. 2015年剑麻产业发展报告及形势预测[J]. 世界热带农业信息,(8):26-30. doi:10.3969/j.issn.1009-1726.2016.08.004. [Wang J B. 2016. Development report and situation forecast of sisal industry in 2015[J]. World Tropical Agriculture Information,(8): 26-30.]
谢红辉. 2016. 桑毛色二孢根腐病的病原、发生规律及其防治研究[D]. 南宁:广西大学. [Xie H H. 2016. Studies on the pathogen,occurrence pattern and control of mulberry La-siodiplodia root rot[D]. Nanning: Guangxi University.]
谢红辉,黄兑武,王春田. 2012. 剑麻病虫害生态防治应用及研究现状[J]. 中国热带农业,(6): 40-41. doi:10.3969/j.issn.1673-0658.2012.06.019. [Xie H H,Huang D W,Wang C T. 2012. Application and research status of ecological control of sisal diseases and insect pests[J]. China Tropical Agriculture,(6): 40-41.]
张俊杰,尚益民,田寅,汪晓鸽,郭晨,彭姗姗,杨旭. 2019. 1株黄瓜枯萎病菌拮抗酵母的分离鉴定及其拮抗作用初探[J]. 河南农业大学学报,53(3):393-399. [Zhang J J,Shang Y M,Tian Y,Wang X G,Guo C,Peng S S,Yang X. 2019. Isolation and identification of an antagonistic yeast strain against cucumber Fusarium wilt and the preliminary study on its antagonism[J]. Journal of Henan Agricultural University,53(3):393-399.]
张燕梅,赵艳龙,周文钊. 2016. 剑麻斑马纹病研究进展[J]. 热带作物学报,37(8):1627-1633. doi:10.3969/j.issn. 1000-2561.2016.08.028. [Zhang Y M,Zhao Y L,Zhou W Z. 2016. Research progress of zebra leaf disease on sisal[J]. Chinese Journal of Tropical Crops,37(8):1627-1633.]
張振华,林江,王文雅,许畅,杨开样,何世伟. 2019. 火龙果溃疡病原菌拮抗菌株的筛选与生物防治效果初探[J]. 河南农业科学,48(4):88-94. doi:10.15933/j.cnki.1004-3268.2019.08.013. [Zhang Z H,Lin J,Wang W Y,Xu C,Yang K Y,He S W. 2019. Screening of antagonistic strains of pitaya ulcer pathogen and primary study on biocontrol effects[J]. Journal of Henan Agricultural Scien-ces,48(4):88-94.]
赵艳龙,何衍彪,詹儒林. 2007. 我国剑麻主要病虫害的发生与防治[J]. 中国麻业科学,29(6): 334-338. doi: 10. 3969/j.issn.1671-3532.2007.06.008. [Zhao Y L,He Y B,Zhan R L. 2007. The occurrence and control of the main disease and pests in sisal hemp in China[J]. Plant Fiber Sciences in China,29(6): 334-338.]
赵艳龙,李俊峰,姚全胜,何衍彪,柳凤,吴婧波,李国平,杨洁. 2020. 剑麻3种主要病害研究进展及其展望[J]. 热带农业科学,40(1):72-82. doi:10.12008/j.issn.1009-2196. 2020.01.012. [Zhao Y L,Li J F,Yao Q S,He Y B,Liu F,Wu J B,Li G P,Yang J. 2020. Research progress and prospects of three main diseases of sisal[J]. Chinese Journal of Tropical Agriculture,40(1):72-82.]
趙政,陈巍,王欢,夏可心,高仁维,姜斯琪,庞冠,蔡枫. 2018. 木霉微生物肥与减量化肥配施对番茄产量、品质及土壤肥力的影响[J]. 土壤学报,55(5): 1243-1253. doi:10. 11766/trxb201802270062. [Zhao Z,Chen W,Wang H,Xia K X,Gao R W,Jiang S Q,Pang G,Cai F. 2018. Effects of bio-manure combined with chemical fertilizer reduced in application rate on soil fertility and yield and quality of tomato[J]. Acta Pedologica Sinica,55(5): 1243-1253.]
郑金龙,高建民,张世清,陈河龙,刘巧莲,习金根,易克贤. 2011. 6种杀菌剂对剑麻斑马纹病的田间药效试验[J]. 江西农业学报,23(11):115-116. doi:10.3969/j.issn. 1001- 8581.2011.11.036. [Zheng J L,Gao J M,Zhang S Q,Chen H L,Liu Q L,Xi J G,Yi K X. 2011. Field experiments of control effects of six fungicides on sisal zebra disease[J]. Acta Agriculturae Jiangxi,23(11):115-116.]
郑金龙,高建民,张世清,陈河龙,习金根,刘巧莲,易克贤. 2012. 6种杀菌剂防治剑麻茎腐病田间药效试验[J]. 广东农业科学,39(23):65-66. doi:10.3969/j.issn.1004-874X. 2012.23.021. [Zheng J L,Gao J M,Zhang S Q,Chen H L,Xi J G,Liu Q L,Yi K X. 2012. Field efficacy scree-ning experiment of sisal stem rot from six kinds of fungicides[J]. Guangdong Agricultural Sciences,39(23):65-66.]
周少霞. 1998. 旺茂农场更新麻园斑马纹病严重[J]. 广西热作科技,(3): 25-26. [Zhou S X.1998. Zebra stripe di-sease was serious in the renewed hemp garden of Wangmao farm[J]. Guangxi Science & Technology of Tropical Crops,(3): 25-26.]
Bakhshizadeh M,Hashemian H R,Najafzadeh M J,Dolatabadi S,Zarrinfar H. 2014. First report of rhinosinusitis caused by Neoscytalidium dimidiatumin in Iran[J]. Journal of Medical Microbiology,63(7): 1017-1019. doi:10.1099/jmm.0.065292-0.
Barbosa L O,Lima J S,Magalh?es V C,Gava C A T,Soares A C F,Marbach P A S,Souza J T D. 2018. Compatibility and combination of selected bacterial antagonists in the biocontrol of sisal bole rot disease[J]. BioControl,63: 595-605. doi:10.1007/s10526-018-9872-x.
Carbone I,Kohn L M. 1999. A method for designing primer sets for speciation studies in filamentous ascomycetes[J]. Mycologia,91(3): 553-556. doi:10.1080/00275514. 1999.12061051.
Clinton P K S,Peregrine W T H. 1963. The zebra complex of sisal hybrid No. 11648[J]. East African Agricultural and Forestry Journal,29(2): 110-113. doi:10.1080/00128325. 1963.11661907.
Coninck E,Scauflaire J,Gollier M,Lienard C,Foucart G,Manssens G,Munaut F,Legreve A. 2020. Trichoderma atroviride as a promising biocontrol agent in seed coating for reducing Fusarium damping-off on maize[J]. Journal of Applied Microbiology,129(3): 637-651. doi:10.1111/jam.14641.
Crous P W,Slippers B,Wingfield M J,Rheeder J,Marasas W F O,Philips A J L,Alves A,Burgess T,Barber P,Groenewald J Z. 2006. Phylogenetic lineages in the Botryosphaeriaceae[J]. Studies in Mycology,55(1): 235-253. doi:10.3114/sim.55.1.235.
Dionne B,Neff L,Lee S A,Sutton D A,Wiederhold N P,Lindner J,Fan H,Jakeman B. 2015. Pulmonary fungal infection caused by Neoscytalidium dimidiatum[J]. Journal of Clinical Microbiology,53(7):2381-2384. doi:10.3109/13693786.2010.533392.
Duarte E A A,Damasceno C L,Oliveira T A S D,Barbosa L D O,Martins F M,Silva J R D Q,Lima T E F D,Silva R M D,Kato R B,Bortolini D E,Azevedo V,Goes-Neto A,Soares A C F. 2018. Putting the mess in order: Aspergillus welwitschiae(and Not A. niger) is the etiological agent of sisal bole rot disease in Brazil[J]. Frontiers in microbiology,9(4):1-21. doi:10.3389/fmicb.2018.01227.
Elad D,Morick D,David D,Scheinin A,Yamin G,Blum S,Goffman O. 2011. Pulmonary fungal infection caused by Neoscytalidium dimidiatum in a Rissos dolphin(Grampus griseus)[J]. Medical Mycology,49(4): 424-426. doi:10.3109/13693786.2010.533392.
Fernández-Herrera E,Moreno-Salazar S F,Eentería-Martínez M E,Arratia-Castro A A,Villar-Luna E. 2017. Neoscytalidium dimidiatum:Causal agent of dieback in Ficus benjamina L. in Mexico[J]. Revista Chapingo Serie Horticultura,23(3): 203-210. doi:10.5154/r.rchsh.2017.02. 009.
Gotor-Vila A,Teixid N,Francesco A D,Usall J,Ugolini L,Torres R,Mari M. 2017. Antifungal effect of volatile organic compounds produced by Bacillus amyloliquefaciens CPA-8 against fruit pathogen decays of cherry[J]. Food Microbiology,64:219-225. doi:10.1016/j.fm.2017. 01.006.
Kee Y J,Suhaimi N N,Zakaria L,Mohd M H. 2017. Characterisation of Neoscytalidium dimidiatum causing leaf blight on Sansevieria trifasciata in Malaysia[J]. Australa-sian Plant Disease Notes,12: 60. doi:10.1007/s13314-017-0284-z.
Lan G B,He Z F. 2012. First report of brown spot disease caused by Neoscytalidium dimidiatum on Hylocereus undatus in Guangdong,Chinese mainland[J]. Plant Disease,96(11): 1702-1703. doi:10.1094/PDIS-07-12-0632-PDN.
Luong H T,Kieu B T N,Vu T N,Ha T T,Tong H V,Hua T S,Nguyen N Q,Nguyen T H N. 2016. Study on the possibility of using microorganisms as biological agents to control fungal pathogens Neoscytalidium dimidiatum causing disease of brown spots on the dragon fruit[J]. Journal of Vietnamese Environment,8(1):41-44. doi:10. 13141/jve.vol8.no1.pp41-44.
Machado A R,Pinho D B,Dutra D C,Pereira O L. 2012. First report of collar and root rot of physic nut(Jatropha curcas) caused by Neoscytalidium dimidiatum in Brazil[J]. Plant Disease,96(11):1697. doi:10.1094/PDIS-05-12-0504-PDN.
Magalhaes V C,Barbosa L D O,Andrade J P,Soares A C F,Souza J T D,Marbach P A S. 2017. Burkholderia isolates from a sand dune leaf litter display biocontrol acti-vity against the bole rot disease of Agave sisalana[J]. Biological Control,112:41-48. doi:10.1016/j.biocontrol.2017. 06.005.
Padin C,Fernández-Zeppenfeldt G,Yegres F,Yegres N R. 2005. Scytalidium dimidiatum an opportunistic fungus for both man and Mangifera indica trees in Venezuela[J]. Revista Iberoamericana de Micología,22(3):172-173. doi:10.1016/s1130-1406 (05)70035-8.
Pereira G M,Ribeiro M G,da Silva B P,Parente J P. 2017. Structural characterization of a new steroidal saponin from Agave angustifolia var. Marginata and a preliminary investigation of its in vivo antiulcerogenic activity and in vitro membrane permeability property[J]. Bioorganic & Medicinal Chemistry Letters,27(18): 4345-4349. doi:10.1016/j.bmcl.2017.08.026.
Polizzi G,Aiello D,Vitale A,Giuffrida F,Crous P W. 2009. First report of shoot blight,canker,and gummosis caused by Neoscytalidium dimidiatum on citrus in Italy[J]. Plant Disease,93(11): 1215. doi:10.1094/PDIS-93-11-1215A.
Sigler L,Summerbell R C,Poole L,Wieden M,Sutton D A,Rinaldi M G,Aguirre M,Estes G W,Galgiani J N. 1997. Invasive Nattrassia mangiferae infections: Case report,literature review,and therapeutic and taxonomic appraisal[J]. Journal of Clinical Microbiology,35(2): 433-440. doi:10.1128/jcm.35.2.433-440.1997.
White T J,Bruns T,Lee S,Taylor J. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//Innis M,Gelfand D H,Sninsky J J,Whithe T J. PCR protocols: A guide to methods and applications. New York: Acadamic Press:315-322. doi:10. 1016/B978-0-12-372180-8.50042-1.
(責任编辑 麻小燕)

