太湖梅梁湾和东太湖轮虫群落结构周年变化比较
潘 越,郭 赟,黄晓峰,沈 冀,廖瑜欣,杜 玮,刘 涛,杨桂军
(1.无锡市太湖湖泊治理股份有限公司,江苏 无锡 214062;2.江南大学环境与土木工程学院,江苏 无锡 214122)
0 引言
轮虫是浮游动物的重要组成部分,在水生态系统的能量流动和物质循环中发挥着重要的作用。一方面,轮虫摄食藻类和细菌[1],另一方面轮虫又是许多鱼类的重要食物[2-3]。作为水生态系统中的重要组成之一,因为轮虫对水质的变化比较敏感,所以轮虫也是水质的重要指示种群[4]。在自然水体中,轮虫的种类、数量和分布易受到温度、水质以及扰动等外界环境因素的影响,环境因素的变化会引起轮虫群落结构发生相应的改变。
太湖是中国五大淡水湖之一。从20 世纪80年代中后期开始,太湖流域周边经济快速发展,各种点源、面源污染物不断排入太湖中,湖水富营养化问题日益严重,每年5月~10月蓝藻水华频发,严重危害太湖周边居民的生产、生活用水安全[5]。2007年发生太湖蓝藻水华事件后,国家和地方政府投入了大量资金对太湖周边污染物的控制以及太湖水进行治理,使得太湖水质整体明显改善[6]。2015年研究发现太湖水生植被严重退化,夏季太湖水生植被分布区面积仅占2014年夏季的20.14%[7]。太湖水生植物变化反映了太湖水质和水生植物群落结构的变化特征。2017年太湖出现了有记载以来面积最大的蓝藻水华,面积达1 403 km2[8]。其中梅梁湾是典型的藻型湖区,每年均会爆发大规模的蓝藻水华;而东太湖则是典型的草型湖区,由于湖中水生植物较多,所以富营养化和蓝藻水华问题较轻。为更好地了解太湖轮虫和水质情况,于2017年7月至2018年6月对太湖梅梁湾和东太湖轮虫群落结构和水质进行采样调查。该调查结果将为太湖生态系统的管理提供科学依据。
1 材料与方法
1.1 采样站的设置
2017年7月~2018年6月,在梅梁湾和东太湖各布设3 个采样点,进行轮虫和水体环境因子的现场调查。采样点位布设见图1。

图1 太湖梅梁湾与东太湖采样点位示意
1.2 样品点采集与处理
样品每月分2 层(湖水表层为0 ~50 cm 和中下层为100 ~150 cm)采集1 次,置于5 L 的有机玻璃柱状采水器中混匀,后用孔径为48 μm 的筛网进行过滤,并将过滤后的轮虫转移至50 mL 的方形瓶中,同时加入4%的甲醛保存样品[9]。并在现场测定水深、水温、透明度、pH 值,另取1 L 混合水样,带回实验室后按文献[10]方法测定分析水样理化指标(如TN,TP 等)。
1.3 试验方法
根据文献[11-12]在显微镜下对轮虫进行分类、计数。对每一种轮虫个体至少测量30 个,同时按照文献[13]算出体积,最后按轮虫质量浓度为1 mg/mm3进行换算。本文中的生物量均为湿重。
1.4 分析方法
在数据处理过程中,使用Origin 2017 软件制图,采用t 检验法分析2 个湖区的物理、化学和轮虫的差异,对所有的数据均用SPSS 22.0 软件进行统计分析。
2 研究与分析
2.1 太湖梅梁湾和东太湖环境因子周年变化
调查期间梅梁湾和东太湖部分水质指标周年变化趋势见图2。由图2(a)和(d)可以看出,梅梁湾TN浓度显著高于东太湖。在2017年7月~2018年2月及2018年5月~2018年6月,梅梁湾湖区TP 浓度也显著高于东太湖。梅梁湾和东太湖TN 质量浓度最高值均出现在5月,分别为3.200 和2.827 mg/L;梅梁湾和东太湖TP 质量浓度最大值分别出现在2017年7月和2018年6月,为0.505 和0.203 mg/L。图2(b)和(c)中梅梁湾湖区NH3-N 和NO3--N 浓度总体高于东太湖湖区。图2(e)中梅梁湾和东太湖2个湖区溶解性TP 变化趋势都表现为夏、秋季高于冬、春季。图2(f)中,除了2017年12月~2018年4月以外,梅梁湾叶绿素a 浓度都显著高于东太湖,尤其在2018年6月,梅梁湾叶绿素a 质量浓度高达150.57 μg/L,而东太湖叶绿素a 质量浓度只有32.61 μg/L。梅梁湾湖区的TN、溶解性TN、TP 和溶解性TP浓度均显著高于东太湖,说明梅梁湾富营养程度高于东太湖。这也是梅梁湾湖区叶绿素a 浓度显著高于东太湖的主要原因之一。
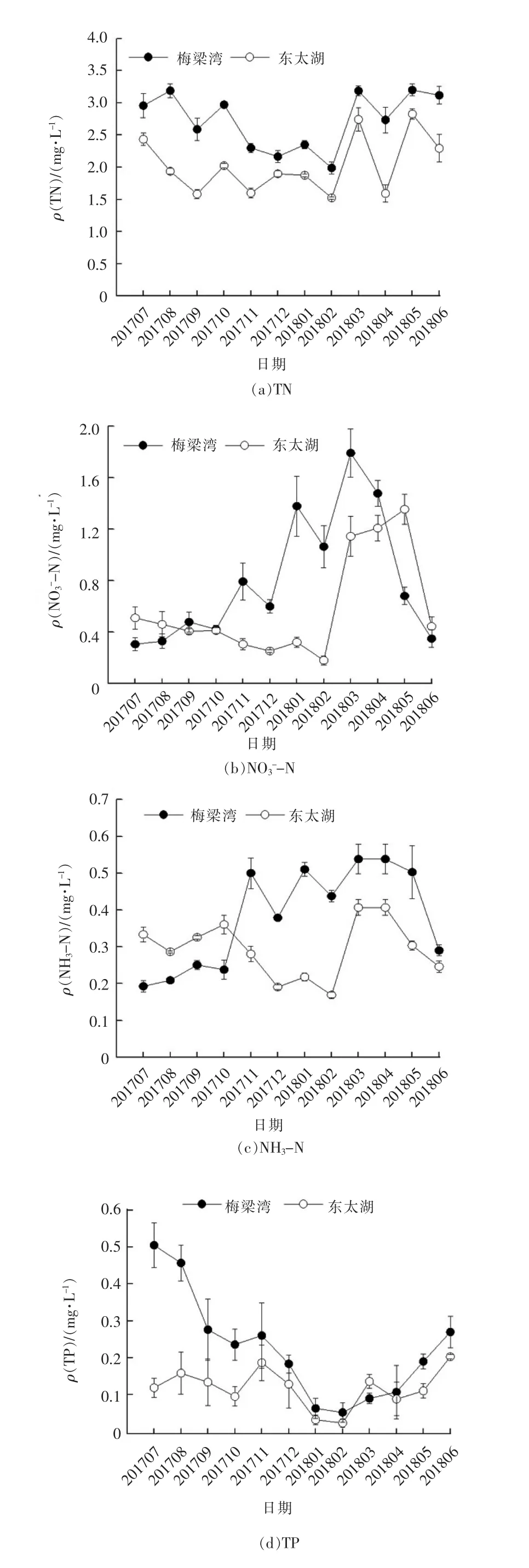
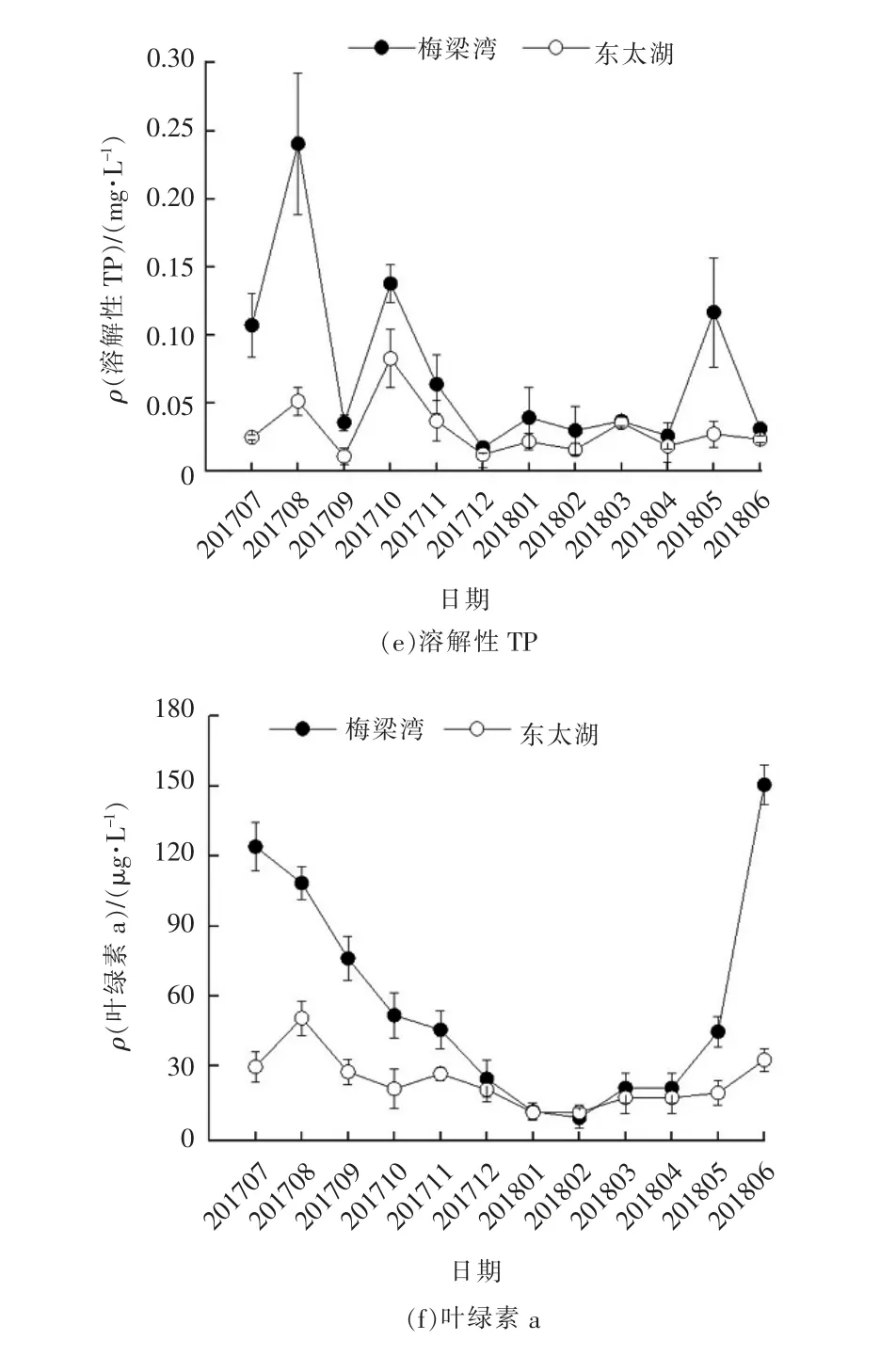
图2 太湖梅梁湾和东太湖部分水质指标周年变化
2.2 太湖梅梁湾和东太湖轮虫群落结构比较
(1)轮虫的种类组成
通过调查在梅梁湾和东太湖各发现15 种轮虫。2 个湖区轮虫种类包括萼花臂尾轮虫Brachionus calyciflorus、角突臂尾轮虫B.angularis、蒲达臂尾轮虫B.budapestiensis、卜氏晶囊轮虫Asplanchna brightwellii、多突囊足轮虫Asplanchnopus multiceps、长三肢轮虫Filinia longiseta、针簇多肢轮虫Polyarthra trigla、义角聚花轮虫Conochilus dossuarius、矩形龟甲轮虫Keratella quadrata、螺旋龟甲轮虫K.cochlearis、曲腿龟甲轮虫K.valga、细异尾轮虫Trichocerca gracilis、囊形单趾轮虫Monostyla bulla、腔轮虫Lecane sp.、大肚须足轮虫Euehlalns dilatata、没尾无柄轮虫Ascomorpha ecaudis。其中,囊形单趾轮虫仅出现在东太湖,大肚须足轮虫仅出现在梅梁湾。
(2)轮虫密度和生物量
太湖梅梁湾和东太湖调查期间轮虫年平均密度和生物量见图3。由图3 可以看出,梅梁湾和东太湖的轮虫年平均密度分别为81.4 和17.8 ind./L,轮虫年平均生物量分别为0.123 和0.030 1 mg/L,梅梁湾湖区轮虫年平均密度与年平均生物量均显著高于东太湖湖区。
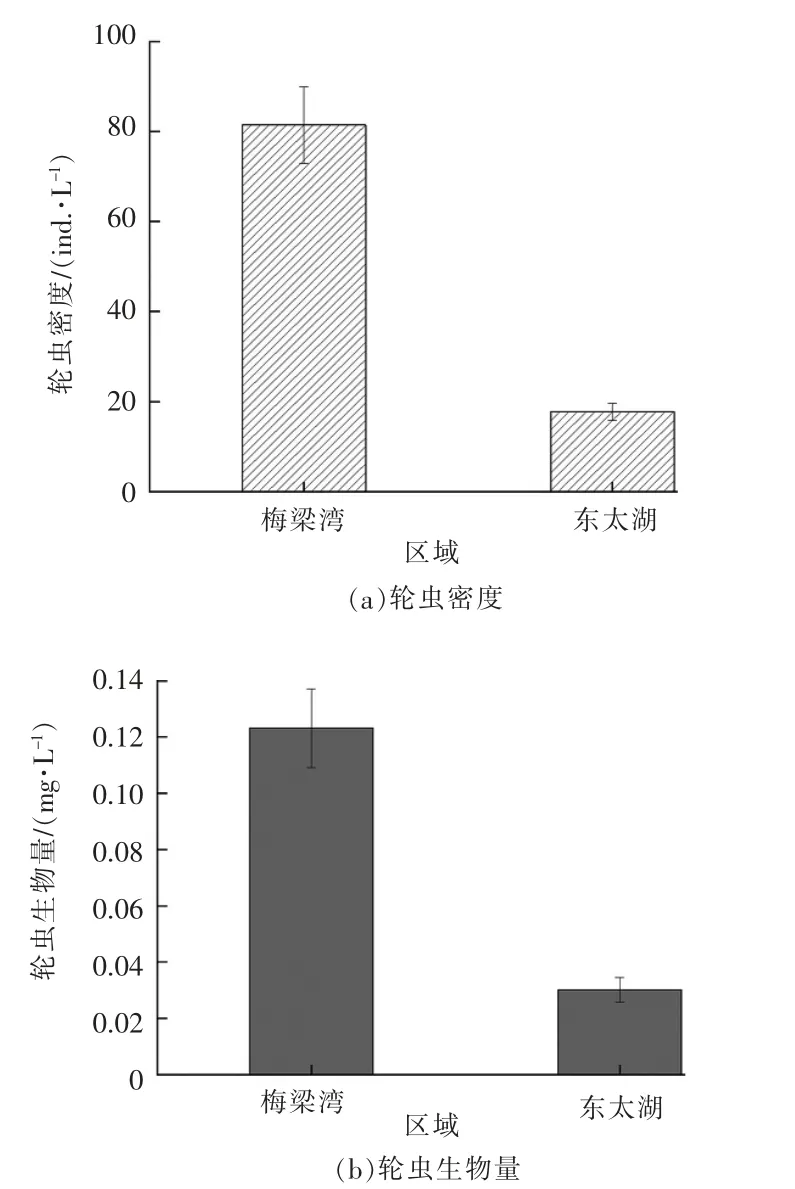
图3 太湖梅梁湾和东太湖调查期间轮虫年平均密度和生物量
太湖梅梁湾和东太湖轮虫密度和生物量周年变化见图4。
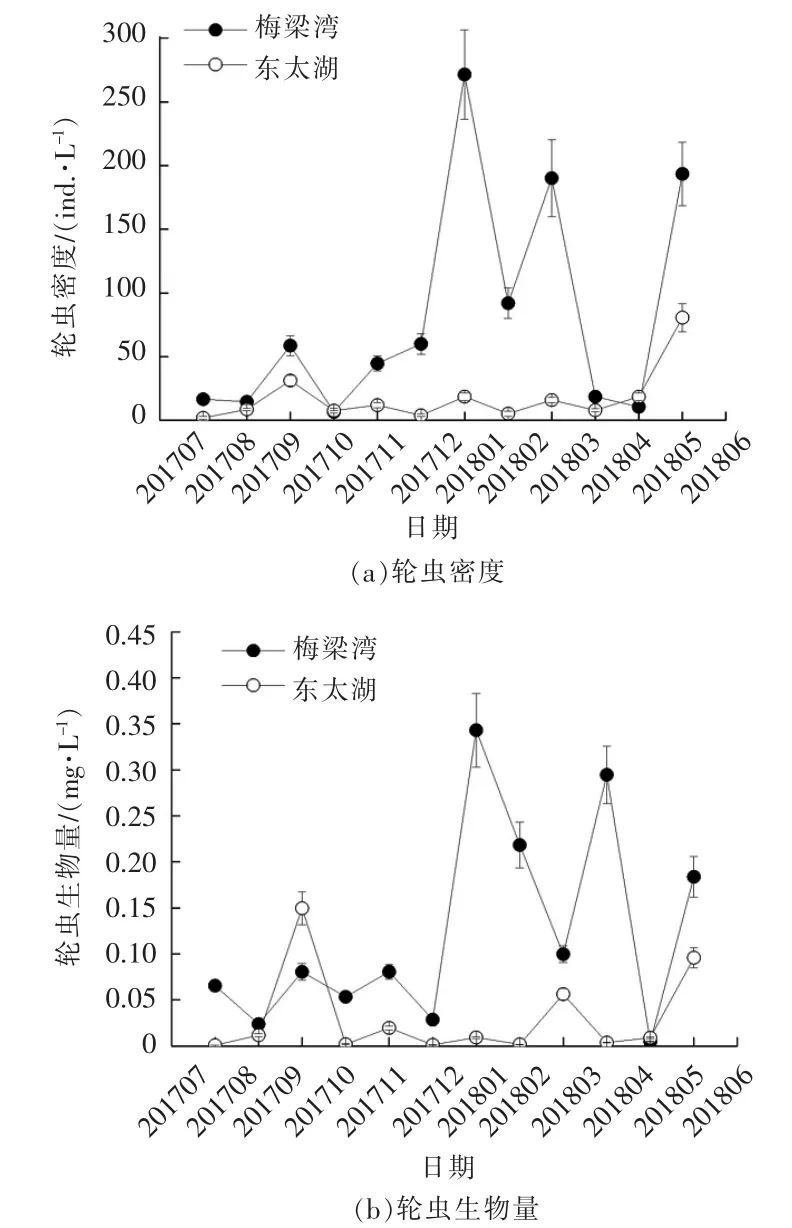
图4 太湖梅梁湾和东太湖轮虫密度和生物量周年变化
由图4 可以看出,梅梁湾轮虫密度除了2017年7月、8月、10月以及2018年4月、5月以外,其它月份都显著高于东太湖轮虫的密度。梅梁湾轮虫密度呈现冬、春季高,夏、秋季低的规律,最高密度出现在2018年1月,为271.3 ind./L;而东太湖轮虫密度则为夏、秋季高,冬、春季低的规律,最高密度出现在2018年6月,为80.7 ind./L。梅梁湾轮虫生物量除了2017年8月、9月,以及2018年5月以外,其它月份都显著高于东太湖轮虫的生物量。梅梁湾轮虫生物量呈现冬、春季高,夏、秋季低的规律,最高生物量出现在2018年1月,为0.343 1 mg/L;而东太湖为夏、秋季高,冬、春季低的规律,最高生物量出现在2018年9月,为0.149 7 mg/L。
(3)轮虫优势种
太湖梅梁湾和东太湖轮虫优势种周年变化见图5。由图5 可以看出,梅梁湾轮虫优势种为针簇多肢轮虫和矩形龟甲轮虫,其占总轮虫数量比例分别为31.38%,18.42%;东太湖轮虫优势种为矩形龟甲轮虫和角突臂尾轮虫,其占总轮虫数量比例分别为34.43%和12.52%。梅梁湾针簇多肢轮虫年平均密度为25.6 ind./L,最高密度出现在2018年1月,为184.7 ind./L;而东太湖针簇多肢轮虫年平均密度只有1.83 ind./L,最高密度出现在2018年1月,为7.3ind./L;梅梁湾矩形龟甲轮虫年平均密度为15.0 ind./L,最高密度出现在2018年6月,为128 ind./L;东太湖矩形龟甲轮虫最高密度为30 ind./L,出现在2018年6月,其年平均密度为6.1 ind./L;梅梁湾角突臂尾轮虫最高密度为39.3 ind./L,出现在2018年3月,其年平均密度为9.7 ind./L,东太湖角突臂尾轮虫最高密度为9.3 ind./L,出现在2018年9月,其年平均密度仅为2.2 ind./L。


图5 太湖梅梁湾和东太湖轮虫优势种周年变化
(4)轮虫与环境因素的相关性分析
对梅梁湾、东太湖轮虫密度和生物量与环境因子进行了Pearson 相关分析,分析结果见表3。

表3 太湖梅梁湾和东太湖轮虫密度和环境因子相关性分析
由表3 可以看出,梅梁湾轮虫密度与悬浮颗粒物浓度呈显著负相关,相关系数为-0.674;梅梁湾轮虫密度与溶解性TP 浓度呈极显著负相关,其相关系数为-0.748,同样,梅梁湾轮虫生物量与溶解性TP 浓度呈显著负相关,相关系数为-0.597。与梅梁湾不同,东太湖轮虫密度与pH 值呈显著正相关,其相关系数为0.612。同一湖泊不同湖区影响轮虫密度和生物量的环境因素不同。
研究表明,梅梁湾轮虫密度和N,P 浓度显著高于东太湖,充足的N,P 有利于藻类的生长。叶绿素a是浮游动物的主要食物来源之一,因此水体中浮游植物的数量与浮游动物的生长繁殖密切相关[14-15]。梅梁湾和东太湖中叶绿素a年平均质量浓度分别为57.10 和23.19 μg/L,说明梅梁湾藻类生物量显著高于东太湖。梅梁湾和东太湖中浮游植物年平均密度分别为10.5×107和2.1×107cells/L,梅梁湾浮游植物年平均数量是东太湖的4.94 倍。水生高等植物通过与藻类竞争N,P 营养盐和光照[16],从而抑制藻类的生长于繁殖,另外,水生植物还可以通过分泌化感物质抑制藻类的生长[17]。王晓菲等[18]发现东太湖藻类受到的水生高等植物的强烈抑制作用是导致东太湖水生植物区域浮游动物数量低于敞水区的原因之一。
研究还发现东太湖湖区轮虫密度在冬、春季低,夏、秋季高,而梅梁湾的轮虫密度则为冬、春季高,夏、秋季低。自然水体中,水温和光照是影响藻类和水生高等植物生长的重要因素[19]。夏、秋季高水温和充足的光照有利于藻类和沉水植物的生长,藻类和沉水植物光合作用快速消化水体中的CO2促使水体pH 值升高,Pearson 相关分析显示,东太湖轮虫生物量与pH 值显著正相关,其相关系数为0.612。东太湖夏、秋季叶绿素a 浓度高于冬、春季,藻类的快速生长为东太湖轮虫的生长和繁殖提供了食物保障。反之,冬季水温低,藻类生长缓慢,导致轮虫食物匮乏,水温的季节变化是影响东太湖轮虫密度变化的重要因素,与王晓菲等[18]研究一致。除了水温,藻类生长还受水体P 浓度的影响。梅梁湾夏、秋季溶解性TP 浓度显著高于冬、春季,充足的溶解性P 有利于藻类生长,然而,夏、秋季藻类主要为微囊藻,野外微囊藻主要以群体形态存在[20],微囊藻群体由于过大不能被轮虫直接摄食。虽然微囊藻死亡后附着的大量细菌以及碎屑可作为轮虫的食物来源[21],但野外调查发现浮游甲壳动物象鼻溞、角突网纹溞在与轮虫竞争中通常处于优势地位[22-23],所以浮游甲壳动物的竞争优势抑制了轮虫的生长与繁殖,导致梅梁湾轮虫在夏、秋季数量少。太湖中微囊藻是悬浮颗粒物的重要组成部分,夏、秋季节高浓度的微囊藻意味着高浓度的悬浮颗粒,Pearson 相关分析显示,梅梁湾轮虫数量与悬浮颗粒物浓度呈显著负相关。太湖梅梁湾紧邻无锡市,无锡市许多河道与梅梁湾相通,城市污水通过河道将大量的有机物污染物及附着细菌等排入梅梁湾,这为轮虫的生长提供了食物。由于冬季梅梁湾水温低,很多浮游甲壳动物难以生存,其数量远低于夏季[24],冬季浮游甲壳动物与轮虫的竞争减弱,因此,梅梁湾轮虫数量冬、春季反而比夏秋季高。杨桂军等[9,25]研究发现2003年~2004年和2006年~2007年太湖梅梁湾轮虫数量表现为冬季高,夏、秋季低的特征,而杨佳等[26]研究发现太湖梅梁湾轮虫数量夏季高于冬季,出现不同研究结果的原因值得进一步研究和探讨。
3 结论
(1)梅梁湾和东太湖轮虫年平均密度分别为81.4 和17.8 ind./L,梁湾湖和东太湖区轮虫年平均生物量分别为0.123 1 和0.030 1 mg/L,太湖梅梁湾轮虫数量和生物量都显著高于东太湖。
(2)梅梁湾轮虫优势种为针簇多肢轮虫和矩形龟甲轮虫,其年平均密度分别为25.6 和15.0 ind./L;而东太湖轮虫优势种为矩形龟甲轮虫和角突臂尾轮虫,其年平均密度分别为6.1 和2.2 ind./L。
(3)东太湖轮虫数量冬、春季低,夏、秋季高,而梅梁湾轮虫数量则为冬、春季高,夏、秋季低。东太湖与梅梁湾轮虫数量季节变化显著不同。

