浮水植物-底泥-微生物系统对富营养化水体氮的净化作用
邬淑婷,周之栋,华建峰,殷云龙,薛建辉
〔江苏省中国科学院植物研究所(南京中山植物园),江苏 南京 210014〕
湖泊水体富营养化已成为水环境污染的一个重要问题,其主要原因是城市生活污水,造纸、炼钢等工业废水以及农药和化肥等地表污染物,包含了大量有机物和无机营养物质[1]。这些物质进入水体后,为藻类及浮游生物提供了充足的生长条件,使其迅速繁殖,造成水体溶解氧不断下降,导致水质不断恶化[2-3]。根据《第二次全国污染源普查公报》,2017年度农业废水、生活废水和工业废水中总氮(TN)含量占比分别为46.61%、48.26%和5.13%,总磷(TP)含量分别为67.24%、30.26%和2.51%[4]。构建人工湿地以进行富营养化水体的生态修复已成为热点研究。水生植物作为湿地生态系统的重要组成部分,是调节水质、减缓水体富营养化的重要载体[5-7]。水生植物不仅能够通过吸收环境中N、P等营养物质,转化为自身可利用的物质;也可以通过向外界排放化感物质,控制藻类的繁殖代谢[8];还能够为微生物提供适宜的生活环境。微生物的存在对水生态环境的修复至关重要[9-10],其主要通过硝化-反硝化作用对人工湿地产生脱氮效应[11-14]。同样,底泥能够通过截留与沉降作用,去除富营养水体中的N、P等[15]。
根据水生植物的生活方式,一般将其分为挺水植物、浮水植物和沉水植物。对芦苇(Hragmitescommunis)、黄花鸢尾(Iriswilsonii)及菖蒲(Acoruscalamus)等挺水植物的研究表明,其对试验水体氨氮(NH4+-N)的去除率均在90%以上,对TN的去除率也不低于75%,其中黄花鸢尾对TN的去除效果较好[12]。刘会等[16]对沉水植物的研究发现,竹叶眼子菜(Potamogetonintortifolius)、黑藻(Hydrillaverticillata)及苦藻(Vallisnerianatans)对水体TN的去除效果较好。与挺水和沉水植物相比,浮水植物水深适应范围广,繁殖迅速,去除N、P能力强,又能遮蔽射入水中的阳光,抑制水体中藻类的生长,更便于种植、收割和日常管理,一直是人工湿地构建过程中重要的植物类型[17]。槐叶萍(Salvinianatans)及浮水莲(Eichhorniacrassipes)对TN的去除效果较好,对提高水体透明度效果也较佳[18]。除了水生植物直接吸收营养物质外,有研究发现,复合微生物对猪场粪污水NH4+-N有明显的削减效果,去除率可达60%以上[19]。在好氧微生物的脱氮作用下,底泥释放的总氮和硝氮的去除率分别高达75.87%和79.96%,底泥内源氮污染得到有效的控制[20]。此外,添加微生物菌剂的生物强化系统对模拟城市污水中NH4+-N和TN的去除率分别提高了56.06%和70.56%,表明微生物作用能够显著改善模拟城市污水系统的运行效果和稳定性[21]。
水生植物具有根系量大且发达的特征,能够与微生物进行协同作用,实现湿地生态系统的高效净化[22]。有研究表明,水生植物通过根系释放氧气与分泌物增加环境体系内的溶解氧与有机质,由于能量及养分源充足,微环境适宜微生物的生长,进而提高了底泥中微生物活性与新陈代谢,促进了富营养化水体C、N和P的循环[23-24]。对杭州西溪湿地挺水、浮水、沉水等湿生植物的研究发现,其底泥具有很高的细菌多样性,且最优势的菌群均为变形菌门(Proteobacteria),在这些类群中具有大量与N、S、P等代谢相关的菌群,对湿地底泥的元素循环有重要作用[25]。此外,人工湿地种植的芦苇与香蒲(Typhaorientalis)的根际细菌群落结构有一定的差别,表现为芦苇根际细菌群落丰富度及多样性均高于香蒲根际,优势细菌种群大多以变形菌门、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)及厚壁菌门(Firmicutes)为主[26]。
构建人工湿地,通过植物-底泥-微生物之间的协同作用[11],不仅能修复生态环境[27],也能达到经济高效的目的[28-29]。然而,现有大部分报道集中于研究单独栽种植物或是添加微生物对富营养化水体的净化作用,或者植物对底泥微生物群落结构的影响,从而间接表明微生物在水体净化中的重要作用,但鲜有将植物-底泥-微生物作为一个系统来研究各途径在富营养化水体净化中发挥的作用。因浮水植物具有水深适应范围广、吸收能力突出且易于收割等特性,以水龙(Ludwigiaadscendens)等华东地区常见的浮水植物为对象,采集池塘底泥,通过植物种植试验和底泥灭菌试验,研究植物-底泥-微生物系统中不同途径对不同富营养化程度水体N的净化作用,为湿地生态系统的生态修复提供科学依据。
1 材料与方法
1.1 供试材料
选择华东地区水域常见的水龙、荇菜(Nymphoidespeltata)、睡莲以及水金英(Hydrocleysnymphoides)4种浮水植物作为研究对象。所选植物均采购自宜兴市龙鼎实业有限公司种植基地,且生长状况良好、形状统一,试验前在自来水中统一驯化培养7 d。
1.2 试验设计
试验在江苏省中国科学院植物研究所(南京中山植物园)试验温室内(32°03′ N,118°49′ E)进行。预先向花盆(内径35 cm,高45 cm)内填充10 kg取自南京中山植物园池塘的底泥,底泥理化性质:w(TN)为2.371 mg·g-1,w〔有机碳(IN)〕为31.101 mg·g-1,w(有机质)为53.618 mg·g-1,w(NH4+-N)为0.031 mg·g-1,w(无机氮)为0.058 mg·g-1。
补充35 L河水(包括底泥,水深约40 cm)并充分混合静置后,加入由硝酸铵(NH4NO3)配制成的3种不同TN质量浓度(2、10、20 mg·L-1)的富营养化水体。然后,将生长状态良好、外形一致(植株大小、形状、叶数、叶色等)、鲜重接近的植株用自来水洗净后种植在花盆内。同时,设置不种植任何植物的花盆作为空白对照(CK)。每个处理各设4个重复,随机区组排列于温室内。试验周期为2019年6月6日—2019年7月16日。试验期间,向各处理花盆内定期加入新鲜自来水补充水分蒸发流失,以保持水位一致。
为了研究微生物在富营养化水体净化中的作用,取与上述试验相同的原始池塘底泥,部分经2次高压灭菌(121 ℃,1 h)以去除体系内微生物,另一部分则未灭菌。分别向花盆(内径15 cm,高20 cm)内填充1 kg原始底泥(US)或灭菌底泥(S),分别补充2 L自来水或灭菌水(包括底泥,水深约15 cm)并充分混合静置后,加入由NH4NO3配制成的3个不同TN质量浓度(3、10、15 mg·L-1)的富营养化水体。每个处理设置3个重复,随机区组排列于温室内。试验周期为2019年9月6日—2019年9月16日。试验期间,向各处理花盆内分别定期加入新鲜自来水或无菌水,补充蒸发流失以保持水位一致。
1.3 样品采集
试验开始后,在第1、10、20、30、40天分别采集10 mL水样测定TN、NH4+-N、NO3--N浓度。试验前后,取花盆内底泥并测定其干样TN及鲜样IN含量。植物收获后,将根与茎叶分开,用蒸馏水洗净后,烘箱内烘干(80 ℃)24 h,测定干重。将植物及风干底泥样品采用研磨机粉碎,植物过0.25 mm孔径筛,底泥过0.15 mm孔径筛后密封于自封袋,用于植物及底泥N含量的测定。同时取根际底泥,用于测定微生物的相关指标。
底泥灭菌试验开始后,在第1、3、5、7、9、11天分别采集10 mL水样测定TN、NH4+-N、NO3--N含量。试验前后,取花盆内底泥并测定其鲜样IN含量。
1.4 样品测定
水体TN、NH4+-N、NO3--N及NO2--N浓度均使用流动分析仪(De Breda,荷兰)测定[30]。植物样品中的N含量采用浓H2SO4-H2O2消解,凯氏定氮法测定[31]。同时选用土壤标准样品(GSS-3)及植物标准样品(GBW07603)控制分析的准确性。底泥IN含量通过Bremner氯化钾法提取后,使用流动分析仪测定。
水体N去除率和底泥N去除率(积累率)[32]的计算方法为
ηw=(C0-Ci)/C0×100%,
(1)
ηs=(Ci-C0)/C0×100%。
(2)
式(1)~(2)中,ηw为富营养水体中N的去除率,%;C0为测定指标的起始浓度,mg·L-1;Ci为试验结束时测定指标的浓度,mg·L-1;ηs为底泥TN和IN的积累率(正值)或去除率(负值),%。
细菌DNA经抽提、浓度和纯度检测后,对其16S rRNA V3-V4区进行PCR扩增。选用引物为515F(5′-GTGYCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACNVGG GTWTCTAAT-3′)[10]。在广东美格基因科技有限公司进行Illumina HiSeq高通量测序。测序数据经过质量筛选,利用Usearch软件以97%相似性水平进行操作分类单元(operational taxonomic unit,OTU)划分,对比Silva数据库进行分类学分析。采用R语言计算Chao、Simpson和Shannon-Wiener多样性指数。
1.5 数据处理
统计分析采用SPSS 25.0软件处理,作图采用Origin 9.1及Excel 2016软件,部分参数比较差异进行单因素方差(One-way ANOVA)及单样本的T检验(t-test)分析,多重比较选用Duncan新复极差方法。
2 结果与分析
2.1 水体N浓度的变化
40 d的生长期内,低N水体中,水金英、荇菜和睡莲处理组TN去除率分别为82.70%、64.25%和65.98%;水龙处理组与对照组对TN的去除效果较差,且显著低于水金英组(P<0.05)。中N水体中,荇菜处理组TN去除率最高(92.43%),且显著高于对照(P<0.05);其他植物处理组(除睡莲组)TN去除率均达90%以上,但与对照组相比并无显著性差异。在高N水体中,对照组和处理组TN去除率均达94%,尤其是荇菜处理组,去除率为96.18%,显著高于其他处理组(P<0.05)。由此可知,在低N水体中水金英去除效果最佳;中、高N水体中去除率为荇菜>水金英>水龙>睡莲。总体上,高N水体中TN的去除率高于其他富营养化水体(图1)。
试验前10 d内,各处理组水体ρ(NH4+-N)迅速下降,其中低N水体以荇菜、睡莲处理组的去除率最高,分别达92.78%和90.48%;而中、高N水体中,植物处理组在前10 d内去除率均高于96%,对照组去除率也高达94.15%。同样,各处理组水体ρ(NO3--N)大幅下降。试验结束时,所有处理组NO3--N去除率均达98.28%以上,ρ均低于0.35 mg·L-1,且各植物处理组(除睡莲组外)之间无显著差异。
2.2 浮水植物对N的积累
随着N浓度的升高,水龙各部位生物量逐渐减少,而荇菜茎叶生物量呈增加的趋势;水金英根生物量在中N水体中显著低于高N水体(P<0.05);同一N浓度系统中,睡莲组植株生物量最高(除中N荇菜组外),且在低、高N水体中显著高于中N水体(P<0.05)(表1)。
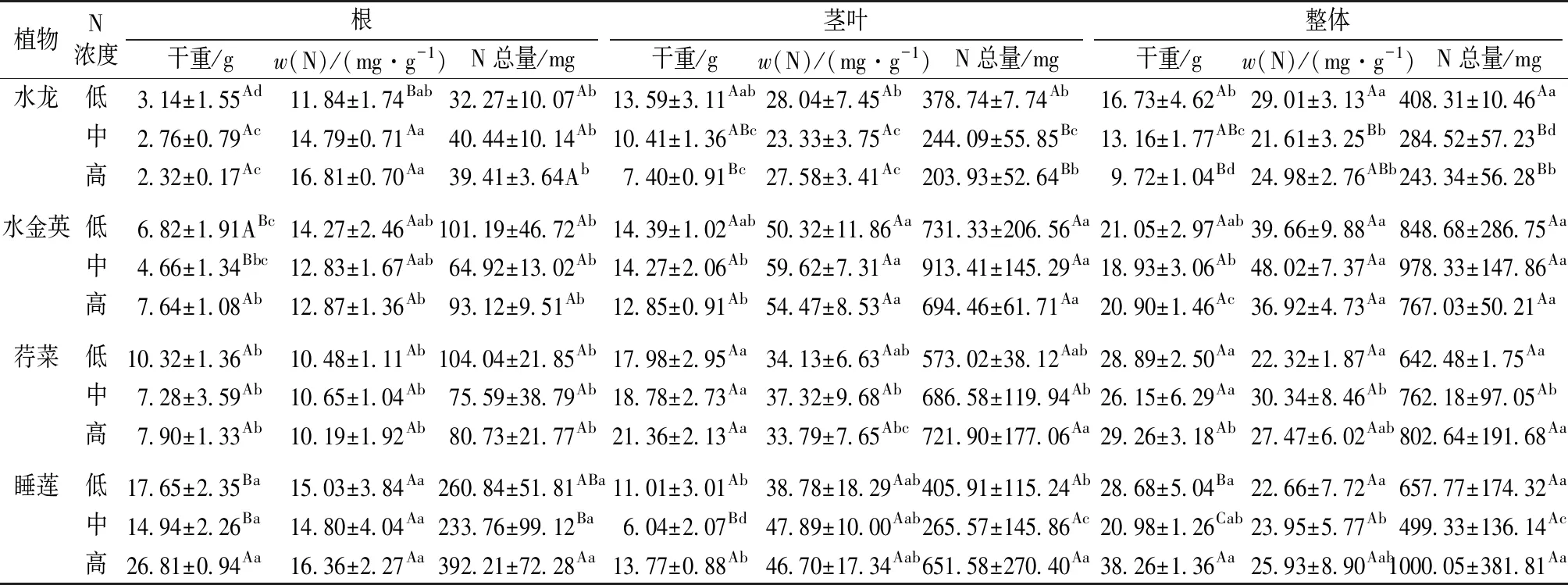
表1 不同N浓度下植株生物量与氮含量Table 1 Plant biomass and N contents of 4 plants under different N concentrations
植物茎叶的w(N)为23.33~59.62 mg·g-1,高于根部(10.19~16.81 mg·g-1)。相比于中、高N水体,低N水体中水龙处理组植株的N积累量更多。睡莲处理组更适应在高N环境中生长,不仅生物量显著高于其他植物(P<0.05),且其对N的积累率也最高。
2.3 底泥N含量的变化
试验结束时,底泥w(TN)为2.02~2.75 mg·g-1,且在不同N水体中及处理之间无显著差异。对照组在任何N水体中均表现出对IN的积累效应,而植物组低N及中N水体中底泥IN均有所去除,低N水体中去除效果依次为荇菜>睡莲>水龙>水金英,中N水体中荇菜>睡莲>水金英>水龙;但高N水体中IN呈现出积累趋势(表2)。
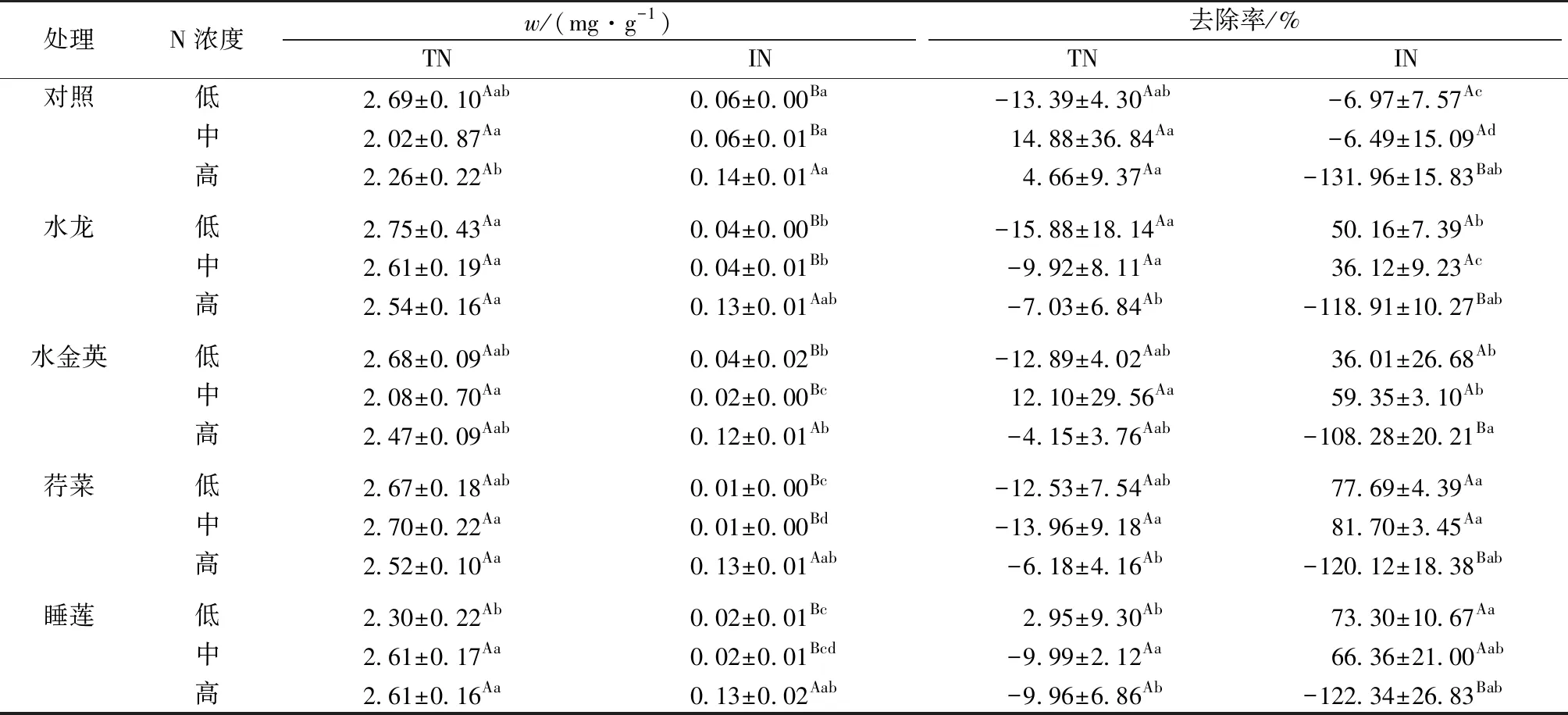
表2 不同处理条件下底泥N含量Table 2 Contents of N in sediments of different systems
2.4 微生物对N去除的影响
微生物处理下,3种N水体中的TN浓度随着时间的推移而降低,而灭菌组水体TN浓度在第1天有所升高,试验末期均稳定在10~12 mg·L-1。除中N水体的第5和7天外,灭菌组3种N水体TN浓度均显著高于有菌组(P<0.05,图2)。试验初期,灭菌组3种N水体NO2--N和NO3--N浓度高于有菌组,但随着时间的推移,其浓度与有菌组趋于一致,均低于0.6 mg·L-1。有菌组水体NH4+-N浓度自试验开始一直呈减少趋势,并在7 d后基本被去除;而灭菌组水体NH4+-N浓度在整个试验周期内均显著高于有菌组(P<0.05),最终ρ分别为7.84、9.37和9.73 mg·L-1。
灭菌组底泥IN含量显著高于有菌组(P<0.05),为有菌组的5~8倍,且不同N水体之间基本无差异。
2.5 植物根际微生物的变化
低N水体中各植物组Chao1指数大于对照组(睡莲组除外),且水龙>水金英>荇菜;中N水体荇菜组和睡莲组大于对照组,而水龙组和水金英组则低于对照组。高N水体中,所有植物组均小于对照组。Shannon指数在7.15~7.35之间,Simpson指数在0.99以上浮动,各水体之间并没有显著差异(表3)。

表3 植物根际底泥细菌α多样性指数Table 3 α diversity index of bacteria in rhizosphere soil
各水体中优势菌均为变形菌门,平均相对丰度为41.28%,其次为绿弯菌门(Chloroflexi,17.56%)、拟杆菌门(Bacteroidetes,9.38%)、绿菌门(Chlorobi,4.76%)、疣微菌门(Verrucomicrobia,4.19%)、酸杆菌门(Acidobacteria,3.93%)和硝化螺旋菌门(Nitrospirae,2.63%)(图3)。低N浓度处理下,所有植物组变形菌门和硝化螺旋菌门相对丰度均高于对照组。此外,除了荇菜在中、高N浓度处理以及睡莲在高N浓度处理外,其余各植物组硝化螺旋菌门均高于对照组。低、中N浓度处理下荇菜组及高N浓度处理下睡莲组中,绿弯菌门相对丰度均高于对照组,但无显著性差异(图3)。
在属水平上,所测得的OTUs共552个门类。平均相对丰度最高的为硫杆状菌属(Thiobacillus,12.59%),其次为Sideroxydans(9.52%)、Ignavibacterium(6.40%);平均相对丰度大于3%的属还有脱硫杆菌属(Desulfatiglans,3.86%)、螺杆菌属(Sulfuricurvum,3.49%)、厌氧绳菌属(Anaerolinea,3.45%)、Ferritrophicum(4.03%)、螺旋体属(Spirochaeta,2.73%)和互营菌属(Syntrophus,3.11%)。但各处理之间微生物群落结构差异并不显著(图4)。
3 讨论
以往大量研究将植物在不添加底泥[33-35]的环境下进行培养,其对水体N的去除效果显著优于对照组。笔者添加池塘底泥后发现,对照组和植物组均具有较高的N去除率,而且大部分情况下两者无显著差异。40 d后,中、高N水体中TN去除率均高于87%,此外NH4+-N和NO3--N的去除率大部分也超过90%,高于大多数人工配置富营养化水体的模拟试验[6,36]。
与刘利华等[37]的研究结果类似,随着水体N浓度的升高,水体N去除率也随之增加。在水体N浓度水平较低的条件下,N是植物生长的限制因子,而随着水体N浓度的增加,植物生长更快,吸收利用的N越多,对水体N的去除率也就越高[38]。在不同N浓度水体中,同一植物的最终生物量基本(除水龙及睡莲外)无明显差异。但整体而言,睡莲、荇菜、水金英对营养的转化吸收高于水龙,对N的积累也明显较高。可见,生物量是决定体系净化能力的一个重要因素,植物净增长越高,其带走体系内的富营养物质就越多[33]。
此外,对照组虽然没有因植物对N的吸收积累而产生N的消减作用,但其水体N的去除效率仍然较高。通过对底泥IN的分析发现,低N和中N水体中,对照组底泥IN含量显著高于植物处理组。可见,低N和中N水体中部分N仅仅因为沉降作用留在底泥中。李胜男等[39]通过对不同湿地植物N的研究发现,水体中TN浓度不仅依赖于植物积累,也与底泥的作用有关,因为整个系统内,底泥与水体一直在进行N的循环交换。周林飞等[40]通过是否添加底泥对6种植物水质理化性质进行研究,发现底泥对水体N有一定的吸附作用。高N水体中植物组底泥IN含量低于对照组,但是两者之间没有显著差异。整个系统的N浓度超出了植物对N的吸收范围,呈现出底泥IN积累的趋势。可见,植物对IN的吸收也有一定的限制。
湿地生态系统中的N除了通过植物直接吸收和沉降去除外[6,10,41-44],微生物在其消减过程中也发挥着重要作用。大量研究表明,微生物的生命活动可以将水体N通过其自身新陈代谢(包括硝化与反硝化以及氨的挥发等)以及高降解转化作用去除[25]。水生植物的种植加速了水体-底泥-植物系统中底泥N的释放,为底泥微生物提供了充足的N源,显著提升了其活性及N循环菌的数量,促进了系统内的N循环[41]。刘丹丹等[42]通过模拟生态柱种植伊乐藻,同时添加固定化N循环菌系统,认为沉水植物对微生物反硝化过程的促进大于其本身对N的吸收作用。而且不同植物区的底泥微生物群落在丰富度和多样性上均有所差异,而不同采样点的相同植物类型中,微生物群落组成较为相似,表明种植植物及植物种类对微生物群落结构有显著影响,且N浓度对微生物群落结构有一定的影响[10]。通过对长江口崇明东滩湿地微生物群落结构的研究发现,就细菌16S rRNA 基因拷贝数而言,植被区底泥远远高于光滩区表层,且门水平中占比较高的绿弯菌门对底泥TN、NH4+-N和NO3--N较为敏感,呈显著正相关[45]。但是笔者研究表明,植物处理的根系微生物群落并未发生显著变化,这可能是因为试验周期较短以及底泥自身营养物质较为丰富,植物尚无法通过改变生境的营养环境来影响其菌落组成结构的多样性[45]。
灭菌组水体TN和底泥IN的去除效果显著弱于有菌组,该现象解释了对照组无植物种植,但也能在短时间内对各个形态的N有较高的去除率。灭菌组水体TN和NH4+-N浓度升高则可能是因为高温灭菌条件下,土壤理化结构被破坏,土壤有机质被分解,导致土壤中部分TN和NH4+-N进入至水体[46]。可见,底泥原有的微生物群落足以在富营养化水体净化中发挥巨大作用。优势菌种以变形菌门、绿弯菌门和酸杆菌门为主,与已有研究相一致[10,47]。其中,变形菌门包括许多固N细菌,对N的转化及植物吸收有促进作用[26]。Sulfuricurvum属、Ferritrophicum属、Sulfuricella属、Thiobacillus属与Sulfuricurvum属归属于变形菌门,包括氨氧化菌、亚硝酸氧化菌以及反硝化菌等[48]。其中,Ferritrophicum属为自养反硝化菌[49]。Thiobacillus属是专性化能自养型硫氧化菌,能将单质硫、硫化物等底物氧化为硫酸盐,同时也是典型的硝酸盐依赖型亚铁氧化菌,氧化Fe(Ⅱ)的同时,利用NO3-作为电子受体并耦合还原为NH4+[50],其大部分菌群可在厌氧条件下进行自养反硝化作用[45]。Thiobacillus属及Sulfuricurvum属相对丰度较高,与对照组及试验组水体前期NO3--N迅速下降,且最终去除率绝大多数高达90%以上的情况相关性较高。总体占比第2的绿弯菌门是一类以CO2为C源,通过光合作用产生能量的细菌。绿弯菌门的这种光合特性可使其在 SOC含量较低的底泥中具有竞争优势[51-52],同时对枯枝腐叶的C循环分解具有潜在作用[41]。此外,硝化螺旋菌门占比较高,其中的硝化螺旋菌属包含了大量的氨氧化菌[36],可以将环境中的NO2--N氧化成NO3--N,在水体中参与N循环,对于促进NH4+-N、NO3--N的转化及水生植物的生长具有重要意义[25]。
有研究表明,当水体遭到新的污染时,有机N被微生物氧化分解为NH4+-N,而NH4+-N去除周期较短,一般在7 d左右即可达到稳定,所以这期间TN浓度迅速下降[53]。同时,因底泥中一般带负电荷,能够吸引带正电的NH4+-N,其能够通过物理吸附和絮凝沉淀等作用使水体中的N沉降,由此使水体中NH4+-N浓度降低[54]。而在移栽初期,植物为维持自身生长需要,需要大量水分与养分,也导致试验前10 d内NO3--N浓度的迅速下降[55]。当植物适应移栽环境后,其对营养的需求减少;且随着植物体内各种元素的再分配,使得植物吸收水体N的速率减慢,导致水体TN、NH4+-N及NO3--N浓度降低速度趋于平缓[56],而且微生物在富营养化水体N净化中的作用远大于植物。
4 结论
4种水生植物通过对N的吸收累积作用,在一定程度上降低了不同富营养化水体的NH4+-N、NO3--N及TN浓度,其中睡莲、荇菜及水金英效果较好。此外,低N和中N浓度处理的N沉降现象,也使其表现出了较高的水体N去除效应。由于试验周期较短(40 d),种植水生植物并没有显著改变根际底泥微生物群落结构。但是,底泥灭菌试验表明,微生物在富营养化水体净化过程中发挥了至关重要的作用。该研究阐明了富营养化水体中N的去除路径,为有效构建人工湿地,利用水生植物、底泥和微生物,高效、安全、持续地去除富营养化水体的N提供了科学依据。

