北艾根际与非根际土壤微生物多样性的高通量测序分析
吴秋芳, 侯立江, 何玲敏, 郜新强, 张美玲, 王景顺
(安阳工学院生物与食品工程学院,河南 安阳 455000)
北艾(ArtemisiavulgarisL.)为优质道地药材,产于河南省汤阴县,素有“仙艾”美称,是传统的中药材[1]。北艾与宛艾等其他艾草品种一样,富含精油类、黄酮类和糖类等主要成分,具有抑菌、抗虫、平喘、镇咳、祛痰、镇静及抗过敏、抗氧化、抗肿瘤等药理活性作用,广泛应用于医药产品、动物饲料以及消毒剂等日用品中[2-4]。随着北艾的声名远播及其产品销量的与日俱增,提高北艾的品质和产量已成当务之急。微生物是根际土壤的重要组成部分,植物生长与根际微生物相互作用。植物根际分泌物为根际微生物生长提供了营养物质,直接影响微生物的分布[5];而根际微生物群落结构变化影响植物的生长发育状况,甚至决定植物的产量与品质[6-7]。部分根际微生物通过产生激素类物质促进土壤有机质分解、诱导植株抗性增加等,或者通过争夺营养和占领生态位等方式抑制病原菌生长来间接促进植物的生长[8]。根际微生物群落结构失调会导致病原菌数量的增加,从而使植物病害加重品质变劣、产量降低。目前,有关艾的研究多集中于其主要化学成分的药理活性[3]和艾叶内生菌的分离、纯化、鉴定和抑菌方面。冉芳静[9]通过去离子水浸提法和索式提取法得到的艾叶提取物,与购买的商业化艾叶提取物对比具有更好的抑菌效果。张秀敏等[10]从艾叶药用植物中共分离得到19株内生放线菌,其中2株对禾谷镰刀菌(FusariumgraminearumSchw.)、水稻胡麻斑病菌(Bipolarisoryzae(Breda deHaan)Shoem)和肠球菌(Enterococcussp.)具有拮抗活性,3株对耐青霉素类金黄色葡萄球菌(Staphyloccocusaureus)具有拮抗活性。史晓晶等[11]采用对峙培养初筛和发酵液复筛相结合的方法,从艾根茎接合部位也分离筛选出抑菌活性较强的10株内生放线菌,为艾草病害生物防治提供了理论依据。对植物生长有重要影响的不仅有植物内生菌,还有根际微生物群落结构。但是,目前关于北艾与根际微生物相互作用的研究尚未见报道,北艾在生长过程中与根际微生物相互作用的机制也不明确。因此,了解北艾根际真菌和细菌群落结构和多样性的变化,对评价土壤微生物对北艾乃至不同品种艾的生长和品质的影响具有重要意义。
根际微生物中包括大量不可培养微生物,这限制了传统培养技术在根际微生物研究中的应用,而近年来发展起来的分子生态学技术,又存在检测限低、工作量大和灵敏度低等缺点[12]。相对于以上研究手段,高通量测序技术具有速度快、成本低以及准确度高等优点,能更真实反映环境中群落特点。因此,本研究采用高通量测序技术对栽培2 a的北艾根际和非根际土壤真菌、细菌群落组成的多态性和主成分进行对比分析,旨在探究北艾根际微生物群落结构多样性及变化,为下一步进行北艾间套混作和对北艾产量品质影响的研究提供科学依据和指导。
1 材料与方法
1.1 试验地概况
试验地位于河南省汤阴县(35°45′~36°01′N,114°13′~114°42′E),该区域土壤为沙壤土,年平均气温为21 ℃,年日照时数 2 369.9 h,无霜期206 d,年平均降水量606.1 mm,暖温带半湿润大陆性季风气候,气候温和,四季分明。
1.2 样品采集
土壤样品于2020-08-26采自汤阴扁鹊庙外2 a连作第3茬北艾地,北艾处于旺盛营养生长期,该地人工除草,未施化肥,1 a共2茬。本研究挖取艾草植株,抖落根部松散土壤后,用消毒的刷子收集粘在北艾根际的土壤,视为北艾根际土壤样品;而非根际土壤为距离北艾根系表面5~10 cm范围内5~20 cm土层的土壤;装入无菌密封塑料袋中,注明取样编号、名称、地点、日期和采集者。土壤样品标记为AG-1(移栽2 a田),非根际土壤样品标记为AG-2(对照田),每个样地3份样品。去除枯枝落叶,过100目筛,于-80 ℃保存。
1.3 试验方法
1.3.1 土壤总DNA 的提取与电泳检测 使用OMEGA试剂盒提取土壤微生物基因组总DNA,经琼脂糖凝胶电泳定性检测后,再采用核酸定量分光光度计(NanoDrop,美国)测定浓度后置于-20 ℃保存备用。
1.3.2 18S rRNA ITS1-ITS2区的PCR扩增及测序 以提取的总DNA 作为模板,PCR扩增引物为真菌ITS1-ITS2区的特异性引物(ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′;ITS2R:5′-GCTGCGTTCTTCATCGATGC-3′),针对土壤DNA 中真菌的核糖体内转录间隔区( internal transcribed spacer,ITS) 的ITS1-ITS2 区域进行扩增。PCR 反应体系:Phusion Master Mix(2×)15 μL、Primer(2 μmol·L-1)3 μL、gDNA(1 mg·L-1)10 μL、ddH2O 2 μL。反应程序为95 ℃预变性3 min,25个循环包括 94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,72 ℃最终延伸7 min。将PCR产物通过质量分数2%的琼脂糖胶在1×TAE溶液中电泳PCR 产物,割胶回收目标条带,回收纯化PCR产物,构建测试文库,经过Qubit 3.0定量和文库检测,合格后由生工生物工程(上海)股份有限公司通过Illumina MiSeq测序平台进行高通量测序。
1.3.3 16S rRNA V3-V4 区的PCR扩增及测序 以提取的总DNA作为模板,PCR扩增引物为细菌的16S rRNA的V3-V4区域( 341F:5′-CCTACGGGNGGCWGCAG-3′;805R:5′-GACTACHVGGGTATCTAATCC-3′)进行PCR,对细菌的16S rRNA V3-V4区进行扩增。PCR 反应体系共30 μL: Phusion Master Mix(2×)15 μL、Primer(2 μmol·L-1)3 μL、gDNA(1 mg·L-1)10 μL、ddH2O 2 μL。扩增程序为95 ℃预变性3 min,30个循环94 ℃变性30 s,55 ℃退火20 s,72 ℃延伸30 s,最终72 ℃延伸7 min。对PCR产物进行纯化、定量和均一化形成测序文库,对建好的文库先进行文库质检,质检合格的文库用Illumina HiSeq 2500平台进行测序,PCR扩增及测序工作由生工生物工程(上海)股份有限公司完成。
1.3.4 生物信息学分析 可操作分类单元(operational taxonomic unit,OTU)集群使用Uparse,在97%相似水平上对OTU代表序列进行聚类分析,并在不同分类水平上统计各样本群落组成。稀释曲线分析采用Mothur软件。采用Shannon指数、Simpson指数和物种丰富度指数(ACE)、Chao1指数,计算微生物生态多样性指数[13]。功能基因使用Blast在NCBI NT数据库(https://ftp.ncbi.nih.gov/blast/db)进行比对。将优化序列根据数据库中的参考序列在门、纲、科、属的水平上进行鉴定,比较分析其群落组成、丰度以及多样性。主成分分析(principal component analysis,PCA)利用R软件[14]。采用SPSS17.0软件进行差异显著性分析。
2 结果与分析
2.1 北艾根际和非根际土壤微生物质量分析
通过高通量测序获得了北艾根际和非根际土壤真菌和细菌群落的优化序列及其属或种类数等OTU的信息(表1)。双端序列(reads)拼接及过滤后,得到北艾根际土壤真菌和细菌分别为101 536和27 323条Clean tags,非根际土壤真菌和细菌分别为84 723和23 351条Clean tags。基于大于等于97%的相似度水平,通过聚类分析,真菌共获得785个用于物种分类的OTUs,根际和非根际土壤真菌OTUs数量分别为553和232;细菌共获得2 392个用于物种分类的OTUs,根际和非根际土壤细菌OTUs数量分别为1 253和1 139。北艾根际土壤中真菌和细菌的OTUs数量均大于非根际土壤,表明与非根际土壤相比,北艾根际土壤中真菌和细菌的种群更丰富。

表1 北艾根际和非根际土壤微生物的物种丰富度和多样性指数Table 1 The species richness and diversity index of microbial in rhizosphere and non-rhizosphere soils of Artemisia vulgaris L.
2.2 北艾根际和非根际土壤微生物多样性分析
生物多样性指标中Shannon指数、Chao1指数和Ace指数的数值越大,说明被测样品群落多样性越高;而Simpson指数值越小,则说明生物多样性越高。从表1可以看出,北艾根际土壤微生物的Shannon指数、Chao1指数、Ace指数都大于非根际土壤的指数值。北艾根际和非根际土壤样品中细菌Simpson指数数值虽然相同,但北艾根际土壤真菌Simpson指数为0.04,小于非根际土壤0.08,这说明根际微生物菌群多样性水平高于非根际土壤。
2.3 北艾根际和非根际土壤真菌组成分析
通过高通量测序发现,北艾根际与非根际土壤中共检测到真菌的4个菌门(图1),包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)和球囊菌门(Glomeromycota)。子囊菌门是北艾根际与非根际土壤真菌中的优势类群,相对丰度分别为68.40%和70.49%;其次是担子菌门,相对丰度为6.21%和6.37%;北艾根际土壤真菌还包括特有的球囊菌门,相对丰度为3.96%。另外,北艾根际和非根际土壤真菌中存在待定真菌门unclassified_Fungi、unclassified类群,相对丰度分别为15.88%和1.70%、1.51%和14.78%。同时,其他未知真菌在北艾根际土壤真菌中也占很大比例。
从纲、目、科和属水平上进行分析,北艾根际与非根际土壤真菌在群落组成和丰度上存在差异(图2)。从纲水平分析,子囊菌门中的子囊菌纲(Sordariomycetes)在北艾根际和非根际土壤真菌中均为第1大纲,相对丰度分别为46.43%和37.56%;其次是座囊菌纲(Dothideomycetes),相对丰度分别为15.61%和25.19%。在担子菌门中,优势菌纲为伞菌纲(Agaricomycetes),相对丰度分别为5.68%和4.63%。从目水平分析,子囊菌纲中主要包括格孢腔菌目(Pleosporales),相对丰度分别为14.88%和1.74%;伞菌纲中伞菌目(Agaricales)相对丰度分别为3.47%和4.57%。从科水平分析,丛赤壳科(Nectriaceae)为优势菌科,在北艾根际土壤真菌中相对丰度为19.50%,远高于在非根际土壤真菌中相对丰度10.04%,同时2种土壤中共有的真菌还包括毛球壳科(Lasiosphaeriaceae)和毛壳菌科(Chaetomiaceae)等。另外,被孢霉科(Mortierellaceae)在北艾根际土壤真菌中相对丰度为1.92%,低于在非根际土壤真菌中相对丰度5.75%。在北艾根际土壤真菌中还发现另外6科,火丝菌科(Pyronemataceae)相对丰度为1.25%、圆盘菌科(Orbiliaceae)相对丰度为1.53%、子囊菌科(Phaeosphaeriaceae)相对丰度为7.43%、荚孢腔菌科(Sporormiaceae)相对丰度为3.62%、球囊霉科(Glomeraceae)相对丰度为3.09%、鬼伞科(Psathyrellaceae)相对丰度为3.29%;但是,在北艾非根际土壤中发现了独有的白蘑科(Tricholomataceae)。从属水平分析,北艾根际土壤真菌中优势属包括unclassified_Xylariales相对丰度为12.64%、unclassified相对丰度为15.88%、柄孢壳菌属(Podospora)相对丰度为10.13%、镰刀菌属(Fusarium)相对丰度为10.06%、赤霉菌属(Gibberella)相对丰度为8.24%、拟茎点霉属(Paraphoma)相对丰度为7.39%;北艾非根际土壤真菌中优势属包括unclassified_Dothideomycetes相对丰度为22.64%、unclassified相对丰度为14.78%、镰刀菌属相对丰度为14.32%、unclassified_Xylariales相对丰度为9.12%、被孢霉属(Mortierella)相对丰度为5.75%、unclassified_Tricholomataceae相对丰度为4.57%、毛壳菌属(Chaetomium)相对丰度为4.66%。2种土壤真菌共有的属包括镰刀菌属、unclassified_Xylariales;北艾根际土壤真菌中特有的包括拟茎点霉属、柄孢壳菌属、Arthrobotrys、赤霉菌属、Glomus、拟茎点霉属、Minimedusa以及Psathyrella等;非根际土壤真菌中特有的包括unclassified_Dothideomycetes、Pseudeurotium、Udeniozyma、Cladorrhinum、Malbranchea以及Badarisama。
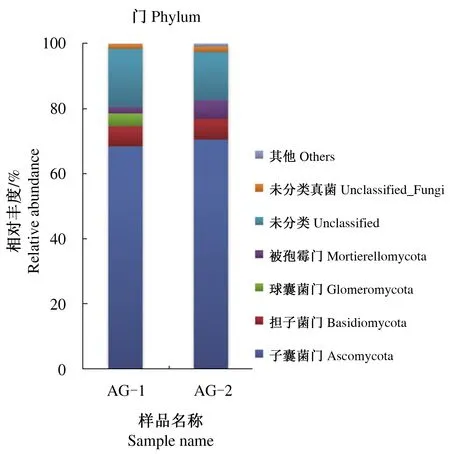
图1 北艾根际和非根际土壤真菌群落在门水平上的分布Fig.1 Distribution of fungal communities in rhizosphere and non-rhizosphere soils of Artemisia vulgaris L. at the phylum level
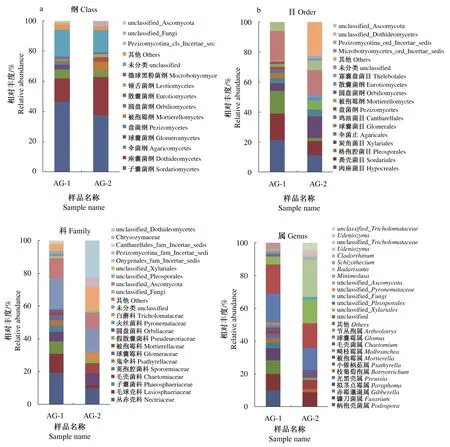
注:a. 纲水平;b. 目水平;c. 科水平;d. 属水平。下同 Note:a. Class level; b. Order level; c. Family level; d. Genus level. The same as below.图2 北艾根际和非根际土壤真菌群落的相对丰度Fig.2 Relative abundance of fungal communities in rhizosphere and non-rhizosphere soils of Artemisia vulgaris L.

图3 北艾根际和非根际土壤细菌群落在门水平上的分布Fig.3 The distribution of bacterium communities in rhizosphere and non-rhizosphere soils of Artemisia vulgaris L. at the phylum level
2.4 北艾根际和非根际土壤细菌组成分析
北艾根际和非根际土壤中优势细菌主要分布在6个门(图3),即变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)和疣微菌门(Verrucomicrobia)。其中,优势类群为变形菌门,在北艾根际和非根际土壤中相对丰度分别为32.24%和34.80%;其次是酸杆菌门,相对丰度分别为24.34%和23.61%;拟杆菌门相对丰度分别为7.11%和7.21%;放线菌门相对丰度分别为5.57%和6.82%;芽单胞菌门相对丰度分别为4.34%和6.90%;疣微菌门相对丰度分别为3.90%和2.02%。
从纲、目、科、属水平上分析,北艾根际与非根际土壤中细菌群落组成和丰度上存在差异(图4)。从纲水平分析,在北艾根际和非根际土壤细菌中,变形菌门的α-变形菌纲(Alphaproteobacteria)是第1大纲,相对丰度分别为20.39%和18.20%;放线菌门的优势菌纲是放线菌纲(Actinobacteria),相对丰度分别为6.46%和5.48%。从目水平分析,鞘氨醇单胞菌目(Sphingomonadales)是北艾根际与非根际土壤细菌第1优势目,相对丰度分别为11.48%和10.22%。从科水平分析,norank_Acidobacteria_Gp4、鞘氨醇单胞菌科(Sphingomonadaceae)、norank_Acidobacteria_Gp6是北艾根际和非根际土壤细菌中3大优势科,相对丰度分别为12.27%和11.80%、11.93%和10.99%、4.34%和6.3%;此外,在北艾根际土壤细菌中还发现了根瘤菌科(Rhizobiaceae),相对丰度为1.10%。从属水平分析,北艾根际和非根际土壤细菌中鞘氨醇单胞菌属(Sphingomonas)是第1优势属,相对丰度分别为11.48%和9.26%,差距为2.22%;北艾根际土壤细菌中芽单胞菌属(Gemmatimonas)和WPS_1_genera_incertae_sedis相对丰度高于其在非根际土壤细菌中的相对丰度。这表明,北艾根际和非根际土壤中细菌群落分布有明显差异。

图4 北艾根际和非根际土壤细菌群落的相对丰度Fig.4 Relative abundance of bacterium communities in rhizosphere and non-rhizosphere soils of Artemisia vulgaris L.
2.5 北艾根际和非根际土壤微生物的主成分分析结果
PCA分析是运用线性代数的知识进行数据降维的方法,将原始高维数据变换组合,投影到维度较低的空间坐标系(即主成分)中,展现样本的自然分布;每个点代表1个样本,2点之间的距离越近,表明2个样本之间的微生物群落结构相似度越高,差异越小;坐标轴括号中的比例代表了对应的主成分所能解释的原始数据中差异比例。图5为微生物在门水平上的PCA图,椭圆形分别代表该PCA模型拟合出的北艾根际和非根际土壤微生物群落。图5-a表明,PC1和PC2分别解释了真菌群落结构83.06%和13.08%的变异;图5-b表明,PC1和PC2分别解释了细菌群落结构82.41%和12.72%的变异。这说明,北艾根际和非根际微生物群落结构有较大的差异,北艾的种植改变了土壤微生物的群落结构组成。

注:a. 真菌;b. 细菌 Note:a. fungi; b. bacterium图5 北艾根际和非根际土壤微生物PCA分析图Fig.5 PCA diagram of microbial in rhizosphere and non-rhizosphere soils of Artemisia vulgaris L.
3 结论和讨论
本研究通过高通量测序平台对北艾根际土壤进行了宏基因测序,获得真菌18S rRNA ITS1-ITS2序列和细菌16S rRNA V3-V4序列。Shannon 指数、Chao1 指数、ACE 指数、Simpson指数等4个指标均表明北艾根际土壤中的微生物多样性高于非根际土壤。北艾根际土壤真菌、细菌序列数分别比非根际土壤多16 813条和3 972条;根际土壤拥有更多独有的OTUs,这与李小林等[15]研究结果一致。本研究中,北艾根际和非根际土壤真菌在门分类水平上,子囊菌门占优势地位,这与付亚娟等[16]研究的大花杓兰根际和非根际真菌生物群组成相似。在属水平上,北艾根际和非根际土壤真菌主要优势属种类存在较大差异。本研究表明,北艾根际土壤真菌中,优势属是unclassified_Xylariales和柄孢壳菌属;非根际土壤真菌中unclassified_Dothideomycetes和镰刀菌属为优势属。Unclassified_Xylariales属于子囊菌门,已有研究表明,该属的某些微生物能够改善植物抗菌、抗氧化的作用,增加植物的生物量,从而提高北艾的抗病性,促进北艾的生长[17]。柄孢壳菌属中的丝状模式真菌Podosporaanserine含有降解木质纤维素的蛋白酶类,提高了北艾根际土壤中杂草茎叶的降解效果,改善了土壤肥力,促进了北艾的健康生长[18]。北艾非根际土壤真菌中的unclassified_Dothideomycetes是座囊菌纲中未分类群,座囊菌纲中某些属是引起水果及木本植物的重要病原。北艾非根际土壤具有丰富的镰刀菌属,李泽宇等[17]研究表明,该属的菌株FSF029降解纤维能力较好,但该属某些菌株同时也是重要的致病菌,能引起植物根部病害。因此,本研究中该属真菌在土壤中的数量变化是否与根部病害有直接关联,还需要进一步研究。
北艾根际和非根际土壤细菌在门分类水平上,优势门均为变形菌门,其次为酸杆菌门、拟杆菌门、放线菌门、芽单胞菌门和疣微菌门。这与前人的研究结果基本一致[19],但在相对丰度上存在差异。本研究中,相对丰度相对较高的菌属有鞘氨醇单胞菌属,该属在北艾根际土壤细菌中比非根际高2.22%,其原因有待进一步研究。鞘氨醇单胞菌属耐受贫营养,具有极强的生命力,该属某些微生物能分泌吲哚-3-乙酸等物质,能够促进植物生长和降解有机物[20-21],并能产生N-乙酰基-高丝氨酸内酯,在烟草抗病性、生物信息交流方面发挥着重要调控作用[15]。此外,在北艾根际与非根际2种土壤中,unclassified和其他类真菌及细菌均占有较大比例,这表明北艾根际和非根际土壤中存在大量的未知新类群,其土壤生态学功能有待研究。本研究表明,北艾根际和非根际土壤微生物,在优势门、属上存在一定差异,推测是由于北艾根系分泌的某些化学物质或是土壤其他理化性质引起的,需要进一步研究。植物根系释放分泌物,为根际微生物提供重要的营养物质;而根际微生物能够释放土壤酶,在降解纤维素和有机物、催化有机质矿化和腐殖质合成等方面发挥着重要作用,对土壤理化性质以及微生物群落结构的分布等方面也有重要影响。根际微生物与植物彼此作用,可以促进或抑制其生长,直接影响药用植物产量和有效成分量的变化[22-23]。北艾根际为土壤微生物繁殖提供了良好的生态环境,而土壤微生物可通过释放多种土壤酶,驱动纤维素降解与抑菌抗病,对改善植物根际土壤养分以及提高艾的抗病性等产生促进作用,这与全妙华等[24]研究的中药材忽地笑栽培土壤根际真菌群落结果基本一致。本研究结果表明,北艾根际土壤相对于非根际土壤,微生物群落结构和多样性更为丰富,土壤微生物种类和分布存在差异但不显著,北艾根际土壤较非根际土壤中促进植物生长和降解有机物的微生物物种占据优势。

