南京两医院体检人群尿液中有机磷酸酯代谢物与氧化应激水平的关联
张红丹,徐诚,王彤,张娟,宋宁慧
1.东南大学 a.公共卫生学院 b.环境医学工程教育部重点实验室,江苏 南京 210009
2.生态环境部南京环境科学研究所,江苏 南京 210042
2009年,《斯德哥尔摩公约》将多溴二苯醚列为持久性有机污染物,有机磷酸酯(organophosphate esters,OPEs)替代多溴二苯醚,作为一类新兴阻燃剂被广泛应用[1]。OPEs 主要用作塑料、聚氨酯泡沫、纺织品、热固性涂料和高分子混合物中的阻燃剂和添加剂[2]。OPEs 还应用于电子设备[3]、婴儿产品[4]和食品包装[5]。2004—2015年,全球OPEs 的总消费量由21 万t 增长至68 万t,并逐年增长[6-8]。OPEs 用作材料添加剂可能会因非化学键结合而轻易地通过挥发、产品磨损和泄漏释放到环境中[2]。因此,大气[9]、水[10]和土壤[11]中已经广泛检测到OPEs。目前,住宅[12]、办公空间[13]和育儿场所[14]等许多人居环境中也检测到OPEs。
OPEs是合成磷酸衍生物,其结构按照酯键的不同可大致分为三类:氯化OPEs、烷基OPEs和芳基OPEs。OPEs 可通过I 相和II 相生物转化代谢为更亲水且更易消除的代谢物[15]。
OPEs 经I 相代谢产生的主要代谢产物为磷酸二酯[16]:氯化OPEs磷酸三(2-氯乙基)酯(TCEP)、磷酸三(2-氯丙基)酯(TCPP)和磷酸三(1,3-二氯异丙基)酯(TDCPP)经I 相代谢产生双(2-氯乙基)磷酸酯(BCEP)、双(1-氯-2-丙基)磷酸酯(BCPP)和双(1,3-二氯-2-丙基)磷酸酯(BDCPP);烷基OPEs 磷酸三乙酯(TEP)、磷酸三正丁酯(TnBP)和磷酸三(2-丁氧基乙基)酯(TBEP)经I相代谢产生磷酸二乙酯(DEP)、磷酸二正丁酯(DnBP)和双(丁氧乙基)磷酸酯(BBEP);芳基OPEs 磷酸三苯酯(TPhP)经I 相代谢产生磷酸二苯酯(DPhP)。尿液中量化的磷酸二酯已被确定为评估人类OPEs 暴露的生物标志物[17-18]。
以往的研究发现,暴露于OPEs 可引起神经毒性[19]、生殖毒性[20]和内分泌紊乱[21]等。动物和细胞实验表明,暴露于OPEs 能够引起氧化应激[22-23]。氧化应激导致线粒体和核DNA 的损伤,产生脂质过氧化作用[24]。8-羟基-2’-脱氧鸟苷(8-hydroxy-2’-deoxyguanosine,8-OHdG)是DNA 受损修复后释放的核苷,被广泛用作DNA 损伤和氧化应激的生物标志物[25-28]。流行病学研究表明,OPEs 暴露与氧化应激之间存在关联[29-31]。
本研究通过检测304 名体检人群尿液中7 种OPEs代谢产物与8-OHdG 的水平,分析尿液OPEs 代谢产物与8-OHdG 之间的关联,探讨成年人暴露于OPEs 是否在代谢过程中引起氧化应激。
1 对象与方法
1.1 研究对象
研究对象为2017年于南京两医院参加健康体检的普通成人304名,平均年龄为(35±10)岁(18~65岁),女性135 名和男性169 名。研究对象各体检指标均在正常范围内,无吸烟、饮酒史。基本个人信息来自健康体检问卷。按照健康体检的要求,使用50 mL聚丙烯试管收集晨尿,标记后放置冰盒内运回实验室,在-80℃保存待用。本研究伦理许可已由东南大学附属中大医院临床研究伦理委员会批准(2015ZDKYSB038),研究对象均知情同意。
1.2 化学品和试剂
DEP(97.6%纯度)、DnBP(99.9%纯度)、DPhP(96%纯度)、BCEP(95%纯度)、BCPP(95%纯度)、BBEP(96%纯度)和BDCPP(95%纯度)7 种OPEs 代谢产物和8-OHdG(97%纯度)标准品均购于加拿大Toronto Research Chemicals。乙腈购于德国Merck(色谱纯,>99%纯度)。
1.3 样品制备和仪器分析
尿液的预处理程序如下:将10 mL 尿液样品放入50 mL离心管中,然后加入盐酸将尿液pH值酸化至5;尿液样品在80℃的水浴中水解2 h,恢复到室温后加入10 mL 乙腈溶液和3 g 氯化钠,涡旋1 min;6 910×g离心5 min;取5 mL 上层溶液通过自制滤筒(该滤筒中装有100 mg N-丙基乙二胺、20 mg 石墨化炭黑、4 g无水硫酸钠),收集在容量试管中;上样后,取5 mL上层溶液进行洗脱,收集的洗脱液在恒温氮吹仪(中国天津奥特赛斯)旋转蒸发至接近干燥;加入1 mL 乙腈使体积恒定,将溶液通过0.22 μm 滤膜过滤。将制备好的样品储存在-20℃等待仪器分析。
使用高效液相色谱-串联四级杆离子阱质谱仪(LC-Agilent Technologies 1290 Infinity,MS-AB SCIEX QTRAP 4500,美国Agilent)测量尿液样品中OPEs 代谢物和8-OHdG 的质量浓度(后称浓度)。在ZORBAX Eclipse Plus C18 色谱柱(150 mm×2.1 mm,3.5 μm;美国Agilent)上分离所有分析物(目标物质总离子流见补充材料图S1)。含有0.2%氨水溶液和乙腈用作流动相。梯度洗脱程序设置如下:0~2 min,1%乙腈;2~4 min,1%~20%乙腈;4~6 min,含20%~40%乙腈;6~8 min,40%~60%乙腈;8~9 min,60%~40%乙腈;9~9.1 min,40%~1%乙腈;9.1~10 min,1%乙腈。每个样品注入5 μL 提取液,流速设置为0.3 mL·min-1,柱温保持在30℃。电喷雾电离以负离子模式进行。电离电压为-5 500 V,离子源温度为500℃。补充材料表S1中列出其他的优化质谱参数,包括每种目标化合物的母离子、子离子、去簇电压、碰撞能量、入口电压和出口电压。尿肌酐水平的测定按照肌酐测定试剂盒(L-Type Creatinine M,日本FUJIFILM)的说明书步骤进行。
1.4 质量控制
用于计算尿液样品中目标化合物浓度的校准标准品的浓度范围为0.01~200 μg·L-1,校准曲线的回归系数>0.997。检测限(信噪比≥3)范围为0.03~18.33 ng·L-1,定量限(信噪比≥10)为0.10~55.00 ng·L-1。本底值低于检测限。方法回收率的测量是检测3 种不同浓度(10、100、200 ng·L-1)的加标样品(基质为人工尿),并为每种浓度设置5 个平行样品,3 种浓度的加标样品的回收率达到52.36%~114.56%,精密度低于10%。具体数据见补充材料表S2。
1.5 统计学分析
使用SPSS 20.0 进行统计分析。针对个体肌酐水平调整OPEs代谢产物和8-OHdG的尿液浓度,单位以μg·g-1表示。7种OPEs代谢物的总浓度表示为Σ7OPEMs。实验数据采用几何均数(geometric mean,GM)表示。采用Mann–WhitneyU检验研究两组之间的差异。Pearson 相关性检验和多元线性回归分析用于检验不同变量之间的相关性;在进行Pearson 相关性检验和多元线性回归分析之前,将OPEs 代谢产物和8-OHdG的浓度进行常用对数转换。使用GraphPad Prism 8.0制作图形。检验水准α=0.05。
2 结果
2.1 尿液OPEs 代谢产物浓度
表1显示体检人群尿液样本中OPEs 代谢产物的浓度。尿液中7 种OPEs 代谢产物检出率范围为53.6%~99.3%。尿液中Σ7OPEMs GM浓度为15.01 μg·g-1。BCPP(GM:4.88 μg·g-1)和DnBP(GM:4.61 μg·g-1)是成年人尿液最丰富的OPEs 代谢产物,其次是DPhP(GM:1.00 μg·g-1)、BCEP(GM:0.73 μg·g-1)、BDCPP(GM:0.72 μg·g-1)、DEP(GM:0.59 μg·g-1)和BBEP(GM:0.57 μg·g-1)。
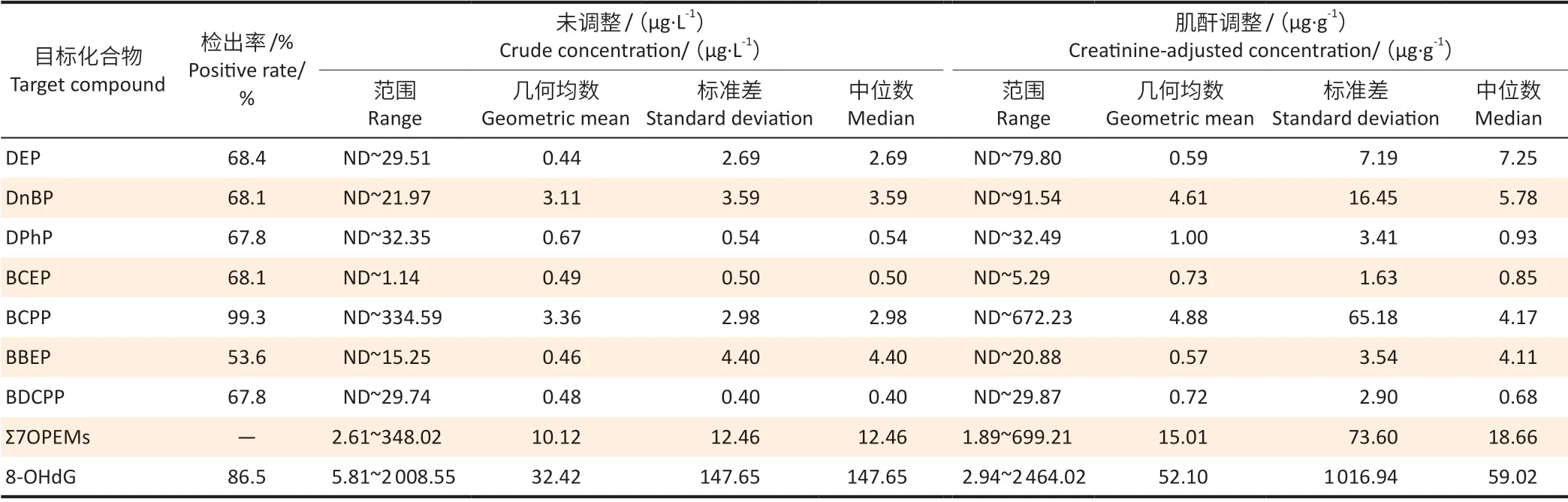
表1 南京两医院体检人群尿液中OPEs 代谢产物和8-OHdG的分布(n=304)Table 1 Distributions of urinary OPEs metabolites and 8-OHdG among selected physical examination population in two Nanjing hospitals (n=304)
2.2 性别相关的尿液OPEs 代谢物水平
表2显示体检人群尿液样本中OPEs 代谢产物的性别差异。尿液DEP、DnBP、BCPP、BBEP 和BDCPP在男性和女性之间存在差异(P<0.05):对于尿液DnBP、BCPP和BDCPP,男性高于女性(GM:5.83、6.44、0.86μg·g-1vs 5.47、3.42、0.69μg·g-1);但是,对于尿液DEP 和BBEP,女性远高于男性(GM:7.44、5.25μg·g-1vs 0.67、0.80μg·g-1)。
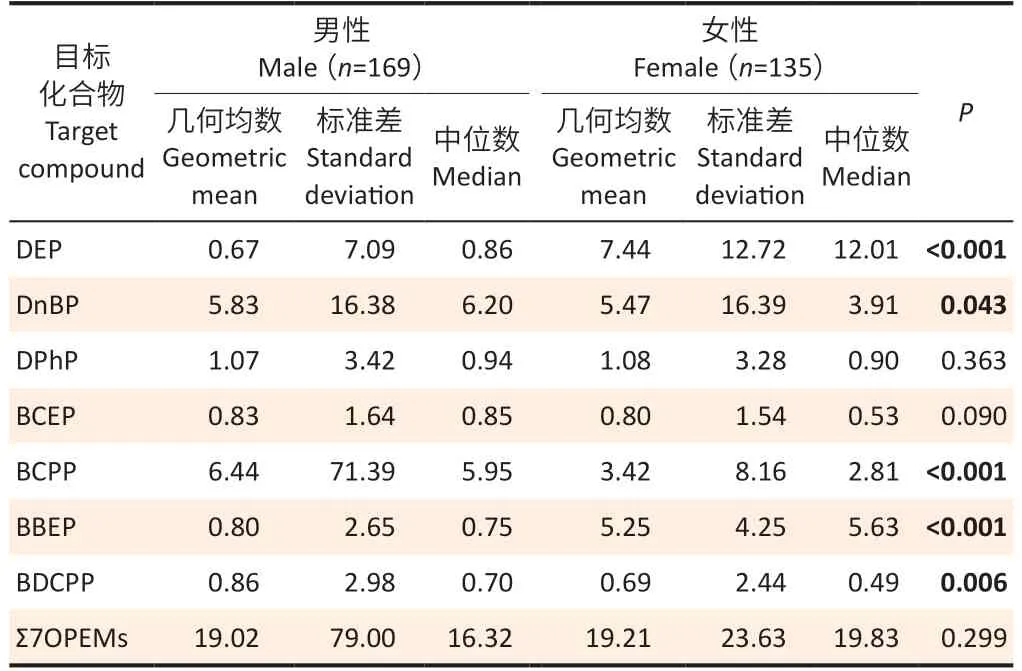
表2 南京两医院体检人群尿液中OPEs 代谢产物的性别差异Table 2 Gender differences in urinary OPEs metabolites among selected physical examination population in two Nanjing hospitals单位(Unit):μg·g-1
2.3 OPEs暴露与氧化应激之间的关联
经过肌酐调整后,通过Pearson相关性检验分析单个OPEs代谢产物与8-OHdG尿液浓度(常用对数转换)之间的相关性(图1)。结果表明:8-OHdG与DEP(r=0.219)、DnBP(r=0.417)、DPhP(r=0.308)、BCEP(r=0.420)、BDCPP(r=0.287)和Σ7OPEMs(r=0.276)均呈正相关(均P<0.01);但是,尿液中8-OHdG与BCPP、BBEP相关性无统计学意义(P>0.05)(见补充材料图S2)。
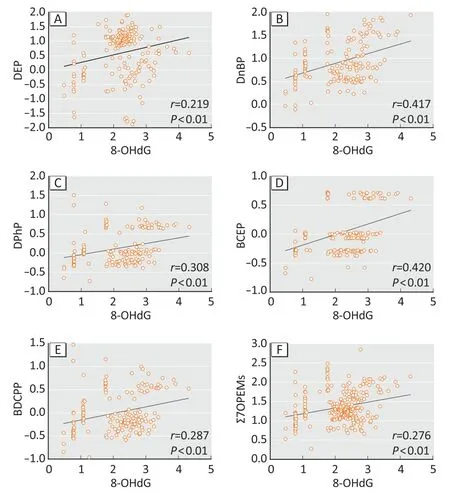
图1 南京两医院体检人群尿液中OPEs代谢产物与8-OHdG浓度的Pearson相关性Figure 1 Pearson correlations between urinary OPEs metabolites and 8-OHdG concentrations among selected physical examination population in two Nanjing hospitals
经过肌酐调整后,按照性别分层,通过Pearson相关性检验分析不同性别下单个OPEs 代谢产物与8-OHdG 尿液浓度(常用对数转换)之间的相关性。结果表明:男性尿液8-OHdG 与DEP(r=0.240)、DnBP(r=0.436)、DPhP(r=0.367)、BCEP(r=0.448)、BDCPP(r=0.348)和Σ7OPEMs(r=0.327)均呈正相关(均P<0.05,见补充材料图S3);女性尿液8-OHdG 与BBEP 呈正相关(r=0.233,P<0.05,见补充材料图S4)。
经过肌酐调整后,控制性别和年龄混杂因素,通过多元线性回归分析来进一步探讨单个OPEs代谢产物与8-OHdG 尿液浓度(常用对数转换)之间的关联(表3)。结果表明,8-OHdG 与DEP(b=0.182)、DnBP(b=0.418)、DPhP(b=0.303)、BCEP(b=0.418)、BDCPP(b=0.284)和Σ7OPEMs(b=0.281)存在正向关联(均P<0.05)。
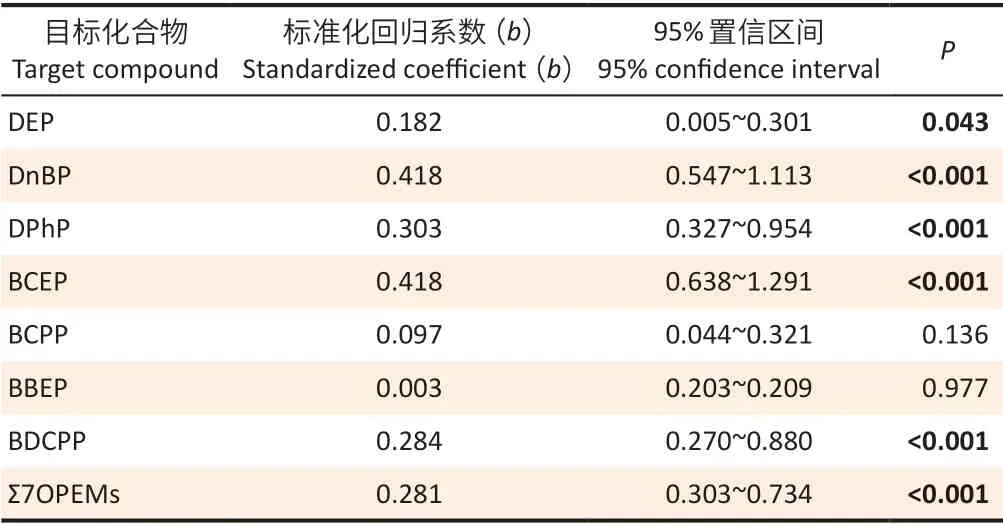
表3 南京两医院体检人群尿液中OPEs 代谢产物与8-OHdG 浓度的多元线性回归分析Table 3 Multiple linear regression analysis on urinary OPEs metabolites and 8-OHdG concentrations among selected physical examination population in two Nanjing hospitals
3 讨论
本研究调查于南京两医院参加健康体检的普通成人尿液中OPEs 代谢产物与氧化应激生物标志物8-OHdG 之间的关联。研究发现:DnBP 和BCPP 是普通成人尿液中最丰富的OPEs 代谢产物;DEP、DnBP 、BCPP、BBEP 和BDCPP 有性别差异,男性DnBP、BCPP和BDCPP 高于女性,女性DEP 和BBEP 高于男性;Pearson 相关性检验分析显示8-OHdG 与DEP、DnBP、DPhP、BCEP 和BDCPP 呈正相关;性别分层后,男性8-OHdG 与DEP、DnBP、DPhP、BCEP 和BDCPP 呈正相关,女性8-OHdG 与BBEP 呈正相关;进一步校正性别和年龄后,多元线性回归分析显示8-OHdG 与DEP、DnBP、DPhP、BCEP和BDCPP有正向关联。
将本研究与不同研究报告的成年人(≥18 岁)尿液OPEs 代谢物浓度进行比较(见补充材料表S3),DPhP 和BDCPP 是先前研究分析的两种最常见的OPEs代谢物,本研究的DPhP(GM:0.67 μg·L-1)尿液水平远低于美国(0.71~1.137 μg·L-1)和加拿大(1.7 μg·L-1);BDCPP(0.48 μg·L-1)尿液水平与加拿大(0.55 μg·L-1)相似,但远低于美国(0.69~2.321 μg·L-1)。对于尿液DEP和BCEP,本研究数据(DEP:0.44 μg·L-1;BCEP:0.49 μg·L-1)与美国(DEP:0.348 μg·L-1;BCEP:0.354~0.38 μg·L-1)相当。本研究观察到成年人尿液中DnBP(3.11 μg·L-1)、BCPP(3.36 μg·L-1)和BBEP(0.46 μg·L-1)水平远高于美国(DnBP:0.0168~0.18 μg·L-1;BCPP:0.0838 、0.18 μg·L-1;BBEP:0.0326 μg·L-1)和加拿大(DnBP:0.08 μg·L-1)。
先前的研究表明,在OPEs 代谢产物中发现性别相关差异[32-35]。例如,成年男性血清中磷酸三异丁酯的浓度高于女性[34],女孩TPhP 的暴露风险高于男孩[32],女性头发中TPhP 的浓度明显高于男性[33]。本研究在课题组前期研究的基础上[36],经过肌酐校正,并增加了样本量,结果显示尿液DEP、DnBP 、BCPP、BBEP 和BDCPP 在男性和女性之间有差异(表2)。原因可能是男性和女性之间的OPEs 暴露来源和水平不同,这将影响尿液中OPEs 代谢产物的水平。例如,部分女性产品(例如指甲油)是OPEs 的重要来源,可增加女性暴露于OPEs的风险[37]。
本研究结果显示,Pearson相关性检验分析后,尿液8-OHdG 与DEP、DnBP、DPhP、BCEP 和BDCPP 呈正相关(图1)。进一步校正性别和年龄后,多元线性回归分析显示尿液8-OHdG 与DEP、DnBP、DPhP、BCEP和BDCPP 有关联(表3)。先前的研究也发现OPEs 代谢产物与氧化应激之间的关联:波多黎各孕妇尿液中BCEP、BCPP 和DPhP 与8-OHdG 的增加有关[29];日本7岁儿童尿液中BBEP、DPhP 和8-OHdG 之间存在正相关性[30];生活在电子垃圾区域的人群尿液中BCPP、BCEP、DPhP和DnBP与8-OHdG水平呈正相关[31]。动物和细胞实验表明,TCEP 和TPhP 会引起小鼠肝脏和睾丸TM3 Leydig 细胞的氧化应激[22]。TDCPP 诱导肾上腺PC12 细胞的氧化应激,尽管未观察到细胞活力降低[23]。关于OPEs 诱导氧化应激的机制,以及OPEs 暴露对氧化应激生物标志物的影响仍需要进行更多的动物实验和流行病学研究。
本研究有一定的局限性:第一,本研究属于横断面研究设计,不能从本数据中建立因果关系;第二,8 种检测物质中,DEP 的加标回收率低于70%;第三,机体可能受多种污染物(苯、重金属和空气污染物等)复合暴露的影响,但本研究只调查了OPEs 代谢产物与8-OHdG 的关联;第四,研究中也未调查其他的氧化应激风险因素,如生活方式、经济和教育状况等,可能会使结论产生偏倚。因此进一步的研究需要控制更多的混杂因素。
综 上,本研究发现DEP、DnBP、DPhP、BCEP 和BDCPP与氧化应激生物标志物8-OHdG 水平升高相关,表明成年人暴露于OPEs 可能会在代谢过程中引起氧化应激。本研究为进一步探索环境化学污染物暴露对机体氧化应激风险的影响提供了流行病学证据。未来应开展研究以查明OPEs 干扰氧化应激潜在的生物学机制和其介导的健康效应。

