Wnt/β-catenin信号通路参与马蹄内翻足畸形形成的研究
李汾杰, 陈曦, 李洋杰, 廖佳馨, 李志富, 刘桉茁, 张月秋, 颜南, 王正东
沈阳医学院 1.基础医学院,2.康复教研室,3.解剖学教研室,沈阳 110034
先天性马蹄内翻足(congenital talipes equinovarus,CTE)是一种常见的先天性足部畸形,患者有足部骨关节变形以及软组织挛缩等复杂病理改变。这种先天性发育不良可能与肌肉挛缩、关节紊乱、肌肉异常插入、血管损伤、吸烟、宫内体位不佳等有关,然而其病理机制尚未完全清楚。目前对于CTE的产前诊断是通过超声检查,有一定的漏诊率。课题组前期研究表明:与对照组相比,患儿足踝部软组织中COL9A1与SOX9高表达,高表达的COL9A1可能参与CTE软组织挛缩,从而导致足部畸形的发生[1];动物实验发现与肢体远端发育相关的HOXD13基因低表达可使SOX9基因表达上调,从而导致与软组织发育相关的COL9A1基因表达上调,这些可能参与CTE畸形的发生[2~4]。已知软骨的分化受Sox9(sex determining region Y-box9)和经典Wnt信号通路的关键因子β-catenin共同调控[5~7],但未有研究显示CTE畸形的发生与Wnt/β-catenin信号通路有关,因此猜想Wnt/β-catenin通路可通过影响β-catenin磷酸化来调控下游靶基因Sox9的表达进而参与CTE畸形的形成。该研究旨在通过观察β-catenin,Pho-β-catenin-S552,Sox9在CTE大鼠踝部软组织的表达来阐明Wnt/βcatenin信号通路的调控机制,为CTE的临床诊断及治疗提供思路。
1 材料与方法
1.1 材料
1.1.1 建模与取材 取10周龄SD大鼠,体重200~350 g,雌鼠20只,雄鼠12只,动物生产许可证SCXK(辽)2015-0001。分别将5只雌鼠和3只雄鼠合笼,第2 d通过阴道栓检查是否怀孕,将孕10 d的SD雌鼠20只随机平均分为对照组和实验组,按照周海涛等人[8]的研究以135 mg/kg全反式维甲酸溶于矿物油对实验组大鼠进行灌胃处理,对照组以相应体积的矿物油灌胃。实验组2只孕鼠在灌胃1 d后死亡。孕20 d后剖宫取出胎鼠。实验组剩余8只孕鼠产出胎鼠58只,其中出现类马蹄内翻足症状的胎鼠有34只,概率为58.6%。对照组获得胎鼠98只,均未出现畸形。部分用于免疫印迹和mRNA检测的典型马蹄内翻足胎鼠和正常胎鼠剖宫取出后立即冻存于-80℃冰箱中,专项实验前取其下肢足踝关节上下5 mm附近的软组织。另取部分典型马蹄内翻足胎鼠和正常胎鼠下肢相应部位组织分别浸入4%多聚甲醛中固定,置于4℃冰箱保存。本实验经沈阳医学院实验动物伦理委员会审批(SYYXY2019022001)。
1.1.2 药物与试剂 HE染色试剂、免疫组化试剂盒和Western blot试剂盒购自北京鼎国昌盛生物技术有限责任公司,qRT-PCR试剂盒(Vazyme),兔抗鼠抗体β-catenin(ABclonal),phospho-β-catenin-S552(ABclonal)及Sox9(Santa Cruz)。
1.2 实验方法
1.2.1 切片HE染色 取两组足踝部组织标本,4%多聚甲醛固定3 h,不同浓度蔗糖溶液浸泡进行组织梯度脱水,制作冰冻切片,固定,HE染色,中性树胶固封,于100倍光学显微镜下观察。
1.2.2 免疫组化检测踝部软组织Sox9与β-catenin表达 组织标本制作冰冻切片同上。取制备好的切片滴加内源性过氧化物酶阻断剂消除其活性;滴加封闭液,室温静置封闭20 min;滴加Ⅰ抗(Sox9 1:500、βcatenin 1:100),置于湿盒中,37℃温箱处理1 h,4℃过夜;滴加生物素标记的Ⅱ抗,室温孵育30 min;滴加链霉菌抗生物素蛋白-过氧化物酶,室温孵育10 min;DAB显色约5 min后,用蒸馏水缓流水冲洗以终止显色;苏木素复染并使用1%盐酸-乙醇溶液对细胞核进行分化,PBS冲洗返蓝,脱水封片;以空白对照组为阴性对照进行免疫组化染色数据分析。Image J软件进行平均灰度值扫描。
1.2.3 Western blot检测组织β-actin、β-catenin、Sox9和P-β-catenin-S552表达 取实验组和对照组足踝部组织标本,称重,加裂解液并研磨,离心取上清于冰中待用。BAC试剂盒测量并调整至适宜蛋白浓度,制胶并以β-actin为内参电泳分离蛋白质,转膜后封闭;加一抗杂交液,摇床1 h后4℃过夜;二抗β-actin(1:10000)、β-catenin(1:1000)、Sox9(1:1000)和P-βcatenin-S552(1:1000)室温杂交2 h;ECL的A,B两种试剂等比例混合并浸润洗涤后的PVDF膜;通过Image J对条带进行扫描处理,量化后分析数据。
1.2.4 Real-Time PCR检测β-catenin和Sox9表达 提取两组足踝部组织样本中总RNA,逆转录后进行Real-Time PCR扩增,引物序列见表1,以Gapdh为内参,每份样品做3个复孔,取平均Ct值进行计算。依据各组的Ct值,采用2—△△Ct法计算实验组与对照组之间β-catenin和Sox9的相对表达差异。
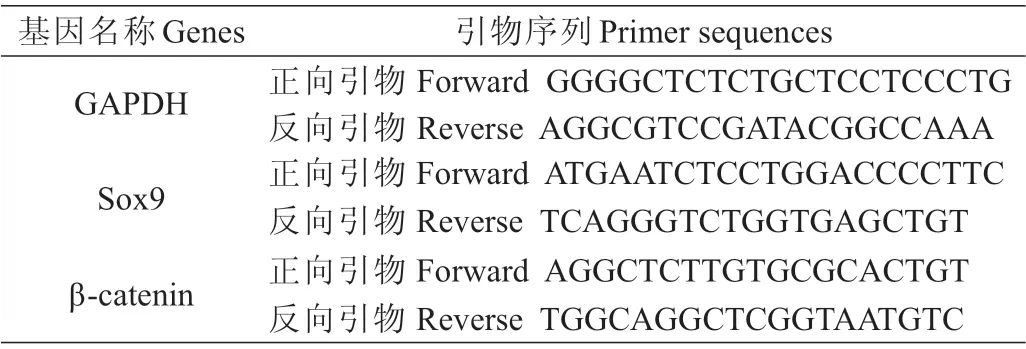
表1 引物序列表Tab.1 Primer sequencesof real-time PCR
1.3 统计学分析
采用SPSS20.0软件进行统计学分析,所有数据用平均数±标准差(±s)表示,采用独立样本t检验分析所得数据,以P<0.05为有统计学意义。
2 结果
2.1 HE染色
HE染色后镜下观察,与正常组相比,实验组软骨基质增多,软组织中胶原纤维成分明显增多,软组织出现明显的挛缩现象,骨之间的间隙增大。
2.2 免疫组化
免疫组化显色结果,细胞核中出现黄褐色阳性颗粒,Sox9蛋白阳性细胞密集分布在软骨及软组织中,β-catenin蛋白主要表达于除骨组织以外的软组织细胞核中。与对照组相比,实验组趾骨有较明显的间隙,且软组织中黄褐色阳性颗粒增多。实验组大鼠踝部软组织Sox9表达显著高于对照组(P<0.01),βcatenin表达高于对照组(P<0.05),见图2。

图1 大鼠足踝部组织HE染色实验组可见较多胶原纤维沉淀及骨间缝隙增大 CTL:正常组CEV:实验组Fig.1 HEstaining of ankletissuein each group It can be seen that the precipitation of more collagen fibers were more obvious in the experimental group,and the gap between bones also significantly increased CTL:Normal group CEV:Experimental group

图2 大鼠足踝部组织中Sox9与βcatenin表达Sox9阳性细胞密集分布在软骨及软组织的细胞核,β-catenin蛋白主要表达于除骨组织以外软组织细胞的细胞核,实验组趾骨有较明显的间隙,且软组织中黄褐色阳性颗粒多于对照组CTL:正常组 CEV:实验组 *P<0.05 **P<0.01Fig.2 The expression of Sox9 andβcatenin in two groups Sox9 protein positive cells were densely distributed in the nuclei of cartilage and soft tissue, β-catenin protein was mainly expressed in the nuclei of soft tissue cells except bone tissue.The phalangeal space in the experimental group was more obvious,and the positive yellow brown particles in soft tissue was more than that in the control group CTL:Normal group CEV:Experimental group*P<0.01,**P<0.05
2.3 RT-qPCR检测
RT-PCR结果显示,与对照组相比,实验组Sox9 mRNA与β-catenin mRNA表达显著增高(P<0.01),二者表达同步增高的原因可用Wnt信号通路调控βcatenin磷酸化水平降低从而激活Sox9基因来解释,见图3。

图3 大鼠足踝部组织中Sox9与β-catenin的mRNA表达水平 CTL:正常组CEV:实验组**P<0.01Fig.3 The mRNA expression levels of Sox9 andβ-catenin in two groups CTL:Normal group CEV:Experimental group**P<0.01
2.4 Western blot结果
Western blot结果显示,与对照组相比,实验组大鼠踝部软组织β-catenin表达水平增高(P<0.05),Sox9表达明显增高(P<0.05),踝部组织中磷酸化β-catenin-S552明显减少(P<0.001),可见CTE大鼠踝部软组织中β-catenin确实高表达,见图4。

图4 大鼠足踝部组织中β-catenin、Sox9与磷酸化β-catenin-S552蛋白表达CTL:正常组CEV:实验组*P<0.05,***P<0.001Fig.4 Theprotein expression levelsofβ-catenin,Sox9 and phosphorylatedβ-catenin-S552 in two groups CTL:Normal group CEV:Experimental group*P<0.05,***P<0.001
3 讨论
课题组前期临床和动物模型实验结果、相关文献均表明,实验组足踝部软组织Sox9蛋白的表达水平明显高于对照组,因此推测高表达的Sox9与CTE发生有关[1~7]。Sox家族的转录因子已经作为典型Wnt/β-catenin信号的调节剂出现在不同的发育和疾病环境中。Wnt信号转导级联是整个动物界发育的主要调节因子,在与Sox9表达相关的多种疾病发生发展中有着重要的角色,因此推测CTE大鼠踝部组织中Sox9高表达与Wnt/β-catenin调控有关,β-catenin是经典Wnt途径中的关键调控因子,由降解复合体(DC)控制其稳定性。DC是由肿瘤抑制蛋白Axin作为支架,与β-catenin两种活性丝氨酸苏氨酸激酶(CK1和GSK3-β)和肿瘤抑制蛋白APC组成。当Fz/LRP受体未与Wnt信号结合时,CK1和GSK3-β可依次将Axin所结合的β-catenin磷酸化;细胞接收到Wnt信号后,GSK3-β的活性被抑制从而抑制β-catenin的磷酸化进程,使游离β-catenin水平迅速增加,在细胞质中大量积累,转入细胞核并激活靶基因,调控基因表达[9]。本研究检测CTE大鼠踝部软组织,Western blot及免疫组化结果显示Sox9与β-catenin表达增高,且磷酸化β-catenin-S552的表达显著减少,因此认为先天性马蹄内翻足大鼠足踝部组织中Sox9高表达是Wnt/β-Catenin信号通路调控引起,该通路参与先天性马蹄内翻足畸形的形成。胎鼠发育过程中其踝部组织细胞接收到Wnt信号,β-catenin的磷酸化被抑制,细胞中β-catenin水平升高并在细胞核中激活Sox9的表达。其他研究也证实Sox9与Wnt通路之间相似的促进关系,比如,经GSK-3β抑制剂处理激活Wnt/βcatenin信号,前列腺癌细胞中的Sox9表达增加,而siRNA下调β-catenin后,Sox9的表达降低,说明Sox9在前列腺癌细胞中的表达受Wnt/β-catenin信号转导调控[10]。当Wnt/β-catenin通路被激活后,Sox9过度表达,促进β-catenin从细胞质到细胞核的易位,从而可以增强TCF/LEF的转录活性,增加GSK3-β在Ser9的磷酸化,当β-catenin被抑制后过度表达的Sox9的促转移作用也被抑制[11]。
本研究的实验模型是由大鼠维甲酸灌胃处理建立,标本数量不是很多,畸形状态虽然与人的马蹄内翻足状态相似,但仅仅是形态上的相仿,腿部畸形明显表现出马蹄内翻但不能确定其生长过程中的发展和表现;维甲酸对胎鼠有一定的毒性作用,除马蹄内翻足外还可导致眼部畸形,尾部畸形,开放性脊柱裂等,因此所得的实验结果或许与临床病例存在一定差异,这些是本研究的局限所在,希望会有更多的研究进以辅证。
综上所述,本课题组认为CTE大鼠踝部组织中Sox9表达量增高是由于经典Wnt信号通路被激活,βcatenin的磷酸化降解减少,胞质中游离β-catenin的水平升高进而进入细胞核并激动Sox9基因的表达造成的,又由于Sox9与CTE畸形之间存在一定的相关性,因此基于前期的研究认为Wnt/β-Catenin信号通路通过参与调控大鼠踝部组织中高表达Sox9而引起先天性马蹄内翻足畸形的发生。