非共价键构筑糖基表面活性剂及其性能研究
雷秋云 廖 雄 刘学民 葛 新
(江南大学 化学与材料工程学院,江苏 无锡 214122)
1 引言
随着环保排放标准不断提高,部分表面活性剂因生物降解速率不足将被替代。以天然可再生的糖为原料制备的糖基表面活性剂是一种安全无毒,环境友好的“绿色”产品[1]。因其环境相容性好和可生物降解等优点,在生物化学、洗护产品、材料制备和基因转染等领域受到广泛关注[2-4]。与单一表面活性剂体系相比,通过表面活性剂复配或者在表面活性剂溶液中加入添加剂构筑新的表面活性剂等方式可以获得更加优良的性能[5]。
Blanza小组[6]利用烷基乳糖胺和十四烷基二酸构筑了离子型糖胺双子表面活性剂,这种表面活性剂在水溶液中能够形成层状相和囊泡,可用于包封和载体化,且具有高抗HIV活性和对人体细胞低毒性的优点。Guo等[7]通过表面张力测定、电导率测定、Zeta电势分析和微环境极性测定等方法探究了在不同羧酸存在下表面活性剂N-十二烷基葡糖胺的聚集及其与DNA的结合情况。结果表明,在己酸的作用下,表面活性剂降低水的表面张力和聚集成胶束的能力最高。李芳等[8]选择单一型和复配型表面活性剂对FePt纳米颗粒进行修饰,比较了它们在颗粒形貌、磁性能上的作用区别,结果显示复配型表面活性剂更有利于诱导生成各向异性纳米结构。因此,研究糖基表面活性剂复配体系的性质有助于开发适用于不同工业过程中的表面活性剂配方,拓宽其商业应用。

图1 G-C-2和L-C-2的合成路线
表面活性剂混合体系中组分的比例不同会导致不同的性质,Cheng等[9]通过调节月桂酸(LA)与十四烷基二甲基氧化胺(C14DMAO)的比例形成不同的无盐阴/阳离子表面活性剂混合体系,发现两者在水溶液中可自组装成丰富的聚集体结构,可形成胶束、层状相、囊泡和凝胶相。以胶束相和层状相为软模板制备了金纳米材料,与利用传统阳离子表面活性剂溶液制备金纳米材料相比,该方法可实现金钠米材料形貌的调控。本文采用三元羧酸(柠檬酸)和单链烷基糖胺(AGA12和ALA12)以不同摩尔比通过非共价键构筑糖基表面活性剂(G-C-n和L-C-n) (n=1, 2, 3),如图1,并研究单链糖胺与柠檬酸不同摩尔比对G-C-n和L-C-n水溶液行为和性能的影响。
2 实验部分
2.1 实验试剂与仪器
智能数显多功能油水浴锅(HH-W5S型,上海锦赋实验仪器设备有限公司),电子天平(FA2004型,上海舜宇恒平科学仪器有限公司),磁力搅拌器(HJ-1型,江苏科析仪器有限公司),低温恒温槽(DC-2006型,上海圣科仪器设备有限公司),超声波清洗器(JP-020型,深圳市洁盟清洗设备有限公司),电导率仪(MP521型,上海三信仪表厂),旋转蒸发器(R201型,上海申顺生物科技有限公司),核磁共振波谱仪(AduanceIII,德国布鲁克公司),全反射红外光谱仪(Nicolet 6700型,美国赛默飞世尔科技有限公司),光学接触角测量仪(OCA 40型,北京东方德菲仪器有限公司)。
2.2 产品合成
十二烷基葡萄糖胺表面活性剂的构建:
将葡萄糖(50 mmol)和十二胺(50 mmol)加入甲醇(100 mL)中,室温下搅拌48 h。然后,抽滤除去甲醇溶剂并用乙醇洗涤滤饼,再于无水乙醇中重结晶两次。最后,旋转蒸发去除乙醇,得到N-十二烷基葡萄糖胺(AGA12)固体粉末,产率为85%。
N-十二烷基葡萄糖胺(AGA12)和柠檬酸(CA)分别以摩尔比1∶1、2∶1和3∶1反应得到葡萄糖基表面活性剂(G-C-n),分别命名为G-C-1、G-C-2和G-C-3。将其分别转移至100 mL容量瓶中用超纯水定容,用于溶液性能的测试。其中G-C-3在水中溶解度过低,不进行溶液性能的研究。
十二烷基乳糖胺表面活性剂的构建:
将乳糖一水合物(18 mmol)溶解于60 mL超纯水中,十二胺(30 mmol)溶解于100 mL异丙醇中。混合两溶液并在室温下搅拌24 h,然后将混合物置于60℃水浴中保温30min。然后,抽滤除去混合物中的甲醇溶剂并用乙醇洗涤滤饼,再于无水乙醇中重结晶两次。最后,旋转蒸发去除乙醇,得到固体粉末N-十二烷基乳糖胺产品(ALA12),收率为73%。
N-十二烷基乳糖胺(ALA12)和柠檬酸(CA)分别以摩尔比1∶1、2∶1和3∶1发生原位中和反应得到乳糖基表面活性剂(L-C-n),分别命名为L-C-1、L-C-2和L-C-3。将其分别转移至100 mL容量瓶中用超纯水定容,用于溶液性能的测试。
以G-C-2为例,使用红外光谱和核磁共振氢谱对原料和产物进行结构表征。
红外光谱如图2所示,与柠檬酸(CA)红外谱图对比,糖基表面活性剂G-C-2的红外谱图在2 926 cm-1和2 854 cm-1处的C-H伸缩振动峰显著加强,这说明G-C-2上接有长碳链。另外,羧酸基团ν(C=O)1 753 cm-1消失,取而代之的是COO-在1 591 cm-1处的反对称伸缩振动和1 405 cm-1处的对称伸缩振动,说明羧酸变成了羧酸根。综上表明,AGA12和CA发生了中和反应,通过非共价键成功构筑了糖基表面活性剂。

图2 G-C-2/AGA12/CA的红外谱图
AGA12的氢核磁谱图如图3,核磁数据如下:
N-dodecyl Glucosamine AGA12.1H NMR (400 MHz, MeOD) δ 3.91-3.80 (m, 2H), 3.67 (dd,J=11.6, 5.6 Hz, 1H), 3.38 (d,J=8.4 Hz, 1H), 3.29 (dd,J=8.8, 5.6 Hz, 1H), 3.27-3.21 (m, 1H), 3.08 (t,J=8.8 Hz, 1H), 2.97-2.88 (m, 1H), 2.69-2.61 (m, 1H), 1.52 (m, 2H), 1.33 (d,J=10.4 Hz, 18H), 0.92 (t,J=6.8 Hz, 3H)。
CA的氢核磁谱图如图4,表征数据如下:
Citric acid monohydrate CA.1H NMR (400 MHz, MeOD) δ 2.91 (d,J=15.7 Hz, 2H), 2.85-2.75 (m, 2H)。
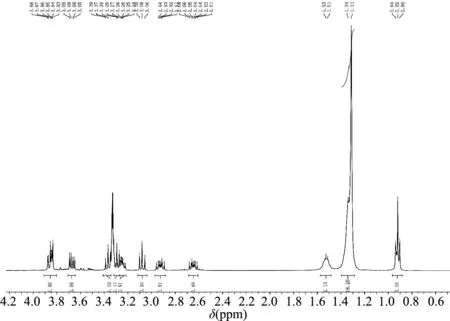
图3 N-十二烷基葡萄糖胺(AGA12)的氢核磁谱图

图4 柠檬酸(CA)的氢核磁谱图
G-C-2的氢核磁谱图如图5,表征数据如下:
G-C-2.1H NMR (400 MHz, MeOD) δ 4.15-4.00 (m, 2H), 3.99-3.87 (m, 2H), 3.86-3.75 (m, 2H), 3.75-3.68 (m, 2H), 3.64 (ddd,J=21.2, 9.1, 4.6 Hz, 2H), 3.39-3.11 (m, 4H), 3.10-2.87 (m, 4H), 2.72 (dd,J=35.2, 15.1 Hz, 4H), 1.71 (d,J=6.7 Hz, 4H), 1.33 (d,J=26.6 Hz, 36H), 0.90 (t,J=6.9 Hz, 6H)。

图5 糖基表面活性剂(G-C-2)的氢核磁谱图
综合核磁及红外谱图的结果可知,利用AGA12和CA成功构筑了糖基表面活性剂G-C-2,且目标产物结构和预期结构符合。
2.3 表面张力测试
实验使用OCA-40型接触角测量仪,通过悬滴法测定45±0.1 ℃条件下表面活性水溶液的表面张力。实验前,使用超纯水校准仪器,该仪器的分辨率为±0.01 mN·m-1,每种溶液的表面张力测量重复三次。得到不同浓度对应的表面张力数据后,在直角坐标系中,以lgc为横轴,γ为纵轴作图,实验结果见图6。

图6 在45℃条件下G-C-n(a)和L-C-n(b)表面活性剂水溶液的γ-lgc曲线
2.4 电导率的测定
用移液管移取一定量的超纯水到双层夹套烧杯中,通过低温恒温槽来调控溶液温度,温度波动度为±0.05 ℃。然后用移液枪向双层夹套烧杯中加入高浓度的表面活性剂溶液,从而得到不同浓度的表面活性剂溶液。溶液首先搅拌2 min,再平衡2 min,记录溶液电导率数值。实验前,用0.01 mol·kg-1的KCl溶液校准电导率仪。该电导率仪的分辨率为±0.5%,每个样品溶液均重复测量三次。
3 结果与讨论
3.1 单链糖胺与柠檬酸不同摩尔比对G-C-n和L-C-n溶液表面性质的影响
表面活性剂能使溶液表面张力显著下降且具有自组装形成聚集体的性能,本文首先考察了在45±0.1 ℃时,N-十二烷基葡萄糖胺(和N-十二烷基乳糖胺)与柠檬酸摩尔比的不同对构筑的糖基表面活性剂(G-C-n和L-C-n)临界胶束浓度(cmc)的影响。
如图6所示,通过溶液的表面张力(γ)与摩尔浓度(C)的γ-lgc曲线图解得到非共价键构筑的糖基表面活性剂(G-C-n和L-C-n)的cmc值。表面张力随浓度增加而降低,直至不变,是典型的表面活性剂的溶液行为,这证明N-十二烷基葡萄糖胺(和N-十二烷基乳糖胺)和柠檬酸以不同摩尔比例成功地构筑了非共价键连接的糖基表面活性剂。在γ-lgc曲线中没有发现最低点,这表明糖基表面活性剂(G-C-n和L-C-n)的纯度达到了水溶液表面化学性质研究的要求。
从获取的表面张力数据可以计算出一些界面参数:cmc、γcmc、Γmax、Amin、pC20和πcmc,如表1。其中,
(1)
(2)
πcmc=γ0-γcmc
(3)
pC20=-lgC20
(4)
式中:
cmc——临界胶束浓度,mmol·L-1;
γ——表面活性剂摩尔浓度为c时测得的表面张力,mN·m-1;
γ0——纯水的表面张力,25 ℃时γ0等于71.8 mN·m-1;
γcmc——cmc处的表面张力;
Amin——平均每个分子占有的最小面积,nm2;
Γmax——表面饱和吸附量,mol·cm-2;
T——绝对温度;
NA——阿伏伽德罗常数;
R——摩尔气体常数,J·mol-1·K-1;
C20——表面活性剂将纯水的表面张力降低20 mN·m-1时的摩尔浓度;
pC20——表示降低表面张力的效率;
n——表面活性剂形成的离子数,由于非共价键构筑的糖基表面活性发生强烈电离,n的值取为3。

表1 糖基表面活性剂(G-C-n/L-C-n)的界面参数Tab. 1 Surface parameters of the sugar basied surfactants (G-C-n/L-C-n)
从表1可以看出,随着单链烷基糖胺(AGA12和ALA12)和柠檬酸摩尔比增加,由AGA12(和ALA12)与柠檬酸构筑的糖基表面活性剂(G-C-n和L-C-n)的cmc和γcmc值减小,pC20和πcmc值逐渐增大。这是因为随着单链烷基糖胺(AGA12和ALA12)和柠檬酸摩尔比的增加,与柠檬酸结合的质子化的糖胺增加,表面活性剂的疏水链数量增多,导致糖基表面活性剂(G-C-n和L-C-n)的疏水体积增大,因此,单链烷基糖胺(AGA12和ALA12)和柠檬酸摩尔比值大的表面活性剂产生的胶束聚集体在空气/水溶液界面的吸附更有效,在水中的吸附效能更大。n值相同时,相对于L-C-n,G-C-n的cmc更小,pC20值更大,这是由于L-C-n亲水头基比G-C-n大,亲水性更强,更难形成胶束聚集体。随着n值增大,Γmax值减小,Amin值增大,说明AGA12(和ALA12)与柠檬酸摩尔比越小时,糖基表面活性剂(G-C-n和L-C-n)在空气/水溶液界面处会形成更紧密堆积的单层膜。
在G-C-n水溶液中,G-C-2具有最小的γcmc值(最大的πcmc)和最大的pC20值,说明G-C-2具有降低水的表面张力的最大效能和最大效率。G-C-1具有最低的cmc/c20值,表明G-C-1更容易形成胶束。L-C-n水溶液中,L-C-3具有最小的γcmc值(最大的πcmc)和最大的pC20值,说明L-C-3具有降低水的表面张力的最大效能和最大效率。L-C-3具有最高的cmc/c20值,表明L-C-3更容易吸附在气液界面处。
3.2 单链糖胺与柠檬酸摩尔比的不同对G-C-n和L-C-n胶束化的影响
测量电导率是研究离子型表面活性剂水溶液聚集行为最有效的方法之一。本文在不同温度下测量了表面活性剂G-C-n和L-C-n水溶液的电导率,见图7、图8,可以看出,随着浓度的增加,电导率曲线有转折点,其对应的横坐标即为cmc值。在45 ℃ 时,通过电导率法所得到的cmc值与表面张力法测量的结果一致,且随着n值的增加,G-C-n和L-C-n的cmc值逐渐减小。
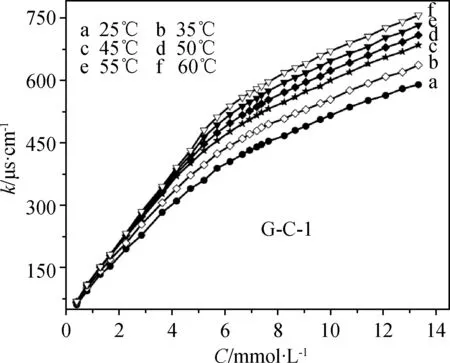
图7 G-C-n水溶液的电导率(κ)和表面活性剂摩尔浓度(C)在不同温度下的相关曲线。

图8 L-C-n水溶液的电导率(κ)和表面活性剂摩尔浓度(c)在不同温度下的相关曲线。
(5)
β=1-α
(6)
表面活性剂水溶液的胶束热力学参数用Zana[11]提出的方法计算。非共价键构筑的糖基表面活性剂(G-n和L-n)的

(7)
(8)
(9)
式中:
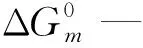


Xcmc——表面活性剂在临界胶束浓度(cmc) 时摩尔分数;
R——摩尔气体常数,J·mol-1·K-1;
T——绝对温度。

表2 G-C-n和L-C-n的热力学参数Tab. 2 Thermodynamic parameters of G-C-n and L-C-n

4 结论
本文利用N-十二烷基葡萄糖胺(和N-十二烷基乳糖胺)分别和三元酸(柠檬酸)以不同摩尔比通过非共价键构筑糖基表面活性剂(G-C-n和L-C-n) (n=1, 2, 3)。研究了N-十二烷基葡萄糖胺(和N-十二烷基乳糖胺)与柠檬酸摩尔比的不同和亲水头基糖环尺寸大小对非共价构建的糖基表面活性剂的溶液表面性质和胶束化性质的影响。随着单链糖胺(AGA12和ALA12)和柠檬酸摩尔比增加,糖基表面活性剂G-C-n和L-C-n的cmc减小,pC20值逐渐增大。由于L-C-n亲水基团上羟基比G-C-n多,亲水性更强,L-C-n的cmc比G-C-n大。此外,热力学数据表明糖基表面活性剂(G-C-n和L-C-n)胶束化过程是热力学的自发的放热过程。

