阿霉素通过循环肿瘤细胞介导三阴性乳腺癌转移*
常文慧,张艳丽,刘子宁,王文明,侯嘉鑫,丁 怡,2△
潍坊医学院 1病理生理学教研室 2应用药理学实验室,潍坊 261053
研究显示,1990~2016年中国女性乳腺癌的发病率不断上升,虽然由于医疗技术水平的提高,我国乳腺癌死亡率有所下降,但据ARIMA模型预测,在未来10年中国乳腺癌发生率仍有持续上升趋势[1]。三阴性乳腺癌(triple negative breast cancer,TNBC)是激素受体ER、PR和HER2均为阴性的乳腺癌[2],占所有乳腺癌的15%~20%[3],其复发率、远处转移率高,是乳腺癌中最具侵袭性的一种亚型。与其他亚型乳腺癌相比,TNBC总生存期短,化疗耐药是晚期TNBC患者死亡的主要原因[4]。新辅助化疗是治疗侵袭性乳腺癌的一种策略,是通过化疗将无法手术的大肿瘤缩小到适合手术切除的大小以改善局部控制[5]并获得对微转移的系统控制[6-7]。阿霉素(doxorubicin,DOX)是一种拓扑异构酶Ⅱ的特异性抑制剂,可造成肿瘤细胞的细胞毒性死亡[8],目前被广泛用于TNBC的化疗。临床研究发现,DOX可在一定程度上使早期乳腺癌患者的总体生存率有所提高,但在清除肿瘤细胞的同时,也有可能增加肿瘤细胞的耐药性和恶性程度[9],从而降低疗效[10],使肿瘤发生复发转移。有报道,多药耐药的乳腺癌细胞可同时发生上皮细胞-间充质表型转化(epithelial-mesenchymal transition,EMT)[11-12],提示其肿瘤耐药与EMT相关[13]。
EMT是指上皮细胞通过去极化使细胞间连接松散,获得长形、成纤维细胞样形态的过程[14],其主要特征为细胞粘附分子如E-钙粘蛋白(E-cadherin)表达的丧失和波形蛋白(Vimentin)、N-钙粘蛋白(N-cadherin)的表达增加[15]。大量研究表明EMT是肿瘤细胞获得转移和耐药特性的潜在机制[16]。肿瘤细胞通过EMT获得肿瘤干细胞特性[17],迁移、侵袭和抗凋亡作用增强[18]。EMT还可以诱导具有致癌和转移能力的循环肿瘤细胞(circulating tumor cells,CTCs)形成。最近的临床研究表明,乳腺癌患者CTCs表现出循环干细胞(CSCs)和EMT两种特征,CTCs中EMT指标阳性的患者对标准化疗反应差且无进展生存期明显缩短[19-20]。在TNBC患者中,CTCs的早期检测在判断患者预后方面发挥着重要作用[21-22]。CTCs中EMT相关分子标志物的表达,对早期TNBC的预后起着决定作用[23-24]。研究认为,在肿瘤发生过程中,CTCs获得侵袭等特性以在血液循环中得以生存[25-26],这些变化与EMT现象有关。事实上,来自转移性乳腺癌患者的CTCs,其EMT间质标记物表达高于早期乳腺癌患者,提示EMT表型与CTCs的转移潜力直接相关。此外,这种EMT表型的存在不仅与CTCs的转移潜力有关,还与这些CTCs表现出的耐药性有关[27]。
本研究通过体外实验观察了DOX对TNBC细胞EMT现象以及侵袭和转移能力的影响,并进一步构建了4T1-GFP TNBC小鼠转移模型,观察外周血CTCs数量变化和肿瘤肺转移情况,探讨低浓度DOX对TNBC的EMT以及肿瘤侵袭和转移的促进作用。
1 材料与方法
1.1 试剂
细胞培养用胎牛血清、RPMI-1640培养液购自美国Hyclone公司。慢病毒转染试剂购自上海吉凯基因化学技术有限公司。MTT固体粉末购自索莱宝生物科技有限公司。Martrigel基质胶、DOX购自美国Sigma公司。Western blot实验所用RIPA细胞裂解液等购自北京碧云天公司,GAPDH、Vimentin、N-Cadherin、E-Cadherin抗体购自美国Cell Signaling Technology,二抗为北京中杉金桥公司产品。Invitrogen TRIzol试剂购自赛默飞世尔公司。
1.2 细胞培养
人三阴性乳腺癌细胞系MDA-MB-231、MDA-MB-468,小鼠三阴性乳腺癌细胞4T1(均购自美国ATCC公司)培养于含10%胎牛血清的RPMI-1640培养液中,置37 ℃含5% CO2的培养箱中。通过携带GFP基因的慢病毒感染4T1细胞,经过一段时间的培养待其稳定生长后,用5 mg/L的嘌呤霉素进行筛选,倒置显微镜下观察确认转染效率。
1.3 MTT实验
将细胞密度调整为4×104/mL,接种于96孔板,200 μL/孔,置于37 ℃含5% CO2的培养箱中,待细胞贴壁后用含2% FBS的培养液饥饿培养12 h,更换为含有不同浓度DOX的完全培养液继续培养,24 h后每孔加入20 μL MTT继续培养4 h。平板离心后每孔加入150 μL DMSO,摇床振荡10 min,分光光度计检测570 nm波长处吸光度值(A570 nm)。计算公式为:生长抑制率(%)=(A对照-A处理)/A对照×100%。
1.4 划痕实验
将5×104/孔细胞接种于提前横向标记好直线的24孔板,置于5% CO2恒温培养箱中培养待细胞贴壁,而后更换为含2% FBS的培养液饥饿培养12 h。用200 μL的枪头在每孔中纵向划直线,于不同时间点在倒置显微镜下观察并拍照记录划痕宽度。划痕愈合率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度。
1.5 Transwell实验检测细胞侵袭能力
将Transwell小室取出后放入24孔板内,在底层铺上基质胶(Matrigel)。生长状态良好的细胞经胰酶消化后,用含2%血清的培养液重悬细胞,细胞密度调整为2.5×105/mL,上室加入200 μL细胞悬液,下室加入500 μL含10% FBS的培养液。5% CO2恒温培养箱中孵育24 h后,清除膜上表面的细胞,将膜进行固定、染色,显微镜下拍照并计数穿膜细胞数。每孔选取3个视野,取平均值作为该组细胞计数。
1.6 实时定量PCR检测
利用TRIzol试剂分别提取细胞总mRNA,随后利用ReverTra Ace qPCR RT Kit试剂盒进行逆转录,得到的cDNA样本用SYBR Green Realtime PCR Master Mix试剂盒进行扩增。引物序列如下:E-cadherin,上游5′-GCCACCGATGCAGACGATGAC-3′,下游5′-CAGCCTGAACCACCAGAGTGTATG-3′;N-cadherin,上游5′-AGGCGTCTGTGGAGGCTTCTG-3′,下游5′-TGCCGTCCTCGTCCACCTTG-3′;Vimentin,上游5′-ACTAGCCGC-AGCCTCTATTCCTC-3′,下游5′-GAAGTCCACCGAGTCTTGAAGCAG-3′。以GAPDH作为内参,利用定量PCR来分析mRNA的相对表达量。反应条件:预变性,95℃ 5 s激活DNA聚合酶;PCR反应,95 ℃ 5 s,55℃ 10 s,72℃ 15 s,经40个循环,采集荧光信号。退火温度55℃,延伸温度72℃。制作60~95 ℃的熔解曲线,相对表达量用2-ΔΔCt计算。
1.7 Western blot检测
细胞用RIPA裂解液裂解,提取总蛋白,BCA法测定蛋白浓度。等量蛋白经SDS-PAGE电泳分离,电泳条件设置分离胶恒定电压80 V,50 min,浓缩胶恒定电压100 V,2 h。转移至PVDF膜,GAPDH分子量为25 kD左右,Vimentin分子量为43 kD左右,N-cadherin和E-cadherin均125 kD左右。设置电流300 mA,大分子量转膜2 h,小分子量转膜90 min。脱脂奶粉封闭1.5 h后,孵育一抗、二抗,抗体稀释比例均为1∶1500。以化学发光剂HRP发光,凝胶成像系统下成像。
1.8 动物模型构建
BALB/c雌鼠,6~8周龄,12只,购自山东大学动物实验中心。在实验小鼠第3对乳腺脂肪垫处注射100 μL 4T1-GFP细胞混悬液(细胞密度为1×107/mL)。荷瘤1周左右,待肿瘤体积为100 mm3时将小鼠随机分成2组,对照组和阿霉素治疗组(DOX治疗组),每组6只。对照组给予生理盐水腹腔注射(200 μL/20 g体重),阿霉素治疗组按2.5 mg/kg体重给予阿霉素腹腔注射,每3天给药1次,连续给药3周。处理结束,眼球取外周血后摘取原发瘤和肺组织,肉眼观察肺结节数量并计数比较。
1.9 免疫磁珠分选CTCs
待动物模型给药周期结束,摘除小鼠眼球取血1 mL左右至1.5 mL EP管中(提前加入20 μL肝素抗凝),取100 μL外周血加入3倍体积的红细胞裂解液,按说明书裂解红细胞。用分选缓冲液清洗细胞并重悬,加入CD326+MicroBeads置于4℃冰箱中孵育15 min。将磁柱置于MACS分离器中,用3 mL分选缓冲液冲洗磁柱,清洗细胞并重悬加入到磁柱中,收集洗脱液,显微镜下进行细胞观察、计数与拍照。以细胞计数板记10 μL液体中荧光细胞数并根据体积得到每100 μL外周血中CTCs计数。
1.10 统计学方法
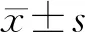
2 结果
2.1 DOX对不同TNBC细胞增殖的抑制作用
为观察DOX对MDA-MB-231、MDA-MB-468和4T1细胞的作用剂量-效应关系,用不同浓度DOX(0、0.5、1.0、1.5、2.0、2.5 μmol/L)处理细胞24 h,MTT法检测细胞增殖抑制情况。结果显示,DOX能明显抑制3种细胞的增殖,且呈剂量依赖趋势(图1)。因DOX对3种乳腺癌细胞的增殖抑制作用无明显差别,我们选取抑制率在20%左右的0.5 μmol/L DOX作为低浓度观察DOX对乳腺癌细胞EMT的影响。
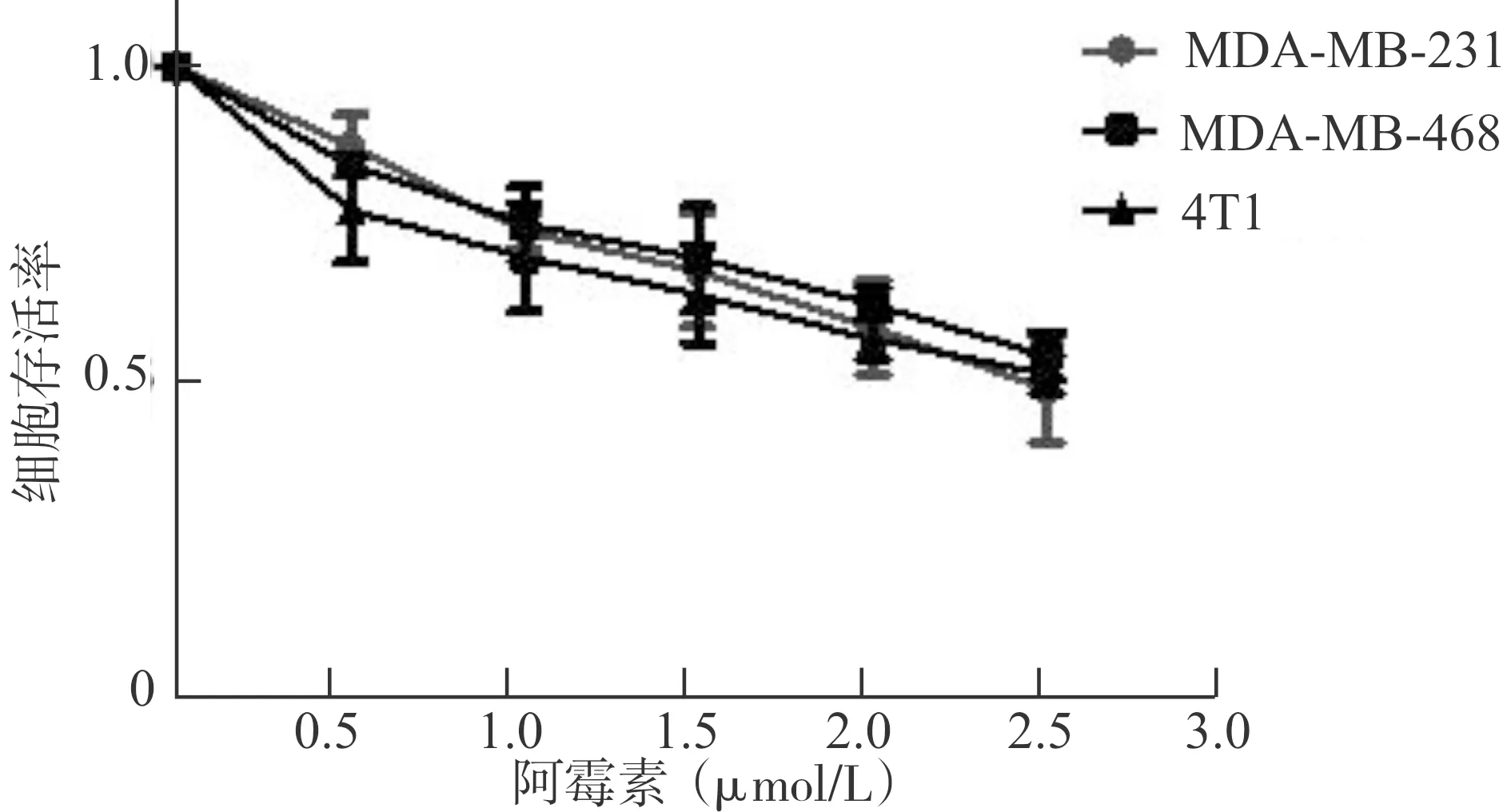
图1 DOX对3种TNBC细胞增殖的影响Fig.1 Effect of DOX on the proliferation of three TNBC cells
2.2 DOX对TNBC细胞迁移能力的影响
肿瘤细胞的EMT过程往往引起细胞迁移能力的改变。为了评估DOX对TNBC细胞迁移能力的影响,实验组用0.5 μmol/L DOX分别预处理MDA-MB-231、MDA-MB-468和4T1细胞24 h,通过划痕实验,与对照组比较细胞迁移能力。结果表明,培养24 h后实验组划痕愈合率明显大于对照组(图2)。提示低浓度DOX可以促进TNBC细胞的迁移能力。
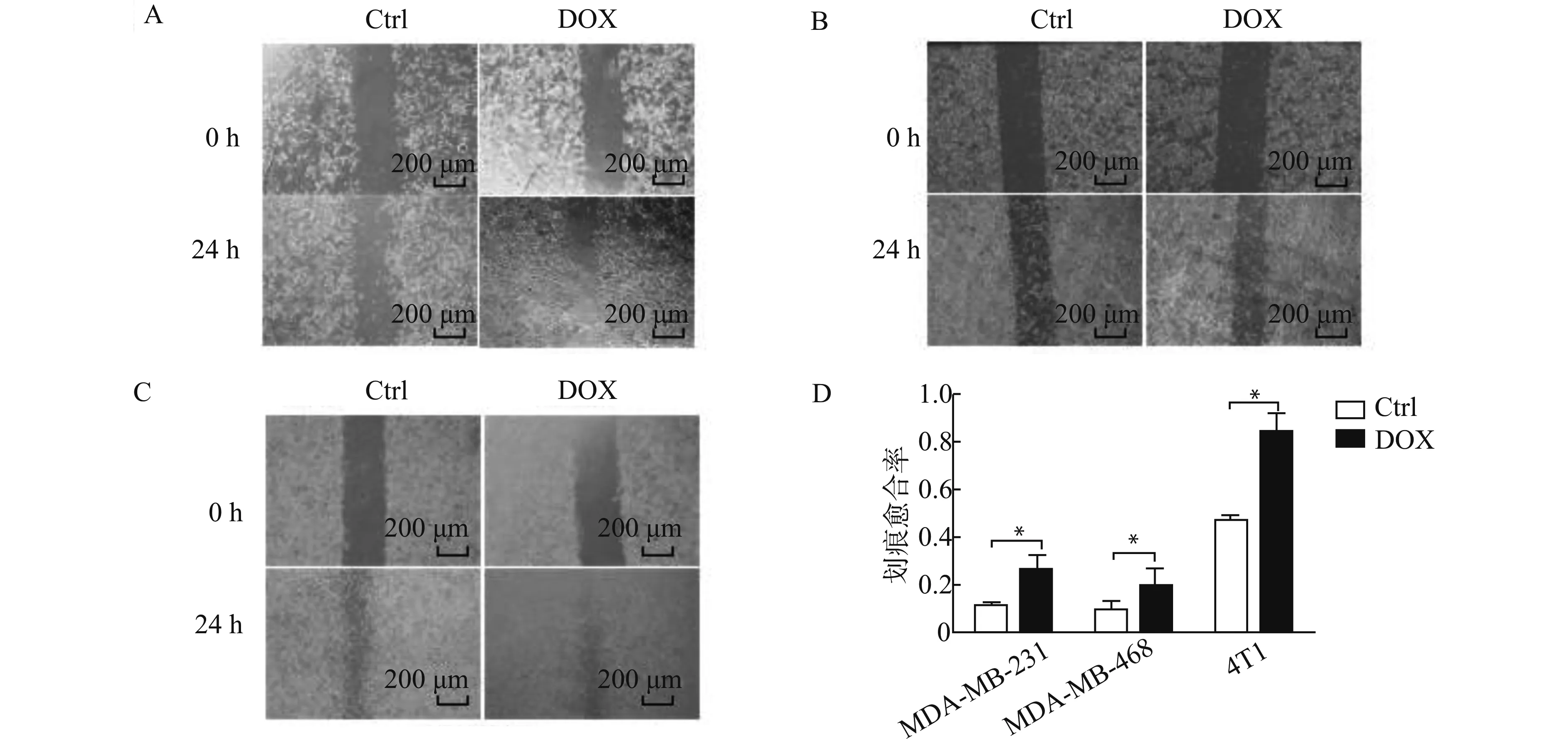
A:MDA-MB-231细胞;B:MDA-MB-468细胞;C:4T1细胞;D:统计图;Ctrl:对照组;DOX:0.5 μmol/L DOX预处理的实验组;*P<0.05,n=3图2 细胞划痕实验检测低浓度DOX对TNBC细胞迁移能力的影响Fig.2 Effect of low concentration of DOX on the migration ability of TNBC cells detected by wound-healing assay
2.3 DOX对TNBC细胞侵袭能力的影响
肿瘤细胞的EMT过程往往引起细胞侵袭能力的改变。通过Transwell实验分析低浓度DOX对TNBC细胞侵袭能力的影响,结果表明,经0.5 μmol/L DOX处理后的TNBC细胞,在相同时间(培养24 h)内穿过基质胶到达小室下表面的细胞数比对照组明显增加(图3)。提示低浓度DOX可以提高TNBC细胞的侵袭能力。
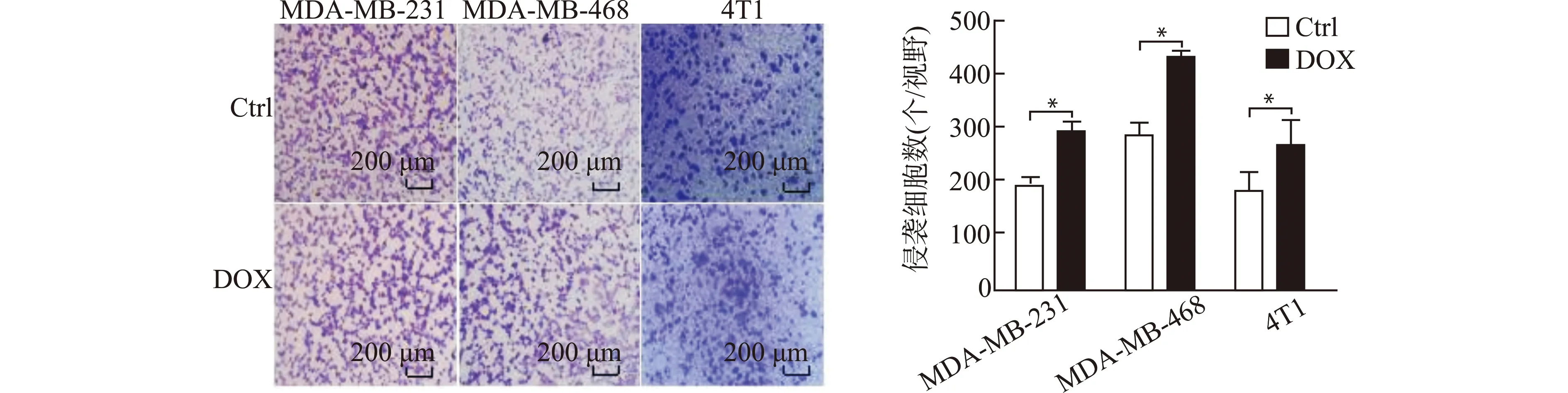
Ctrl:对照组;DOX:0.5 μmol/L DOX预处理的实验组;*P<0.05,n=3图3 Transwell侵袭实验检测低浓度DOX对TNBC细胞侵袭能力的影响Fig.3 Effect of low concentration of DOX on the invasion ability of TNBC cells detected by transwell invasion assay
2.4 DOX对TNBC细胞EMT标志物表达的影响
E-cadherin、N-cadherin和Vimentin是常用来反映细胞上皮-间质转化的标志物,其中,E-cadherin是主要的上皮标志蛋白,而N-cadherin和Vimentin是主要的间质标志蛋白。MDA-MB-231、MDA-MB-468和4T1细胞经0.5 μmol/L DOX作用24 h后,采用qRT-PCR检测标志物mRNA的表达。结果发现,上皮标志物E-cadherin基因表达降低,而间质标志物N-cadherin和Vimentin基因表达升高(图4A、4B、4C)。进一步用Western blot检测了3种标志物蛋白的表达,其中MDA-MB-231、MDA-MB-468细胞经DOX作用36 h,4T1细胞经DOX作用24 h。结果发现3种细胞EMT标志蛋白表达与基因表达情况相似,即间质标志物N-cadherin和Vimentin表达升高,而上皮标志物E-cadherin表达降低(图4D)。
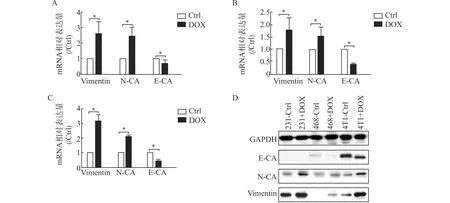
A~C:qRT-PCR检测低浓度DOX对MDA-MB-231(A)、MDA-MB-468(B)、4T1(C)细胞EMT标志物mRNA表达的影响;D:Western blot检测低浓度DOX对细胞EMT标志物蛋白表达的影响;Ctrl:对照组;DOX:0.5 μmol/L DOX预处理的实验组;N-CA:N-cadherin;E-CA:E-cadherin;231:MDA-MB-231,468:MDA-MB-468;*P<0.05图4 DOX对TNBC细胞EMT标志物表达的影响Fig.4 Effects of DOX on the expression of EMT markers in TNBC cells
2.5 DOX对TNBC动物模型的作用
为了进一步评估DOX对乳腺癌的作用,在构建携带GFP的小鼠TNBC稳定细胞株4T1-GFP的基础上,将4T1-GFP接种于BALB/c小鼠乳房脂肪垫上,构建TNBC小鼠转移模型。按照2.5 mg/kg体重的剂量每3天腹腔内注射DOX,模拟人乳腺癌治疗的过程。经过3周的治疗后,DOX治疗组小鼠肿瘤平均重量比对照组明显减轻(图5A、5B),但是其外周血中CTCs数目在87至162之间,而对照组小鼠(经生理盐水处理3周的TNBC小鼠转移模型)的外周血CTCs数目在55至120之间(图5C)。进一步观察TNBC小鼠转移模型的肿瘤肺转移灶情况,发现DOX治疗组小鼠肺转移灶数量较对照组明显增加(图5D)。这些结果提示,DOX在发挥细胞毒性作用杀伤肿瘤细胞的同时也可增加外周血中的CTCs,促进乳腺癌细胞的EMT进展,从而增加肿瘤的转移风险。

A:小鼠TNBC转移模型的原发瘤(上)和肺转移情况(下);B:DOX治疗组和对照组原发瘤重量的比较;C:DOX治疗组和对照组外周血CTCs数量比较;D:DOX治疗组和对照组肺转移灶数量的比较;Ctrl:对照组;DOX:2.5 mg/kg体重DOX治疗组;*P<0.05图5 DOX对小鼠TNBC转移模型的影响Fig.5 Effects of DOX on TNBC transplantation mouse model
3 讨论
最新统计数据显示,乳腺癌已成为世界范围内女性最常见的恶性肿瘤,其发病率随着年龄的增加而增加[28]。TNBC是乳腺癌中死亡率最高的一种类型,其原因与化疗耐药有关[29]。DOX是目前使用最广泛的蒽环类药物,在许多癌症类型中表现出显著的治疗活性,被认为是最有效的化学治疗药物之一。DOX的抗癌机制可总结为2条[30],一是通过抑制DNA拓扑异构酶Ⅱ使DNA双螺旋链解开,从而抑制DNA的转录翻译,抑制大分子生物合成产生抗癌作用;二是它可以通过产生诱导DNA和细胞膜损伤的自由基发挥细胞毒作用。然而DOX在临床使用过程中的耐药性同样限制了其应用[31-34],有研究发现其耐药性的产生与P170质膜糖蛋白有关。P170蛋白是一种分子量为170 kD的糖蛋白,是一种能量依赖型多药外排泵,在多种恶性肿瘤中过表达,它可以通过减少细胞内药物蓄积降低机体对药物的敏感性[35]。然而,近年来越来越多的证据表明,TNBC的化疗耐药是由EMT引起的,并且抑制EMT可以抑制TNBC的化疗耐药[36]。肿瘤细胞发生EMT可以使细胞增殖降低、凋亡耐受增加以及耐药相关基因表达增加从而进入血液循环形成CTCs,进而导致肿瘤的复发和肺转移[22,37]。有研究提出肿瘤发生耐药和复发的主要原因是CTCs数量的增加以及下游CSC的肿瘤起始作用[38-40],此外,癌症患者的不良预后与CTCs的EMT表型有关。在个性化医学时代,CTCs在治疗方案的设计和肿瘤进展检测中已变得极为重要。然而,迄今为止人们对CTCs的研究大多集中在临床上,本研究从细胞和动物层面进一步探究EMT和CTCs在DOX引起的乳腺癌耐药中的作用。
本研究首先通过体外实验使用低浓度DOX对人TNBC细胞MDA-MB-231、MDA-MB-468,以及鼠乳腺癌细胞4T1进行短期处理。肿瘤细胞经DOX处理后发生了显著的分子生物学变化,间质标志物N-cadherin和Vimentin表达升高,而上皮标志物E-cadherin表达降低,说明低浓度DOX可以诱导TNBC细胞发生EMT。划痕实验和侵袭实验结果也提示,低浓度DOX能够增强肿瘤细胞迁移和侵袭能力。在体内实验中,本研究首次发现DOX可以影响模型小鼠外周血CTCs的计数,并且认为这种改变与体外实验中DOX引起的肿瘤细胞EMT变化有关。有趣的是,我们发现经DOX治疗的TNBC转移模型小鼠原发瘤的大小和重量的确有所减小,但同时其外周血CTCs数目却明显增加,而且DOX治疗组的肺转移也增多。这恰好解释了DOX在发挥抗肿瘤细胞毒作用的同时也增加了TNBC复发和转移风险的原因。本研究的体内和体外实验都表明低浓度DOX可引起TNBC细胞发生EMT,从而促进TNBC的侵袭和转移。
EMT的发生是TNBC发生化疗耐药的最主要的原因之一。已有研究表明DOX除了可以诱导细胞凋亡外,暴露于DOX的癌细胞也表现出与EMT变化一致的表型,包括多药耐药(MDR)和增强的侵袭能力[32]。EMT相关的信号转导途径包括Wnt、Notch、核因子-κB(NF-κB)、促分裂原活化蛋白激酶(MAPK)和磷脂酰肌醇3激酶(PI3K)等。不同的刺激可能诱导多种信号通路,这些信号通路又大多被几种诱导EMT的转录因子所调控,包括Snail、Slug、Twist、Zeb1、Zeb2[41]。最近的研究表明,在MMTV/PyVmT转基因动物模型中,DOX治疗可引起循环中TGF-β水平的增加[42],并可通过激活Smad2-Smad3-TGF-β信号通路促进肿瘤细胞的侵袭和转移[43]。进一步研究发现在乳腺癌细胞中DPP-4的缺乏可以通过CXCL12/CXCR4/mTOR/TGF-β轴促进EMT,从而促进DOX化疗耐药[44]。有研究证明,在DOX耐药的乳腺癌细胞中,SIRT1/β-连环蛋白上调,并通过激活Wnt/PI3K/AKT通路促进EMT[45]。在TNBC中DOX究竟是以何种途径影响EMT以及外周血CTCs是我们下一步要研究的主要内容,这将为临床改善TNBC治疗中的DOX耐药提供新思路和理论基础。

