任意数量离散不规则感兴趣区域的快速荧光寿命显微成像*
牛敬敬 刘雄波 陈鹏发 于斌 严伟 屈军乐 林丹樱
(深圳大学生物医学光子学研究中心/物理与光电工程学院,光电子器件与系统重点实验室,深圳 518060)
荧光寿命显微成像(fluorescence lifetime imaging microscopy,FLIM)技术在细胞微环境传感中具有特异性强、灵敏度高、可定量的优点,被广泛应用于生物医学研究.其中,基于时间相关单光子计数(time-correlated single photon counting,TCSPC)进行荧光寿命探测的方法是目前最常用的技术之一,但受成像原理和条件限制,该技术存在数据采集时间较长、成像速度不够快的不足.本文开发一种能对生物样品中任意数量离散的、形状不规则的感兴趣区域(region of interest,ROI)进行快速FLIM 成像的技术.该技术利用声光偏转器(acousto-optic deflector,AOD)实现快速灵活的寻址扫描,并通过对ROI 形状特征的简单在线分析,实现AOD 与TCSPC 同步策略的优化及寿命图像的准确重构,对于生物样品中常见的存在多个离散不规则ROI情形,可大幅节省数据采集时间,从而实现对这些ROI 的快速FLIM 成像.采用该技术,对氯化铵刺激下活细胞中溶酶体探针LysoSensor Green DND-189 的荧光寿命变化进行了动态FLIM 成像,以监测溶酶体管腔内pH 值的实时变化情况.结果表明,该快速FLIM 技术可用于动态监测生物样品中微环境的变化,将在活细胞微环境传感中发挥重要作用.
1 引言
荧光寿命显微成像(fluorescence lifetime imaging microscopy,FLIM)技术在测量细胞微环境的离子浓度、黏度、折射率、温度和pH 值等生化参数时具有特异性强、灵敏度高、可定量的优点[1−3],因而在生物医学领域中有着较为广泛的应用,成为生物医学研究的重要工具.在各种FLIM 技术中,采用时间相关单光子计数(time-correlated single photon counting,TCSPC)的方法实现荧光寿命探测是目前最常用的做法,其原理是采用高重复频率的脉冲激光激发样品,同时由高灵敏度的探测器如光电倍增管(photomultiplier tube,PMT)探测单光子荧光信号,通过获取每个激发周期内荧光光子到达探测器的时间并进行计数,得到近似荧光强度衰减曲线的光子数-时间分布直方图,从而拟合或计算得到荧光寿命值[4−8].一般而言,为了得到准确的荧光寿命值,该方法要求激发光不能太强以避免一个周期产生多个荧光光子的“光子堆积”效应,但同时又要求每个像素点累积足够多的光子数用于寿命拟合[9−11],因此实际应用中通常将TCSPC-FLIM 与激光扫描共聚焦显微术[12](laser scanning confocal microscopy,LSCM)或双光子激发荧光显微术[13](Two-photon excited fluorescence microscopy,TPEFM)结合,通过重复多次的逐点扫描来累积光子数,实现FLIM 成像.
传统的扫描成像系统通常采用振镜对成像视场进行栅扫描,扫描方式不够灵活,且扫描时存在机械惯性,成像速度受到限制.声光偏转器(acousto-optic deflector,AOD)利用声光晶体的声光效应,可通过加载不同的声波频率改变其出射光的衍射角,从而实现光束的线性偏转,代替振镜作为扫描器件.相比振镜扫描,AOD 扫描不存在机械惯性问题,扫描速度快,重复精度高,并且由于两个维度的偏转可独立控制,扫描方式很灵活,可实现跳跃性的快速寻址扫描[14,15].2013 年,深圳大学屈军乐课题组[16]首次将AOD 寻址扫描应用于TCSPC-FLIM,实现了对任意形状感兴趣区域(region of interest,ROI)的FLIM 成像.在该工作中,AOD扫描与TCSPC 数据采集之间只有一个同步信号,控制方式简单,成像灵活.但这种方法由于需要逐点存储寿命数据再进行下一个像素点的采集,因此即使是对较小视场进行成像通常也需要很长的采集时间(如10×10 像素需要3 min),成像速度较慢,并不适用于快速生物医学过程的研究.2014 年,该课题组改用像素、行、帧三个信号对AOD 扫描和TCSPC 采集进行同步控制,从而大幅节省了采集和存储时间,提升了成像速度,实现了坏死因子(TNF-α)诱导癌细胞凋亡过程的FLIM 成像,以监测其黏度和pH 值的变化过程,FLIM 成像速度达到了10 s/帧[17].然而,实际应用中这种同步控制方式仅适用于单个矩形区域的扫描成像,否则后期数据重构将过于复杂耗时,从而使AOD 快速寻址扫描的优势不能很好发挥出来,失去了对任意形状ROI 寻址扫描的灵活性,对存在多个ROI 的情形更加无能为力.针对生物医学研究中常见的存在多个离散不规则ROI 的情形,本文在上述工作的基础上,通过对ROI 的形状特征进行简单的在线分析,对AOD 扫描与TCSPC采集之间的同步控制方式进行优化,并发展相应的寿命图像数据处理方法,可方便地实现对视场中任意数量的离散、不规则ROI 的快速FLIM 成像,为FLIM 技术在活细胞微环境传感等领域的应用提供了一种新的手段.
2 系统与方法
2.1 快速FLIM 系统的搭建
图1 为搭建的快速FLIM 系统示意图.以商用倒置荧光显微镜(Ti2-U,Nikon)为框架,采用钛宝石可调谐飞秒脉冲激光器(Chameleon Ultra II,Coherent)作为双光子激发光源,常用波长为800 nm,峰值功率为3.8 W,重复频率为80 MHz.激光经半波片HWP 和偏振分束棱镜PBS 调节功率、扩束镜BE1 扩束准直和光束提升镜BL 提升后进入二维AOD 扫描器2D-AOD.但由于AOD 中的声光晶体为大色散介质,需在AOD 前引入一个色散棱镜DP 对其引起的空间和时间色散进行预校正[18].2D-AOD 由一对正交放置的AOD (DTSXY-400-640,AA Opto-electronic)组成,激光经AOD 产生的衍射光偏转角由加载在声光晶体上的声波频率决定,因此采用衍射光作为扫描光时,通过加载不同的声波频率,就可以实现X-Y二维平面内任意点的跳跃性扫描.声波频率信号由数据采集卡(USB-6353,National Instruments)输出的数字信号转换而成.扫描光经扩束镜BE2 扩束准直后进入显微镜,经物镜O (100×/1.45 NA,Nikon)聚焦激发样品.产生的荧光经二向色镜DM、滤光片FT 和反射/透射比7:3 的分束镜BS 同时被 PMT(PMC-100-0,Becker &Hickl GmbH)和EMCCD(DU897,Andor)收集.EMCCD 采集的荧光信号用于选取ROI;PMT 采集的荧光信号经放大后传输给TCSPC 采集卡(SPC-150,Becker &Hickl GmbH)处理得到寿命数据,并在计算机上由采集和分析软件(SPCM,Becker &Hickl GmbH)存储并实时显示为荧光强度图像,随后可在该软件(或其他寿命分析软件)中分析得到各像素点的荧光寿命并显示为荧光寿命图像.
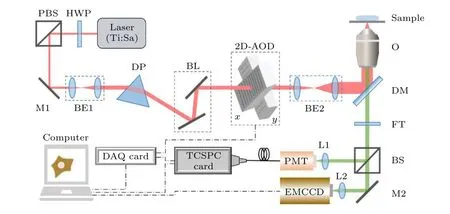
图1 快速FLIM 系统示意图Fig.1.Schematic diagram of fast FLIM system.
2.2 同步信号的产生策略
AOD 扫描与TCSPC 寿命数据的采集和存储之间的同步控制,是上述快速FLIM 系统得以正常工作并获得正确的荧光寿命图像的关键.采用同一数据采集卡输出的3 个脉冲信号作为像素(pixel)、行(line)、帧(frame)同步信号,分别控制寿命数据存储时的像素与像素、行与行、帧与帧之间的切换[19],其中像素信号需要与控制AOD 扫描的数字信号保持严格同步,行信号由扫描区域中每行的像素个数决定,帧信号则由扫描区域的总像素数决定.通常情况下,三路同步信号均为周期信号,周期长度可根据扫描区域的行列数提前设定好.以扫描一个5×2 像素的矩形ROI 为例,控制AOD 扫描的数字信号和三路同步信号如图2(a)所示,AOD扫描区域如图2(b)所示,而TCSPC 数据采集和存储如图2(c)所示,其中数字代表数据存储顺序,不同颜色代表不同寿命值.
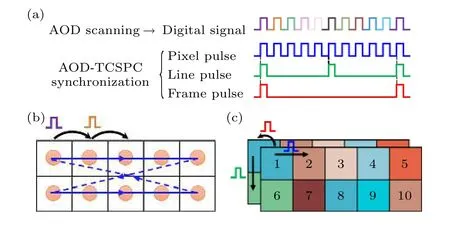
图2 AOD 扫描信号及其与TCSPC 的同步原理示意图 (a)数字信号及三路同步信号;(b) AOD 扫描过程;(c) AOD-TCSPC同步过程Fig.2.Schematic diagram of AOD scanning signal and its synchronization principle with TCSPC:(a) Digital signal and three synchronization signals;(b) AOD scanning process;(c) AOD-TCSPC synchronization process.
但显然这种同步信号的产生策略只适用于单个矩形ROI,对于形状不规则的或者多个离散的ROI 则不适用.为了实现对任意数量离散不规则ROI 的快速FLIM 成像,需要对同步信号的产生策略进行优化,使其能够与所选ROI 的形状特点相对应,以得到正确的荧光寿命图像.以图3(a)所示的3 个离散不规则ROI 为例,为了产生与其尽量匹配的同步信号,同时便于后期数据处理,需要对ROI 的形状特征进行在线分析.首先,找出包含所有ROI 的外接矩形区域(即图中所示的6×6 像素区域),保存该外接矩形区域像素点的坐标信息,用于后期数据处理;然后,计算每一行需要扫描的像素数(如第一行为3 个像素),用于调整行信号的输出,即产生的同步信号应如图3(b) 和图3(c)所示,其中行信号不再是周期信号,相邻行信号脉冲的间距由当前行需要扫描的像素数决定.根据这种策略产生的三路同步信号与所选ROI 的形状是相对应的,因此对于任意数量任意形状的ROI 都是适用的,也包括前面提到的单个矩形ROI.值得指出的是,对于没有像素点需要扫描的“空行”,实际上并不会有行信号产生,同时由于TCSPC 数据存储是顺序无结构的,因此存储下来的荧光寿命数据并不完全与ROI 中各像素点的实际扫描位置相对应,如图3(d)所示,即存储下来的寿命数据仍存在未关联到准确空间位置的问题,需要进一步映射处理以得到准确的寿命图像.
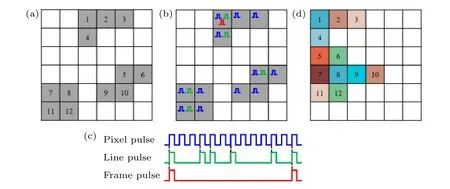
图3 针对任意数量离散不规则ROI 的同步信号产生新策略示意图 (a)三个离散的不同形状ROI(灰色);(b)每个扫描点所需的同步信号;(c)按新策略产生的三路同步信号;(d)已分行存储但仍未准确映射的荧光寿命数据Fig.3.Schematic diagram of a new strategy for generating synchronization signals for any number of discrete irregular ROIs:(a) Three discrete ROIs of different shapes (gray);(b) the synchronization signals required for each scan point;(c) three synchronization signals generated according to the new strategy;(d) fluorescence lifetime image data that has been stored in rows before mapping.
2.3 寿命图像的重建
结合前面ROI 形状分析得到的外接矩形区域信息,可以方便地对已分行存储的寿命数据进行映射处理,即将每个像素点得到的寿命数据移位到其实际的扫描位置处,以重构出准确的荧光寿命图像.具体过程如图4 所示.
首先,如图4(a)—(c)所示,将扫描ROI 的坐标信息与其外接矩形区域的坐标信息进行比较(取交集),可得到一个二值化矩阵(图中数字表示非零元素,对应ROI 内的扫描像素).然后,如图4(d)—图4(f)所示,将该二值化矩阵中非零元素的列坐标(图4(d)中数字所示)与TCSPC 顺序存储时的列坐标(图4(e)中数字所示,参考图3(d))进行比较(相减),可计算得到每个像素的横向相对位移(图4(f)中数字所示),称图4(f)的矩阵为X方向的移位矩阵.同理,通过比较行坐标(图4(g)和图4(h))可得到Y方向的移位矩阵,如图4(i)所示.利用这两个移位矩阵,就可以对寿命数据矩阵(图4(j))进行移位操作,从而得到准确的寿命图像,其中X方向移位操作结果如图4(k)所示,继续进行Y方向的移位操作后,可得到如图4(l)所示的寿命图像.
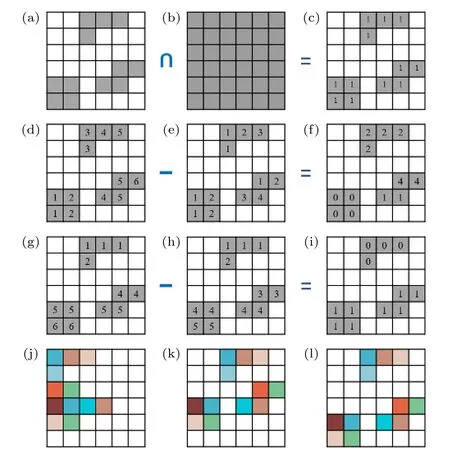
图4 寿命数据处理方法示意图 (a)扫描ROI;(b)外接矩形;(c)二值化矩阵;(d)二值化矩阵非零元素列坐标;(e)寿命数据顺序存储列坐标;(f) X 方向移位矩阵;(g)二值化矩阵非零元素行坐标;(h)寿命数据顺序存储行坐标;(i) Y 方向移位矩阵;(j)未移位的寿命图像;(k) X 方向移位后的寿命图像;(l) Y 方向移位后的准确寿命图像Fig.4.Schematic diagram of the processing method for the lifetime image data:(a) Scanned ROIs;(b) circumscribed rectangle;(c) binarized matrix;(d) column coordinates of non-zero elements in the binarized matrix;(e) column coordinates of the lifetime data before mapping;(f) shift matrix in X-direction;(g) row coordinates of non-zero elements in the binarized matrix;(h) row coordinates of the lifetime data before mapping;(i) shift matrix in Y-direction;(j) lifetime image before mapping;(k) lifetime image after shift in X-direction;(l) correct lifetime image after shift in Y-direction.
这样,通过在线分析所选ROI 的形状特征并获取其外接矩形区域的像素信息,不仅优化了同步信号的产生策略,使得TCSPC 采集和存储的寿命数据分行存储,还可以通过简单的运算对寿命数据进行映射处理得到准确的寿命图像,从而实现对任意数量任意形状ROI 的快速FLIM 成像.
3 结果与讨论
3.1 任意数量离散不规则ROI 成像验证
为了验证上述方法对任意数量离散不规则ROI 的成像能力,以铃兰根茎切片(从Leica 公司采购的标准样片)为例进行成像,结果如图5 所示.其中图5(a)为EMCCD 采集的样品明场图像,通过LabVIEW 编写的控制程序可在其上根据需要选取ROI(也可以在EMCCD 采集的宽场荧光图像上选取),选取时可采用预设的形状,也可以直接用鼠标圈选任意不规则形状,如图中绿色图形所示.完成选区后,数据采集卡产生对应ROI 坐标信息的数字信号,控制AOD 对激光进行偏转,实现对选定ROI 的扫描和激发;同时,程序自动完成如前文所述的ROI 形状特征在线分析,并控制数据采集卡按照新策略产生对应的三路同步信号,控制TCSPC 开始采集和存储相应的寿命数据.图5(b)为扫描过程中EMCCD 拍摄的荧光强度图像,可以看到只有所选ROI 以内的样品被激发出荧光,其余部分没有信号.图5(c)为利用TCSPC 采集的数据直接分析得到的荧光寿命图像,可以看出寿命数据已分行存储,但由于未将寿命信息关联到准确的位置,图像不能反映样品的真实结构.图5(d)为移位处理后的荧光寿命图像,可以看到图像中四个ROI 的结构均与图5(b)所示的荧光强度图像符合得很好.

图5 铃兰根茎切片样品多个离散的不同形状ROI 的FLIM成像 (a)明场图像及ROI 的选取;(b) EMCCD 采集的荧光强度图像;(c) TCSPC 采集得到的寿命图像;(d)准确重构的荧光寿命图像Fig.5.FLIM imaging of multiple discrete ROIs of different shapes in convallaria slice sample:(a) Bright field image collected by EMCCD and selection of ROIs;(b) fluorescence intensity image collected by EMCCD;(c) lifetime image collected by TCSPC;(d) corrected fluorescence lifetime image.
3.2 成像速度对比分析
本文所提的方法能够实现对ROI 的快速FLIM成像,本质上是因为采用了寻址扫描方式,对于多个离散的、形状不规则的ROI 而言,可以大幅减少非感兴趣像素点的数量,从而间接提高成像速度.以铃兰根茎切片样品为例,假设有生物学意义的ROI 为图6(a)所示的环形区域,采用本文方法进行FLIM 成像得到的结果如图6 所示,其中图6(b)为EMCCD采集的荧光强度图像,图6(c)为TCSPC 采集的光子计数累积得到的荧光强度图像,图6(d)为利用TCSPC 采集的光子计数进行分析和重构后得到的荧光寿命图像.作为对比,图7 所示为扫描包含该环形ROI 的矩形区域时得到的结果.可见,当感兴趣的结构只是图中环形ROI 部分时,采用本文的寻址扫描成像方式可以只采集环形ROI 中的数据,而传统栅扫描方式则至少需要对包含该ROI 的整个矩形区域进行扫描,因而将许多原本不需要的像素包括在内,既增加了数据采集时间,也增加了数据处理负担.定量地,可统计得到图6中环形ROI 包含的像素数为6164,而图7 中矩形ROI 包含的像素数为15625,在保证单像素采集的最大光子数基本一致(分别为841 和824)的前提下,图6 和图7 的采集时间分别为3.0 s 和7.8 s,即由于环形ROI 像素数仅为矩形的约39%,相应的采集时间缩短为矩形的38%,采集时间随着扫描像素数的减少而成比例地减少.

图6 铃兰根茎切片样品环形ROI 的FLIM 成像 (a)环形ROI 的选取;(b) EMCCD 采集的荧光强度图像;(c) TCSPC采集的荧光强度图像;(d)荧光寿命图像Fig.6.FLIM imaging of a circular ROI in convallaria slice sample:(a) Selection of the circular ROI;(b) fluorescence intensity image collected by EMCCD;(c) fluorescence intensity image collected by TCSPC;(d) fluorescence lifetime image.
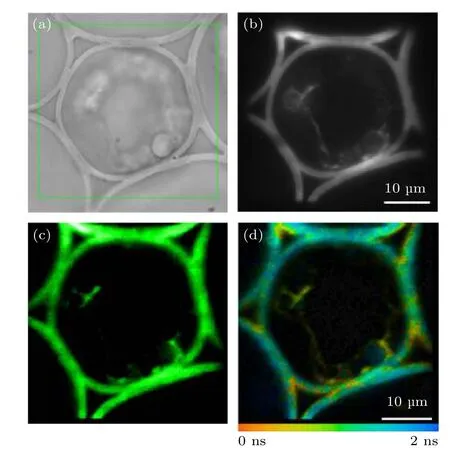
图7 铃兰根茎切片样品矩形ROI 的FLIM 成像 (a)矩形ROI 的选取;(b) EMCCD 采集的荧光强度图像;(c) TCSPC采集的荧光强度图像;(d)荧光寿命图像Fig.7.FLIM imaging of a rectangular ROI in convallaria slice sample:(a) Selection of the rectangular ROI;(b) fluorescence intensity image collected by EMCCD;(c) fluorescence intensity image collected by TCSPC;(d) fluorescence lifetime image.
在生物医学成像实验中,ROI 呈离散不规则分布的情况是非常多见的,例如对于细胞核或者细胞中其他细胞器的研究等.因此,对于这些情形,采用本文的方法可以大幅缩短数据采集时间,提高FLIM 成像速度.ROI 越小、越分散,采用这种方法的优势就越明显.特别地,当感兴趣区域是一些离散点时,采用本文的方法不仅方便,而且可以达到非常快的成像速度.为了验证这一点,采用平铺在盖玻片上的罗丹明6 G 溶液为样品,选取视场内构成“FAST FLIM”图样的87 个离散点进行成像,结果如图8 所示.由于扫描的像素数量非常少,荧光寿命图像采集时间仅为52.2 ms,成像速度非常快.而传统成像方式很难做到这一点,这是因为虽然TCSPC 采集时也有单点探测模式,但其探测的点是不能根据需求任意指定的,只能是视场中央的一个点,一般用于调试采集参数.而采用本文的成像方式,即AOD 寻址扫描结合TCSPC 三路同步信号产生的新策略和图像数据处理方法,就可以方便地做到任意离散点的快速FLIM 成像.

图8 罗丹明6G 溶液样品中离散点的快速FLIM 成像 (a)离散像素点的选取;(b) EMCCD 采集的荧光强度图像;(c) TCSPC采集的荧光强度图像;(d)荧光寿命图像Fig.8.Fast FLIM imaging of discrete pixels in rhodamine 6G solution:(a) Selection of the discrete pixels;(b) fluorescence intensity image collected by EMCCD; (c) fluorescence intensity image collected by TCSPC;(d) fluorescence lifetime image.
3.3 活细胞成像应用
利用本文的快速FLIM 成像方法,对氯化铵刺激下活细胞中溶酶体探针的荧光寿命变化进行动态成像,以监测溶酶体管腔内pH 值的变化情况.实验采用对pH 敏感的探针LysoSensor Green DND-189 标记人肉骨瘤细胞(U2OS,37 ℃、5% CO2孵育)中的溶酶体(标记浓度1 µM (1 M=1 mol/L),孵育时间30 min).首先如图9(a)—(b)所示,选取一个感兴趣细胞并拍摄其明场图像和宽场荧光强度图像,发现溶酶体的荧光信号比较集中,进而选择“1”和“2”两个ROI进行快速FLIM 成像,单幅采集时间为200 ms.成像过程中加入10 µL 浓度为1 µM 的氯化铵溶液对活细胞进行刺激,并记录加入氯化铵溶液后5 min 内ROI 中的荧光寿命图像,结果如图9(c)和图9(d)所示,其中图9(c)表示加入氯化铵溶液刺激后两个ROI 中溶酶体探针平均荧光寿命的变化,图9(d)为部分时间点的荧光寿命图像,时间点“0”对应尚未加入氯化铵溶液时的结果.可以看到,在氯化铵的刺激下,两个ROI 中溶酶体探针的荧光寿命都是先急剧变短,然后再缓慢变长.根据文献[20]报道的探针LysoSensor-DND189 的荧光寿命与pH 值的关系(即pH 值越高,探针的荧光寿命越短;反之亦然),该过程中溶酶体探针的荧光寿命变化代表的是其管腔内pH 值的变化情况,即在弱酸性溶液氯化铵的刺激下,活细胞中溶酶体管腔内的pH 先急剧增大,然后再缓慢回落.该动态结果很好地记录了对于外界的突然刺激溶酶体管腔内pH 值的实时变化过程.而这种实时监测结果,利用传统的TCSPC-FLIM 是无法获得的.
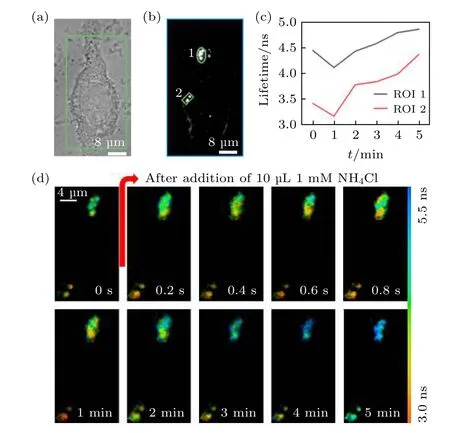
图 9 活细胞 中LysoSensor-DND189 标记溶 酶体的快速FLIM 成像 (a)明场图像;(b) EMCCD 采集的荧光强度图像及ROI 的选取;(c) ROI 平均荧光寿命随氯化铵刺激时间的变化;(d)部分时间点的荧光寿命图像Fig.9.Fast FLIM imaging of LysoSensor-DND189 labeled lysosomes in living cells:(a) Bright field image;(b) fluorescence intensity image collected by EMCCD and selection of ROIs;(c) the change of the average fluorescence lifetime in the ROIs with the stimulation time of ammonium chloride;(d) the fluorescence lifetime image of selected time points.
4 总结与展望
针对传统TCSPC-FLIM 受成像原理和条件限制,存在数据采集时间长、成像速度不够快的问题,本文开发了一种利用AOD 进行寻址扫描,并通过对ROI 形状特征的在线分析和AOD-TCSPC同步策略的优化重构出准确寿命图像的方法,从而实现了对任意数量的离散不规则ROI 的快速FLIM成像.本文详细阐述了该快速FLIM 成像方法的原理和实现过程,并对该成像方法进行了实验验证和性能分析.结果表明,利用该方法对任意数量的离散不规则ROI 进行FLIM 成像均能够得到正确反映样品真实结构的荧光强度图像和寿命图像,并且由于避免了对非感兴趣像素点的扫描,可大幅节省采集时间,实现快速FLIM 成像.采用该技术,对氯化铵刺激下活细胞中溶酶体探针LysoSensor-DND189 的荧光寿命变化进行了动态FLIM 成像,实现了溶酶体管腔内pH 值变化情况的动态监测.该方法将为动态监测生物样品中某些感兴趣对象(如细胞器等)的快速微环境变化提供很好的工具.

