原发性肝脏淋巴上皮瘤样癌MR表现4例并文献复习
肖扬锐 周新木 孙洪鸣 王祖飞 赵雪妙 李炳荣
淋巴上皮瘤样癌(lymphoepithelioma-like carcinoma,LELC)多见于鼻咽部和肺部,原发于肝脏者非常少见且术前难以确诊,经常被误诊为肝细胞肝癌(hepatocellular carcinoma,HCC)或肝内胆管细胞癌(intrahepatic cholangiocarcinoma,ICC)。目前肝脏LELC国内的相关报道不足40例。笔者通过分析温州医科大学附属第五医院4例肝脏LELC患者的MR表现并复习相关文献,旨在提高临床医师对本病的认识,现报道如下。
1 临床资料
例1 女,64岁。外院B超提示右肝强回声团10 d后于2020年3月20日就诊于本院,既往有糖尿病史。实验室检查示肿瘤标志物[甲胎蛋白(AFP)、癌胚抗原(CEA)]正常、甲肝、乙肝、丙肝结果阴性。2020年3月24日MR检查提示肝S6段有一3.0 cm×2.1 cm结节,边界清,T1WI呈稍低信号,T2WI呈轻中度高信号,未见脂肪变性、出血、结中结征,扩散加权成像(DWI)呈高信号,表观弥散系数(ADC)值减低,增强扫描动脉期病灶呈非环状整瘤显著强化,后期强化持续呈相对等信号,强化模式表现为持续强化,未见假包膜,未见动脉期瘤周异常灌注、胆管扩张及肝包膜凹陷征等周围组织结构伴随征象,肝门及腹膜后无肿大淋巴结。影像诊断考虑为肝恶性肿瘤。入院后在全麻下行右肝肿瘤切除术,手术所见肝S6段肿块,最大径约2.8 cm,质中,边界清。肿块切面呈灰白色,病理检查发现肿瘤细胞呈立方形、分枝状和腺管状分布,腺体分化程度不同,有异型,核呈卵圆形、空泡状,可见核仁和核分裂象,全瘤见大量淋巴细胞浸润,诊断为胆管淋巴上皮瘤样癌(lymphoepithelioma-like cholangio carcinoma,LELICC),原位杂交EBER(+)。术后未行放化疗治疗,MR检查随访4个月未出现复发及转移。见图1。

图1 例1患者的MR及病理检查所见[a:右肝结节,长径3.0 cm,横轴面T2WI+FS序列示病灶呈高信号;b:增强扫描动脉期病灶呈非环状整瘤显著强化;c:延迟期病灶呈相对等信号,未见假包膜征;d:肿瘤细胞呈立方形、分枝状和腺管状分布,腺体分化程度不同,有异型,核呈卵圆形、空泡状,可见核仁和核分裂象,全瘤见大量淋巴细胞浸润,HE染色,×10;e:EBER(+),病理为胆管淋巴上皮瘤样癌]
例2 女,54岁。声音嘶哑3年,2016年1月6日门诊喉镜提示声带息肉入住本院手术,住院期间腹部B超意外发现肝内低回声团。实验室检查:AFP、CEA无异常,乙肝阴性。2016年1月11日MR检查提示肝左内叶包膜下2.2 cm×2.0 cm结节,T1WI呈稍低信号,T2WI呈轻中度高信号,未见脂肪变性、出血、结中结征,DWI呈稍高信号,增强扫描动脉期病灶呈轻中度环状强化,门脉期、平衡期病灶充填性强化呈相对高信号,强化模式表现为填充强化,未见假包膜,未见动脉期瘤周异常灌注、胆管扩张及肝包膜凹陷征等周围组织结构伴随征象,肝门及腹膜后无肿大淋巴结。影像诊断考虑为肝恶性肿瘤。入院后在全麻下行左肝肿瘤切除术,术中见左肝肿块,切面呈灰白色,质中,最大径约2.2 cm。病理检查肿瘤细胞有一定异型,全瘤大量淋巴细胞浸润并形成淋巴滤泡。病理诊断为LEL-ICC,原位杂交EBER(+)。术后行经导管肝动脉化疗栓塞术预防治疗,MR检查随访4年未出现复发及转移。见图2。
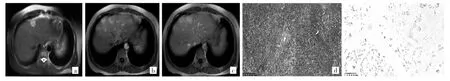
图2 例2患者的MR及病理检查所见[a:左肝结节,长径2.2 cm,横轴面T2WI+FS序列示病灶呈轻-中度高信号;b:增强扫描动脉期病灶呈轻中度环状强化;c:延迟期病灶呈高信号,未见假包膜征;d:肿瘤细胞有一定异型,全瘤大量淋巴细胞浸润并形成淋巴滤泡,HE染色,×10;e:EBER(+),病理为胆管淋巴上皮瘤样癌]
例3 男,52岁。外院B超发现“肝占位”于2016年2月15日入住本院,既往有乙肝、肝硬化、脾脏切除史。实验室检查:AFP为389.7 ng/ml(正常参考值0~15 ng/ml),CEA正常。2016年2月15日MR检查提示肝右叶两枚小结节,边缘尚清,较大者约2.0 cm,T1WI呈稍低信号,T2WI呈轻中度高信号,未见脂肪变性、出血、结中结征,DWI呈高信号、ADC值减低,增强扫描动脉期病灶呈非环状整瘤显著强化,后期强化廓清呈低信号,强化模式表现为快进快出强化,可见假包膜,未见动脉期瘤周异常灌注、胆管扩张及肝包膜凹陷征等周围组织结构伴随征象,肝门及腹膜后无肿大淋巴结。影像诊断考虑为HCC。入院后在全麻下行复杂肝脏肿瘤切除+胆囊切除术,术中于肝S6段见两枚质硬肿块,较大者最大径约2.0 cm,均边界清,可见包膜,瘤细胞异型明显,排列成团巢状,易见核分裂象,间质大量淋巴细胞浸润,淋巴滤泡形成,周围肝组织呈纤维化表现。较大者病理诊断为肝细胞淋巴上皮瘤样癌(lymphoepithelioma-like hepatocellular carcinoma,LEL-HCC),原位杂交EBER(-)。较小者病理诊断为肝细胞癌Ⅱ级,直径约1.3 cm。术后行经导管肝动脉化疗栓塞术预防治疗,MR随访4年未出现复发及转移。见图3。
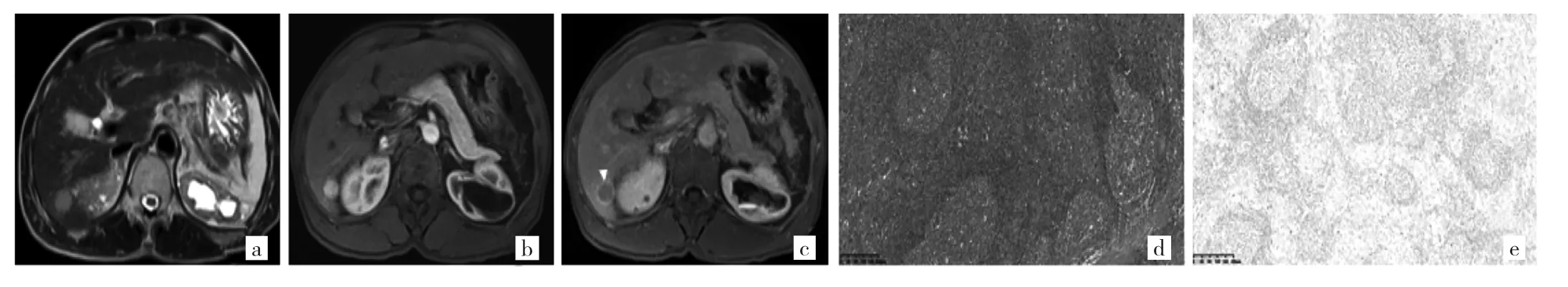
图3 例3患者的MR及病理检查所见[a:右肝结节,长径2.0 cm,横轴面T2WI+FS序列示病灶呈轻-中度高信号;b:增强扫描动脉期病灶呈非环状整瘤显著强化;c:延迟期病灶呈低信号,可见假包膜征(白箭头所示);d:瘤细胞异型明显,排列成团巢状,易见核分裂象,间质大量淋巴细胞浸润,淋巴滤泡形成,周围肝组织呈纤维化表现,HE染色,×10;e:EBER(-),病理为肝细胞淋巴上皮瘤样癌]
例4 男,44岁。外院B超发现左肝低回声团于2019年12月7日入住本院,既往有乙肝病史。实验室检查AFP、CEA正常。2009年12月3日MR检查提示肝左内叶后下缘包膜下1.6 cm×1.3 cm结节,T1WI呈稍低信号,T2WI呈轻中度高信号,未见脂肪变性、出血、结中结征,DWI呈高信号,增强扫描动脉期病灶呈轻中度环状强化,后期强化持续呈等信号,强化模式表现为持续强化,未见动脉期瘤周异常灌注、胆管扩张及肝包膜凹陷征等周围组织结构伴随征象,肝门及腹膜后无肿大淋巴结。影像诊断考虑为HCC。入院后在全麻下行左肝肿物切除术,术中于肝左内叶见一灰黄色肿块,质硬,最大径约1.6 cm,边界尚清。肿块切面灰白,质中,病理检查肿瘤细胞呈立方形,见少量核分裂象,肿瘤组织呈巢状或腺管状排列,内有大量淋巴细胞浸润并形成多量淋巴滤泡,肿瘤周边可及不完整纤维包膜;周围肝组织呈间质性肝炎表现。病理诊断为LEL-ICC,原位杂交EBER(+)。术后未行放化疗治疗,多次MR复查未出现复发及转移,无瘤生存。
2 文献资料复习
通过中国知网、万方数据库搜索“淋巴上皮瘤样癌”,排除标准:搜索结果中显示病灶位于非肝脏的其他部位,最终得到13篇文献共32例患者,其中8篇肝脏原发LELC文献报道描述了9例患者的MR表现,见表 1、2。

表1 文献中肝脏LELC患者临床资料与肝内病灶的一般情况
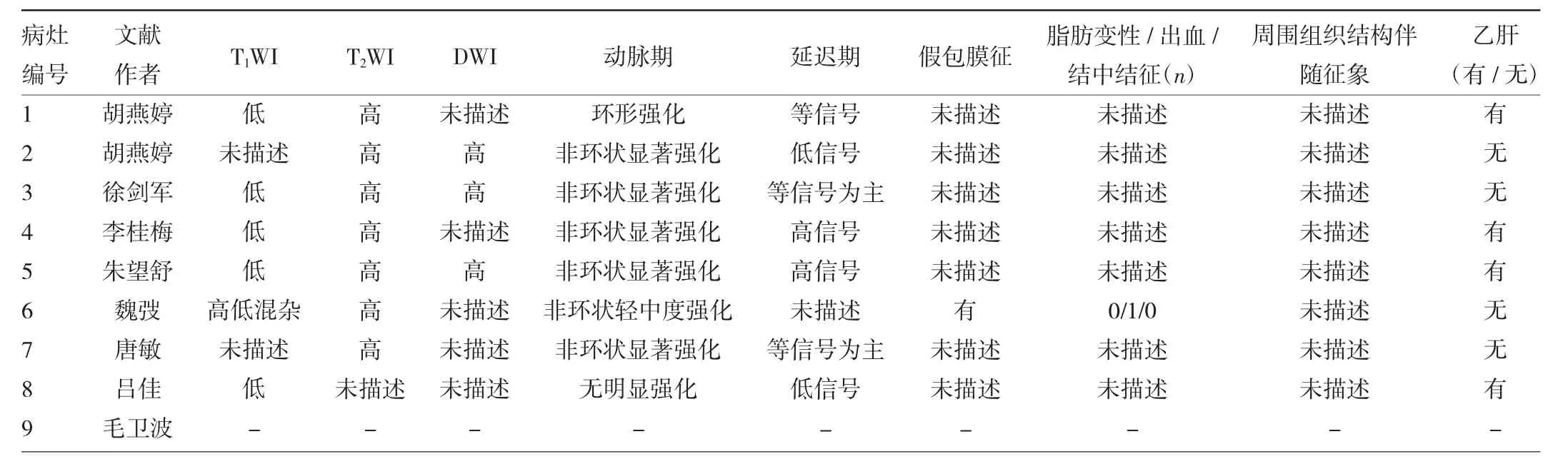
表2 文献中肝脏LELC病灶的MR表现
3 讨论
肝脏原发性LELC是肝癌中的少见类型,分为LEL-ICC、LEL-HCC和肝细胞与胆管细胞混合型LEL 3种亚型,病理检查中各亚型肝LELC均以大量淋巴细胞浸润并形成多量淋巴滤泡为特点[14]。尽管疾病的发生可能与EBV、乙型或丙型肝炎病毒感染有关[15],但患者的临床情况一般较好,少有淋巴/血行转移或微血管侵犯(mMicrovascular invasion,MVI),术后通常能够获得长期的无瘤生存[2]。
本研究显示LELC在平扫时通常表现出T1WI稍低信号、T2WI轻中度高信号、DWI高信号的一般性恶性肿瘤征象,肿瘤伴有出血时T1WI可呈高低混杂信号但出现该征象的概率低,目前仅见1例瘤内出血的报道。增强扫描时LELC可呈现多种强化表现,但动脉期病灶以非环状显著强化最为多见,环状强化次之,无明显强化表现最少;延迟期病灶信号以相对等或高信号为主,相对低信号者最少见。由此可见LELC的MR表现多样缺乏特异性,与肝细胞癌、肿块型肝内胆管细胞癌、转移瘤、混合型肝癌甚至局灶性结节增生均有一定相似或重叠之处。
笔者认为肝LELC与HCC的鉴别最为关键,原因之一是由于HCC是我国最常见的肝脏恶性肿瘤;其二,LELC患者伴发乙肝的比例也较高,而乙肝为公认的HCC高危风险因素;其三,LELC与其他肝脏恶性肿瘤公认的治疗标准仍是手术,而HCC的治疗标准并不局限于手术(介入在HCC的治疗中已得到广泛认同);换句话来说,将LELC误诊为HCC可能导致患者接受非标准的治疗,而即便LELC被误诊为其他肝脏恶性肿瘤,但对患者的预后可能不会有实质性的影响,因为它们的治疗标准是相同的。朱望舒等[4]认为多数LELC并没有在静脉期发生显著的对比剂廓清,与本文统计结果相符;非环状廓清被普遍认为是诊断HCC最有力的佐证[16],同时瘤内出血、脂肪变性、结中结征、假包膜征这些HCC较特异征象在LELC中也均罕有报道[17],病灶不具备上述征象可能有助于提高阅片者将病灶诊断为非HCC的概率。
另外已有文献和本文患者的MR影像均显示,绝大多数LELC在动脉期和(或)延迟期时发生了整瘤强化。因此笔者认为LELC病灶中极少出现影像可见的瘤内坏死征象,坏死区即便出现但其范围通常不大,这与一些好发生坏死的肝脏恶性肿瘤如胆管细胞癌、转移甚至部分低分化HCC有一定差别。
综上所述,肝脏LELC患者肿瘤标志物常无异常,病灶MR表现多样缺乏特异性,确诊仍依赖于病理;但多数LELC并不具备HCC的对比剂廓清、瘤内出血、脂肪变性、结中结征、假包膜征等表现,或许可将大部分LELC与HCC在术前予以区分。

