不同水分含量下黑土氧化亚氮排放差异
王蕾,董彦宏,王连峰
(大连交通大学 环境与化学工程学院,辽宁 大连 116028)*
东北黑土地区是我国重要的粮食作物产区之一.由于掠夺性利用,导致黑土严重退化、氮肥流失和N2O等温室气体排放问题严重.近年来,大气中温室气体排放所带来的问题严重,N2O是仅次于CO2和CH4需要管控的温室气体,土壤中排放的N2O是大气中N2O的主要来源.影响土壤中N2O排放的因素有很多,其中水分含量的变化可能会影响土壤中硝化、反硝化微生物的活性并影响土壤中氮素的转化以及N2O的产排[1-2].
土壤水分对土壤N2O产排和硝化反硝化微生物种群性状变化的影响备受关注[3].有研究表明,当土壤水分含量为60%~80% WHC时,N2O排放量最大;也有研究指出N2O排放量在80% WHC的无锡市旱地轮作黄泥土中最高[4],而在100% WHC鹰潭红壤中最高[5].土壤中主要是由硝化反硝化微生物共同作用而产生N2O.一般认为,N2O在低水分含量条件下,主要是通过硝化作用产生;而在高水分含量条件下,则是通过反硝化作用产生[6].当环境条件相对稳定时,土壤中氮素相对稳定,N2O排放量相对较少;当环境条件发生变化时,土壤中氮素形态的变化会促进N2O的产生和排放.土壤理化性质变化的强度和频率可能对N2O的产排产生重大影响.因此,有必要对环境条件变化对N2O产排的影响给予更多的关注.
1 材料与方法
1.1 土壤样品的采集与处理
供试土壤样品采自处于温带大陆性季风气候的哈尔滨黑土生态环境科学观测站,地理位置为45°40′N;126°35′E,海拔为151 m,年降水量为533 mm.取样深度为0~20 cm的耕层土壤,表面疏松,观察颜色呈棕褐色,较为湿润,含有较多植物根系等腐殖质.置于阴凉通风处自然风干,并用镊子将土壤中残留的植物根系、大颗粒石子等剔除,将土壤研磨并过2 mm筛备用.供试土样基本性质如下:pH值为7.22,有机质为26.70 g/kg,铵态氮为1.12 mg/kg,硝态氮为1.03 mg/kg,全氮为1.47 g/kg,全钾为25.16 g/kg,速效磷为51.00mg/kg,速效钾为200.00 mg/kg.
1.2 实验处理
采用120 mL血清瓶进行培养,实验设置两种水分模式,40% WHC(T1)和80% WHC(T2),于25℃下培养四周,每种处理设置3组重复样,分别在第一、二、三、四周结束时进行破坏性取样,并测定相应数据,实验设计如图1所示.
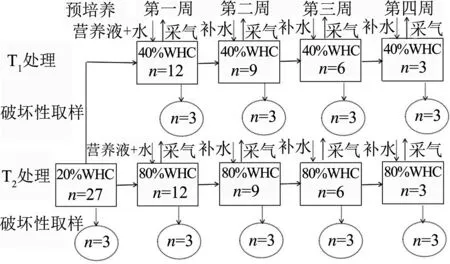
图1 不同水分培养的实验设计
取27份处理后土壤样品,每份25 g,放入120mL玻璃血清瓶中,用移液管向土壤中均匀滴加无菌水使水分含量达到20% WHC,置于生化培养箱预培养一周(恒温25℃);培养开始前,向土壤中各添加50 ppm的KNO3和NH4HCO3,随后将两组土壤样品水分含量分别调节至40% WHC和80% WHC,加橡胶塞、铝箔、封口膜密封,防止瓶内外气体交换,放入培养箱培养,记为培养点.
预培养样品3瓶,预培养一周结束后对其进行破坏性取样,土壤加1 mol/L KCL溶液浸提,用于测量NH4+-N和NO3--N含量,T1、T2处理最初均各有12瓶平行样品,在每个培养周期结束时,对两种处理各提取3瓶进行破坏性取样,重复预培养检测实验步骤;其余样品保持恒定40% WHC与恒定80% WHC水分条件.每个周期连续监测5天排放的N2O、CO2通量.
1.3 NH4+-N、NO3--N测定方法
土壤中NH4+-N采用纳氏试剂分光光度法测定:取2 mL浸提液于50 mL比色管中,加入去离子水至标线,摇匀后加入1 mL酒石酸钾钠,1.5mL纳氏试剂摇匀,静置10 min后,在波长为420 nm处,测量其吸光度.
土壤中NO3--N采用紫外分光光度法测定:取2 mL浸提液于50 mL比色管中,加入去离子水至标线摇匀,在波长为220 nm和275 nm处测量其吸光度,按照公式校正吸光度.校正吸光度公式为:A=A220-2A275.
1.4 N2O和CO2排放通量测定方法
采用气相色谱GC-7890B,进行N2O和CO2的检测,配有检测器为电子捕获检测器ECD和火焰离子检测器FID,检测器温度为300℃和250℃,柱温为60℃,载气为高纯氮气,流速为25mL/min,燃气为氢气、亚甲烷和零级空气.取一支规格为5 mL的一次性注射器在采样前抽吸空气三次,然后插入瓶内,上下抽吸三次,得到一个均匀混合的样品,采集5 mL气样插进气相色谱进样口,缓缓注入.每次取样结束后,用抽真空泵将瓶内气体排净,打开瓶塞使瓶内气体为空气.
1.5 数据处理
N2O(CO2)排放通量计算详细描述见文献[7],采用统计分析作图软件为:Microsoft Office 2013、Origin9.0.
2 结果
2.1 不同水分对NH4+-N、NO3--N含量的影响

图2 两种水分条件对NH4+-N和NO3--N含量的影响
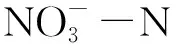
2.2 不同水分对N2O、CO2排放通量的影响
T1条件下的土壤,在培养的四周内几乎不产生N2O(图3);而在T2条件下,第一周大量排放N2O并持续上升,在第四天出现峰值,第二周排放量持续下降至4.02 μg·kg-1·h-1,后两周放量几乎为零.
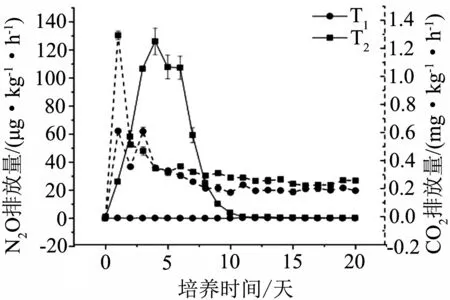
图3 两种水分条件对N2O、CO2排放通量的影响
T1条件下,培养的第一周CO2排放通量少量的增加后减少,第一周结束时的排放通量减少至0.3 mg·kg-1·h-1,第二周排放量逐渐减少并在接下来两周稳定在0.2 mg·kg-1·h-1;T2条件下,培养的第二天CO2的排放通量突然增加并达到峰值,接着开始下降,直到培养的第二周趋于平稳,后两周的排放量几乎稳定在0.3~0.4 mg·kg-1·h-1之间.在整个培养过程中除第3天外,均为T2大于T1.
2.3 不同水分对N2O、CO2累积排放量的影响
两种水分含量处理下N2O和CO2在四周内累积排放量(图4),可以看出T1条件下几乎不排放N2O,而T2条件下积累大量N2O至2 000 μg·kg-1;而CO2在两种水分条件下均大量产生,T1水分条件下产生量约为15 mg·kg-1,T2条件下积累量略大,约为20 mg·kg-1.
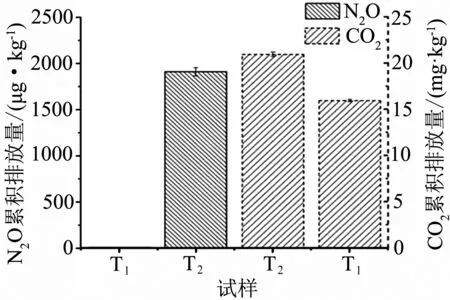
图4 两种水分条件对N2O、CO2累积排放量的影响
3 讨论
3.1 不同水分对NH4+-N、NO3--N含量的影响
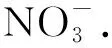
3.2 不同水分对N2O、CO2排放通量的影响
影响土壤N2O产排的主因之一是土壤水分含量,因为其影响土壤中的通气情况,进而影响土壤硝化、反硝化微生物的种类及基因丰度来影响土壤N2O产排.一般在好氧条件下,硝化作用是N2O形成的主导过程,而厌氧条件下,反硝化作用是N2O形成的主导过程.土壤湿度增加时,硝化产生N2O可能增加,随水分增加到一定程度时,N2O则是通过反硝化产生的[14].研究表明,水分含量在60%~80% WHC的土壤,N2O排放通量最大.对某一亚热带森林土壤的研究表明,在好氧条件下,反硝化作用占N2O产量的56%[15].此外随着土壤湿度的增加,平均N2O和NO排放量的减少可能是由于脱氮过程中N2排放量增加[16].
整个培养过程中,低水分条件下几乎未检测到N2O排放,硝化作用条件下,产生的N2O含量较低;高水分条件下,前两周N2O排放急剧积累,但后两周几乎不排放,可能因为土壤微生物活性降低,也可能因为在高水分含量时,较强的反硝化作用,使土壤中产生的N2O进一步转化成N2;虽然硝化、反硝化反应同样可产生N2O,但高水分含量时的反硝化能大量产生N2O.两种水分模式下CO2均在培养的前两周排放量先增后减,并在后面两周稳定排放,但高水分时排放的CO2稍高于低水分时,在培养初期土壤中供微生物生长底物充分,使土壤微生物活性增强发生剧烈的呼吸作用,且在高水分含量时硝化、反硝化微生物的呼吸强度高于低水分含量时.在每周培养的开始,排放CO2含量小幅增加,是因为培养开始会对土壤水分进行补充,有研究指出土壤水分含量增加会增加土壤微生物活性,欧阳杨等[17]的实验通过研究多种干湿交替方式发现,干湿交替条件更能促进土壤中CO2和N2O产生和释放,这解释了每周初始土壤中CO2与N2O排放量突然增加而后减少的原因.后两周开始消耗营养物质,土壤微生物活性降低,呼吸作用相对减弱;研究指出土壤干燥会降低氮的矿化率,可能由于影响底物扩散或土壤干燥的限制,低土壤湿度减少底物对土壤微生物的供应,引起部分微生物死亡[18].40% WHC时CO2排放量明显低于土壤水分值较高的情况,说明低土壤水分降低了微生物的活性;低水分含量的土壤有利于减少温室气体的排放,降低全球变暖带来的危害.
3.3 不同水分对N2O、CO2累积排放量的影响
N2O四周内累积排放量,在低水分条件下几乎不积累N2O,而高水分条件下积累大量N2O,说明水分含量对N2O产排产生剧烈影响,在低水分的硝化反应过程中几乎不产生N2O,而在高水分含量下,同时发生了强烈的硝化、反硝化反应,在该过程中所产生的N2O主要是由反硝化微生物产生的;而CO2在两种水分条件下均大量产生,在两种水分含量下微生物呼吸作用都很强,活性均很高,但低水分含量条件下主要发生的是硝化作用,高水分含量下发生的是硝化、反硝化作用,在水分含量较高的情况下土壤中微生物的呼吸作用更强,此时微生物生长繁殖的活性更强.
4 结论
(1)在低水分含量条件下,硝化反应占主导地位,通过硝化反应所产生的N2O含量相对较少,微生物呼吸作用较强;
(2)在高水分含量条件下,土壤同时发生了硝化反应和反硝化反应,反硝化作用产生大量的N2O,N2O排放通量降低是因为发生了强烈的完全反硝化反应,使产生的N2O进一步转化成了N2,并且微生物呼吸作用强于低水分含量条件;
(3)在农业生产过程中可通过控制土壤水分含量,减少土壤向大气排放N2O、CO2等温室气体.

