肝细胞癌抗原587基因甲基化调节HCA587-TAF9互作介导肝细胞癌的侵袭和迁移*
冷 雪 刘 萍 陈 桢 周 亮
(1 遂宁市中医院病理科,遂宁 629000;2 泸州市人民医院病理科,泸州 646000;3 遂宁市中医院检验科,遂宁 629000;4 四川大学华西基础医学与法医学院,成都 610065)
肝细胞癌(hepatocellular carcinoma,HCC)是中国第三大与癌症相关的死亡原因[1]。病因包括乙型/丙型肝炎病毒(hepatitis B virus/hepatitis C virus,HBV/HCV)感染、慢性酒精中毒、黄曲霉毒素、吸烟、肥胖和糖尿病等[2]。术后肝内或肝外转移的高发生率仍然是肝细胞癌难以治愈的关键原因之一[3]。已发现多个基因靶点或启动子区甲基化状态与肝细胞癌的预后密切相关[4]。Wang等[5]通过对肝细胞癌重组cDNA表达文库的血清学分析,鉴定了肝细胞癌相关抗原587(hepatocellular carcinoma-associated antigen 587,HCA587)基因,其序列与黑素瘤相关抗原C2(melanoma-associated antigen C2,MAGEC2)的序列相同。最新的研究证据显示,HCA587能够通过TATA盒结合蛋白相关因子9(TATA-box binding protein associated factor 9,TAF9)相互结合,并发挥致癌功能[6]。HCA587与癌症转移相关[7-8]。王万祥等[9]认为,HCA587 mRNA作为肿瘤标志物来检测循环肝癌细胞,可用于肝细胞癌的辅助诊断和作为监测复发、转移和预后的指标。然而,到目前为止,几乎没有关于HCA587的上调与其启动子区甲基化的相关报道。本研究假设HCA587启动子区甲基化状态失调与HCA587的上调相关,并因此而促进肝细胞癌细胞的转移。本实验通过临床肝细胞癌组织检测HCA587的表达和启动子区甲基化变化,体外检测HCA587对肝细胞癌细胞的迁移和侵袭的影响。
1 材料和方法
1.1 患者和组织样本
从2016年12月至2019年12月,于遂宁市中医院病理科收集114例接受手术治疗肝癌病例的肝细胞癌组织和癌旁非癌组织。纳入标准如下:诊断为肝细胞癌的患者;术前无放疗或化学疗法。排除标准如下:手术前接受过放疗或化疗的患者;另外,本研究从114例中随机选择3例接受手术治疗,收集这3例肝细胞癌新鲜组织以及石蜡包埋组织和各自匹配的非癌组织,用于免疫组织化学和免疫印迹检测。本研究记录每位患者年龄、性别、肿瘤大小、分化程度、原发肿瘤局部淋巴结远处转移(tumor node metastasis,TNM)分期等信息。
1.2 试剂与耗材
人肝细胞癌细胞BEL-7404购于武汉普诺赛生命科技有限公司;RPMI-1640培养基购自美国Hyclone公司;TRIzol 试剂购自美国Invitrogen公司;反转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)试剂盒购自日本TaKaRa公司;HCA587一抗购于美国Abcam公司;甲基化抑制剂5-Azacytidine购于上海浩然生物技术有限公司;HCA587的重组高表达质粒(pcDNA3.1-HCA587)和其空载体(empty vector,EV)购于上海吉玛公司;Lipofectamine 2000购自美国Invitrogen(ThermoFisher Scientific)公司;实时定量PCR(real time-qPCR)引物购自生工生物工程(上海)股份有限公司;EasyBlot购于美国GeneTex公 司;BeaverBeads™ GSH-GST蛋 白纯化磁珠购于苏州海狸公司;Transwell 小室购自Corning公司(美国);Matrigel 基底膜基质购自美国BD公司。
1.3 RT-PCR检测肝细胞癌组织中HCA587的表达
使用TRIzol一步法提取细胞总RNA,逆转录后得到cDNA,以GAPDH为内参基因,进行荧光定量PCR检测。HCA587基因的荧光定量PCR引物见表1。PCR反应条件为95℃预变性6 min;97℃变性10 s,55℃退火20 s,70℃延伸35 s,共38个循环。每个样本重复检测2次。mRNA相对表达量以2-△△Ct表示。

表1 HCA587基因引物序列
1.4 HCA587基因启动子区甲基化检测
提取肝细胞癌组和癌旁组中的DNA,每组DNA样品均进行甲基化敏感酶HhaⅠ酶切、甲基化依赖酶McrBC酶切处理,并以非酶切样本作为对照。甲基化敏感酶HhaⅠ特异性识别,并切开非甲基化的CGCG位点,甲基化依赖酶McrBC特异性识别,并酶切PumCG(N40-3000)位点。酶切体系为:限制酶4 μL,NEB buffer 5 μL,1 mmol/L GTP,BSA 100 μg/mL,DNA 4 μg,用去离子H2O补至总体积50 μL。37℃ 酶切16 h,65℃ 20 min灭活酶活性。
在HCA587基因CpG岛区域设计引物,扩增区域同时含有甲基化敏感酶和甲基化依赖酶的酶切位点。荧光定量PCR反应总体系为15 μL:酶切产物2 μL,HCA587-MF和HCA587-MR引物各1 μL,2×PCR master mix 3.0 μL,dNTP 1 μL,去离子H2O 8 μL。结果判断:若DNA样本HhaⅠ酶切后荧光定量PCR检测到特异片段的扩增,而McrBC酶切后无扩增,则判断此样品存在甲基化;若HhaⅠ酶切后无扩增,而McrBC酶切后扩增阳性,则判断为无甲基化。Ct值≥35个循环认为无扩增。
1.5 免疫印迹检测
取1~3号患者肝细胞癌标本,冷藏研磨,用磷酸盐缓冲液清洗后加入裂解液,置于EP管中,后离心(4 ℃,13 000 r/min,20 min)。取上清液,用牛血清白蛋白法测定蛋白浓度。进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,使用电转(恒电流200 mA,120 min,冰水浴),脱脂奶粉封闭2 h,加入HCA587一抗(1∶500)后在4 ℃下孵育过夜。次日 Tris-HCl 缓冲液漂洗3次后,加入二抗孵育 1 h,再用Tris-HCl 缓冲液漂洗3次,用化学发光显色、拍照,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,GAPDH)为内参。
1.6 细胞培养和转染
BEL-7404培养采用10%胎牛血清配制的RPMI-1640培养基,并置于37℃、5% CO2的培养箱中。转染前1 d将BEL-7404细胞接种于24孔板中。严格根据合成商提供的说明,使用5-Azacytidine、pcDNA3.1-HCA587及EV对BEL-7404进行分别处理,处理时间为24 h。
1.7 免疫沉淀
根据制造商的说明,采用纯蛋白组蛋白磁珠系统进行免疫沉淀实验。采用HCA587和rIgG制备抗体磁珠。随后按照免疫印迹方法进行结果分析。使用EasyBlot作为二抗抗体。
1.8 Transwell迁移和侵袭实验
细胞迁移实验取对数生长期的细胞(1×105)接种于未铺Matrigel胶的小室,500 μL的完全培养基(10%胎牛血清)加入下室;在37℃、5% CO2的培养箱中孵育24 h后取出小室,加入4%多聚甲醛固定细胞15 min,使用棉签棒擦拭上室中未穿膜细胞;倒置显微镜下观察,随机选取5个视野的细胞计数,取均数。
细胞侵袭实验取对数生长期的细胞(1×105)接种于预先铺有25 μL的Matrigel 胶小室,其余步骤与迁移实验一致。使用棉签棒擦拭上室中未穿膜细胞;倒置显微镜下观察,随机选取5个视野的细胞计数,取均数。
1.9 统计学处理
采用 SPSS 17.0 统计软件分析。计量资料用±s表示,组间比较采用t检验和单因素方差分析,P<0.05 认为差异有统计学意义。
2 结果
2.1 肝细胞癌患者临床病理指标
剔除拒绝入组及不符合入组条件者,本实验入组114例确诊的HCC患者,年龄范围为48~82岁(中位数为67岁),年龄为(47.22±15.36)岁,男性为(46.57±11.69)岁,女性为(48.25±19.10)岁;男性76人(66.7%),女性38人(33.3%)。其中,非吸烟患者占(27人)23.7%,吸烟患者占(87人)76.3%。根据肝细胞癌的TNM 分期,患者病理肿瘤分期的分布为Ⅰ期15例,Ⅱ期39例,Ⅲ期51例,Ⅳ期9例(表2)。
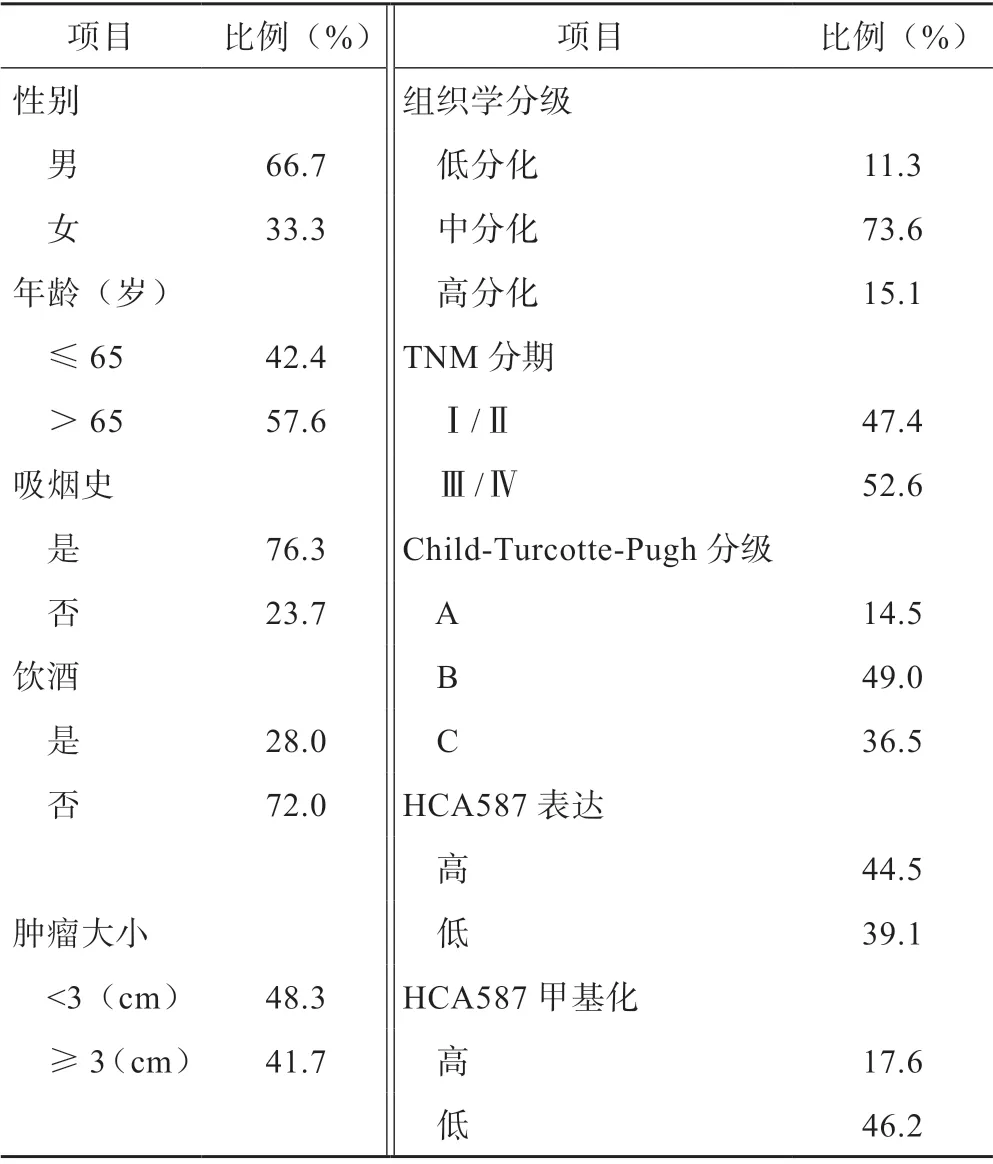
表2 肝细胞癌患者病理特征
2.2 HCA587的表达
应用RT-PCR法研究肝细胞癌患者HCA587基因的转录水平表达,选择肝细胞癌组织及匹配的癌旁非肿瘤组织。结果显示,与癌旁非癌组织组比,肝细胞癌组织中HCA587的mRNA高水平表达,差异有统计学意义(P<0.05,图1A、B)。

图1 HCA587 mRNA的表达。
2.3 肝细胞癌组织中HCA587翻译水平和表达变化
HCA587在肝细胞癌组织中的蛋白表达检测,免疫印迹检测结果与RT-qPCR结果一致,与癌旁非癌组织组比,肝细胞癌组织中HCA587的蛋白水平上调,差异均有统计学意义(图2A)。免疫组织化学结果显示,肝细胞癌组中的HCA587阳性率高于癌旁非癌组织(图2B)。

图2 HCA587在肝细胞癌中的表达。
2.4 HCA587启动子区甲基化水平
NT组及HCC组基因HCA587基因启动子区CpG岛甲基化水平分布图见图3,HCC组HCA587启动子区CpG岛平均甲基化率为(15.61±6.85)%,NT组平均甲基化率为(19.89±5.22)%,HCC组HCA587基因启动子区CpG岛的甲基化水平较NT组低,差异有统计学意义(P<0.05)。

图3 HCA587基因启动子区甲基化检测结果,HCA587基因启动子区CpG岛甲基化水平分布图.
2.5 5-Azacytidine抑制HCA587的甲基化,并促进HCA587的mRNA表达
使用5-Azacytidine处理HCC细胞后发现,HCA587的 mRNA表达较对照组显著增加(表3,P<0.05);但是,HCA587的甲基化水平较对照组显著降低(表3,P<0.05)。
表3 5-Azacytidine 对HCC细胞中HCA587的mRNA和甲基化水平影响(n=3,±s)

表3 5-Azacytidine 对HCC细胞中HCA587的mRNA和甲基化水平影响(n=3,±s)
*P<0.05 vs对照组
组别 HCA587 mRNA HCA587甲基化对照组 2.669±0.547 1.000±0.012 5-Azacytidine 12.536±2.997* 0.651±0.324*
2.6 5-Azacytidine 促进HCA587和TAF9的结合
使用5-Azacytidine处理肝细胞癌细胞。使用免疫沉淀法研究细胞中HCA587和TAF9的直接作用。免疫印迹检测结果表明,与5-Azacytidine处理前比,HCA587和TAF9的免疫沉淀复合物增加(图4A、B)。结果表明,肝细胞癌细胞中5-Azacytidine可促进HCA587和TAF9的结合。
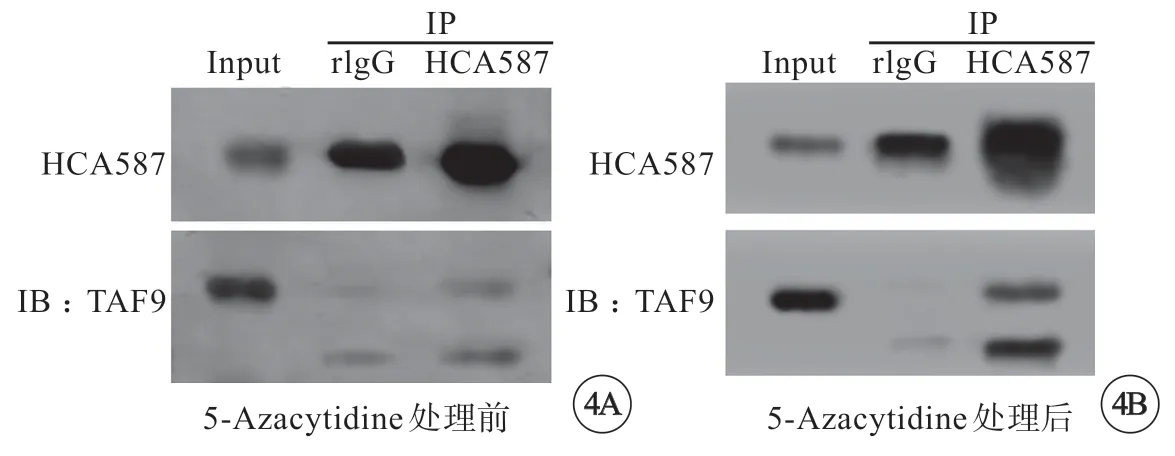
图4 5-Azacytidine 处理肝细胞癌细胞后,使用免疫沉淀技术检测HCA587和TAF9的结合。IP:免疫沉淀。
2.7 5-Azacytidine或过表达HCA587上调HCC细胞的迁移和侵袭
进一步检测5-Azacytidine及pcDNA3.1-HCA587处理肝细胞癌细胞对细胞迁移和侵袭的影响(图5A、B),与对照组比,5-Azacytidine促进肝细胞癌细胞的迁移细胞数量和侵袭细胞数量,差异均有统计学意义(P<0.018)(图5A、B),过表达HCA587促进肝细胞癌细胞的迁移和侵袭能力,与空载体组比,pcDNA3.1-HCA587组的迁移细胞数和侵袭细胞数明显增多,差异有统计学意义(P<0.05)。

图5 Twanswell小室法检测过表达HCA587对HCC细胞侵袭细胞数的影响。A1~E1:Transwell细胞迁移结果(A1~D1)及迁移细胞数统计柱形图(E1),标尺=20μm;A2~E2:Transwell细胞侵袭结果(A2~D2)及侵袭细胞数统计柱形图(E2),标尺=20 μm。*P<0.05 vs对照组;#P<0.05 vs 空载体组。
3 讨论
肝细胞癌是五大最常见的癌症类型之一,具有高复发率,缺乏有效的化疗和放疗手段[10],多种致癌信号通路的失调是肝细胞癌的关键特征,本研究认为这些失调的信号机制中可能也包括HCA587启动子区甲基化改变和HCA587/MAGE-C2-TAF9信号调节机制。
HCA587/MAGEC2是一种肿瘤-睾丸(cancer testis,CT)抗原,在多种恶性肿瘤中表达,包括肝细胞癌、黑素瘤、膀胱癌、头颈癌、乳腺癌和肺癌[11]。先前的研究主要集中在确定HCA587/MAGEC2作为肿瘤免疫治疗靶标的潜力;且已证明HCA587/MAGEC2具有免疫原性,可在患有HCA587/MAGEC2表达的肿瘤患者中诱发自发性抗体和T细胞免疫反应[7,12-13]。而且先前的研究表明,HCA587/MAGEC2在癌细胞中的表达可能介导肿瘤细胞的转移潜能[14-16]。肝细胞癌等恶性肿瘤的转移是预后差的关键原因,先前的报道表明HCA587/MAGEC2还可通过与信号转导与转录激活因子3(signal transduction and transcriptional activator 3,STAT3)结合来促进肿瘤转移[16],这与本研究结果相似。本研究结果显示,肝细胞癌细胞中过表达HCA587后,细胞的体外迁移和侵袭能力均明显上调,意味着HCA587可能是促进肝细胞癌转移的关键抗原之一。
本研究结果表明,肝细胞癌细胞中TAF9能明显与HCA587/MAGEC2进行结合,该结果与先前的研究一致,TAF9是HCA587/MAGEC2的结合伴侣。TAF9和HCA587/MAGEC2共定位于细胞核中,而且通过免疫沉淀试验证明了HCA587/MAGEC2与TAF9在肿瘤细胞内的内源性相互作用[6],TAF9是一种具有调节转录延伸调控因子和细胞周期控制关键基因的基因,介导G1/S周期过渡、细胞极性、细胞完整性[17]。因此,HCA587与TAF9相互作用可能与肿瘤细胞的生长和侵袭能力有重要关联。Nault等[18]报道,TAF9表达上调与通过切除术治疗的肝细胞癌患者预后差有关。此外,还证明了TAF9与锌指蛋白Gli相互作用并调节Gli活性,用干扰Gli/TAF9相互作用的抑制剂治疗可抑制肿瘤生长[19]。在本研究中,再次证实了TAF9与HCA587/MAGEC2的结合,肝细胞癌细胞中TAF9与HCA587/MAGEC2的结合可能对肿瘤细胞的生长、周期、转移等具有调节作用,但是仍需进一步通过实验证实。
表观遗传学是基于基因表达水平的信息遗传,而肿瘤已被确定为表观遗传疾病[20]。近年来研究证实,表观遗传变化引起染色体失去稳定性、基因非法表达、非整倍性和突变,这些均可导致抑癌基因的转录沉默[21]。在人类基因组中,CpG二核苷酸不协调地分布形成了富含CpG的区域。CpG岛异常甲基化是常见的表观遗传修饰,这是组织特异性而非物种特异性。DNA甲基化对多种细胞功能具有一定影响,比如细胞增殖、凋亡、侵袭、迁移。本研究结果显示,人类肝细胞癌中的HCA587的DNA启动子区的甲基化出现异常,研究表明包括HCA587在内的多个基因肿瘤中以高表达和低甲基化状态存在,并通过转录激活促进肿瘤的进展[22]。因此,推测HCA587的低甲基化和高表达在肝细胞癌中具有关键调节作用。本实验结果与推测的一致,观察的肝细胞癌患者肿瘤组织中HCA587的表达大范围上调,而且通过免疫印迹和免疫组织化学法验证了患者组织中HCA587高表达。通过研究HCA587的表观遗传调控和功能,显示HCA587在人肝细胞癌样本中表达水平较高,且甲基化水平较低,体外证实HCA587的高表达受启动子区域甲基化的调节。这些数据表明,HCA587的低甲基化和高表达可作为肝细胞癌早期检测标记;另外,在体外使用甲基化抑制剂5-Azacytidine后,肝细胞癌细胞的迁移和侵袭能力明显增加。为了验证甲基化抑制后对HCA587功能的影响,观察了5-Azacytidine对HCA587表达的影响,结果显示HCA587的mRNA水平明显增加,而体外使用pcDNA3.1重组质粒过表达HCA587后,同样增加了肝细胞癌细胞的迁移和侵袭能力,表明HCA587的CpG区甲基化改变对人类肝细胞癌的转移可能具有重要意义。
本研究仍有稍许不足,首先样本量仍需进一步扩大,明确HCA587的甲基化在肝细胞癌不同分期中的变化,在体内分析HCA587的表达和甲基化水平与患者5年生存期的相关性;另外,仍需进一步明确TAF9与HCA587/MAGEC2结合可能对肿瘤细胞的生长、周期、转移等影响。
综上所述,本研究目前的工作表明,HCA587基因在肝细胞癌中具有高表达和低甲基化趋势。而且,HCA587表达和甲基化水平改变是调节肝细胞癌转移的关键机制之一。本研究为肝细胞癌的治疗靶点研究提供了有价值的实验基础。

