LncRNA PiHL在奥沙利铂耐药结直肠癌细胞中的作用及初步机制
李思,田思雨,袁宏
(1.大连医科大学附属第一医院检验科,辽宁大连116011;2.大连医科大学检验医学院,辽宁大连 116044;3.大连市中心医院检验科,辽宁大连 116089)
结直肠癌(colorectal cancer, CRC)作为目前世界上第三位常见癌症,每年全球范围内约有140万例新增病例以及超过60万的死亡病例[1]。目前,奥沙利铂与5-氟尿嘧啶(5-FU)和亚叶酸(FOLFOX)联合化疗方案在转移性结直肠癌中的缓解率仅为50%[2]。化疗患者发生转移和产生化疗耐药性仍然是结直肠癌治疗的关键障碍。研究表明,LncRNA在癌症的发生和转移中起着重要作用,多种异常表达的LncRNA可作为癌基因或抑癌基因发挥重要功能[3]。最近的研究发现,LncRNA表达失调与结直肠癌的化学耐药有关[4]。目前研究表明,LncRNA主要通过多种机制介导癌症耐药,包括限制药物在细胞内的积累[5],增加DNA损伤修复[6]等。LncRNA PiHL是定位于核内的LncRNA,在结直肠癌中的表达水平显著上调,且PiHL的表达与结直肠癌肿瘤体积和患者预后相关。但是PiHL在结直肠癌耐药中的具体功能和作用机制仍不清楚。为了进一步明确PiHL在结直肠癌化疗耐药中的关键作用,本课题组构建了结直肠癌奥沙利铂耐药细胞系,确定了PiHL在耐药细胞系中呈高表达;通过体外生物学实验证实结直肠癌细胞中PiHL的表达水平对奥沙利铂作用的影响;并探讨PiHL通过与多梳抑制复合物结合介导奥沙利铂的耐药,初步阐明其机理。报道如下。
1 材料与方法
1.1细胞系、试剂与仪器 人结直肠癌细胞系SW620、SW480、DLD1、HCT116和人胚肾上皮细胞HEK293T均购自中国科学院上海生命科学院研究所。DMEM高糖培养基(美国Hyclone公司),胎牛血清(美国Gibco公司),引物均购自大连宝生物公司,奥沙利铂(美国MCE公司),慢病毒(上海杰李公司),PrimeScriptTMRT reagent Kit with gDNA Eraser(日本TaKaRa公司),FastStart Universal SYBR Green Master(Rox,瑞士Roche公司),RNAmax T7体外转录试剂盒(广州锐博生物公司);Lipofectamine 3000转染试剂(美国Thermo Fisher公司)。Applied Biosystems 7500 实时荧光定量PCR仪(美国ABI公司),Multiskan GO全波长酶标仪(美国Thermo Fisher公司),水平电泳仪(上海天能科技公司),流式细胞仪(美国Beckman公司),NanoDrop微量分光光度计(美国赛默飞世尔科技公司)。
1.2细胞毒性实验 取对数生长期的上述细胞用2.5 g/L胰蛋白酶消化,铺于96孔细胞培养板中(1 000个/孔),第2天加入含奥沙利铂培养基处理,分别设置对照组(加入0.5%DMSO)、空白组(无细胞)及加药组(不同细胞的加药浓度不同,根据细胞的IC50确定)。置于37 ℃、5%CO2培养箱中培养5 d,加入不含血清培养基的CCK8试剂(每孔100 μL,1∶10稀释),37 ℃培养箱温育1~2 h,于450 nm波长下检测吸光度A值,并计算各组存活率。
1.3奥沙利铂耐药细胞系的构建 取处于对数生长期且状态良好的结直肠癌细胞HCT116、DLD1、SW480、SW620,用含(初浓度为0.1 μmol/L)奥沙利铂的DMEM培养基接种于培养皿中常规培养。当细胞能维持正常生长且存活率大于50%时,根据不同细胞的存活状况提高药物浓度,反复诱导,直至细胞能够在含一定浓度的奥沙利铂和10%胎牛血清的DMEM培养基中正常生长,细胞存活率与正常细胞无显著差异。
1.4构建稳定过表达PiHL结直肠癌细胞系和稳定干扰PiHL结直肠癌细胞系 构建PiHL过表达质粒和包含PiHL靶向序列的shRNA,按照Lipofectamine 3000转染试剂说明书配制病毒包装体系(即病毒包装)。向含待转染且处于对数生长期的结直肠癌细胞的6孔细胞培养板中加入1.5 mL新培养基及500 μL病毒液(室温融化),加入2 μL polybrene转染试剂,培养48 h后用 0.5 μg/mL嘌呤霉素筛选并继续培养稳转株。
1.5流式细胞术测定细胞凋亡 取对数生长期且未经处理的结直肠癌细胞(对照组)和干扰PIHL表达的结直肠癌细胞(实验组)接种于6孔细胞培养板内,第2天更换新的培养液并加入奥沙利铂作用24 h,使用无EDTA的胰蛋白酶消化,收集细胞并用PBS洗涤;加入缓冲液、Annexin V以及FITC PI染液,室温避光温育15 min;设置未染色、Annexin V单染、PI单染作为空白对照。采用流式细胞仪检测,计数20 000个细胞,使用Flowjo软件分析细胞凋亡情况。
1.6实时荧光定量PCR(qRT-PCR)检测 收集上述对数生长期细胞,Trizol试剂提取细胞中的总RNA,按照PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒将RNA反转录为cDNA,样本置于-20 ℃保存,提取的RNA/DNA使用Nandrop2000微量分光光度计测定浓度和纯度,选取吸光度比值(A260 nm/A280 nm)在1.8~2.0之间的样本用于后续实验。PCR总反应体积为 20 μL,包括:TBGreenPremix Ex TaqⅡ(2×)10 μL,10 μmol/L上、下游引物各0.8 μL,DNA模板2 μL,灭菌水6.4 μL。循环参数:95 ℃ 30 s;95 ℃ 5 s,56 ℃ 20 s,共40个循环。在56 ℃时收集每个循环的荧光信号,进行熔解曲线分析。采用仪器自带软件分析扩增曲线和熔解曲线中的荧光信号,并计算平均阈值循环数(Ct值)。以β-actin作为内参,通过2-ΔΔCt法计算待测基因的相对表达量。
1.7western blot检测PiHL过表达和干扰后EZH2的表达变化 使用慢病毒作为载体,构建稳定过表达PiHL的DLD1、HCT116细胞及其阴性对照(NC组),稳定干扰PiHL的DLD1-oxa、HCT116-oxa细胞及其阴性对照组。将细胞分别接种于6孔细胞培养板中,当细胞融合度达90%、单孔细胞总数不少于106个时,收集细胞,用预冷的PBS洗涤并用RIPA缓冲液裂解。使用BCA试剂盒测定细胞裂解液中的蛋白质水平,用含10% SDS的PAGE电泳分离总蛋白质,使用湿转转膜仪调节稳定电流为300 mA,根据所要检测蛋白质分子量大小设置转膜时间。用含5%BSA的TBST封闭PVDF膜,室温摇床振荡温育2 h。再次用TBST充分洗涤后,加入兔抗anti-EZH2多克隆抗体(1∶1 000稀释)4 ℃摇床温育过夜。加入辣根过氧化物酶偶联的山羊抗兔抗体anti-IgG(1∶1 000稀释)室温摇床振荡反应2 h。使用ECL显色试剂在避光环境中显影,扫描成像后采用Image J软件对目的条带进行灰度分析。
1.8RNA pull-down试验检测PiHL与EZH2蛋白的结合 利用T7 RNA合成酶识别序列合成引物,以cDNA为模板扩增出携带T7 RNA合成酶识别序列的PiHL全长DNA产物,进行体外转录,去除cDNA模板并对产物纯化后得到LncRNA PiHL并标记上生物素,将PiHL与结直肠癌细胞HCT116的细胞核裂解液反应,并用亲和素标记的磁珠将PiHL结合的蛋白质复合体进行纯化,用EZH2抗体进行western blot。
1.9统计学分析 使用SPSS 23.0统计软件分析,图表绘制使用Graphpad 8.0软件;实验组与对照组差异的比较采用配对t检验。Spearman检验进行相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1PiHL在4种奥沙利铂耐药结直肠癌细胞系中的表达水平 所构建的耐药细胞系对奥沙利铂产生显著稳定的耐药性(图1),奥沙利铂在不同细胞的IC50值见表1。进一步通过qRT-PCR检测HCT116、DLD1、SW620、SW480结直肠癌细胞和其对应耐药细胞系中PiHL的表达水平,结果发现耐药细胞系PiHL的表达水平较亲本细胞均显著升高,差异具有统计学意义。见图2。
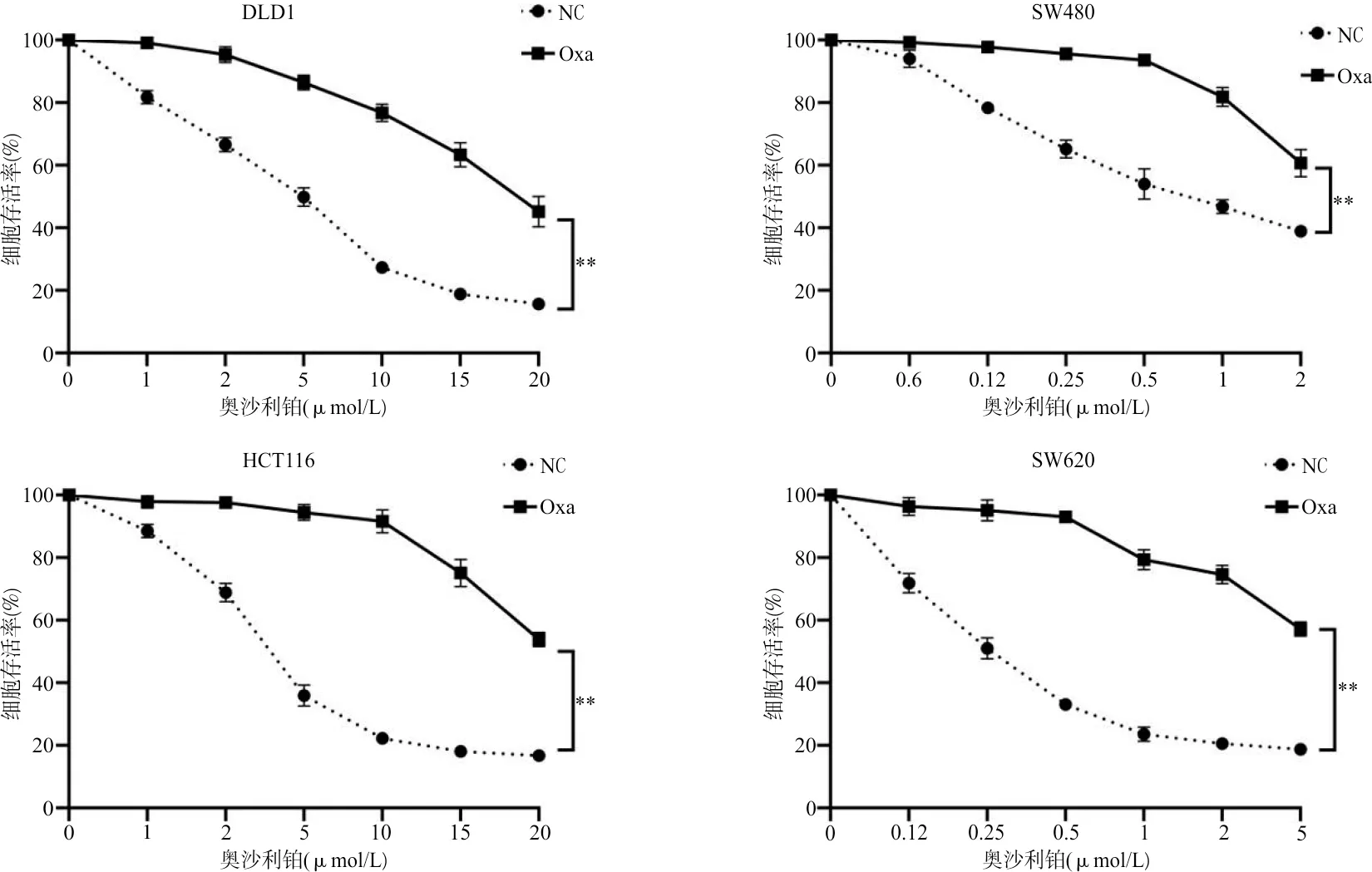
图1 CCK8法检测结直肠癌亲本和耐药细胞系奥沙利铂敏感性

表1 奥沙利铂在不同细胞中的IC50值(μmol/L)

注:与对照组相比,**,P<0.01。
2.2PiHL促进结直肠癌细胞对奥沙利铂耐药 CCK8法结果显示,在HCT116、DLD1、SW480细胞中,PiHL基因被稳定过表达后,在相同浓度奥沙利铂作用下细胞的存活率均显著高于对照组(图3),流式细胞术检测细胞凋亡结果显示,过表达PiHL组奥沙利铂诱导的细胞凋亡比例较对照组明显减少(图4),细胞系对奥沙利铂敏感性明显降低。在耐药结直肠癌细胞系中,奥沙利铂作用下shRNA PiHL1和shRNA PiHL组细胞存活率明显低于对照组,并且细胞凋亡比例明显增加。见图5、6。

注:与对照组相比,*,P<0.05。

注:与对照组相比,*,P<0.05。

注:与对照组相比,*,P<0.05;**,P<0.01。

注:与对照组相比,*,P<0.05;**,P<0.01。
2.3PiHL通过与EZH2结合对CDKN2B/RUNX3/KLF家族基因进行表观遗传抑制 对TCGA数据库结直肠癌组织样本进行分析发现,PiHL的表达和PRC2的组成成分EZH2、SUZ12、EED的表达呈显著正相关(图7)。RNA pull-down试验和western blot验证PiHL与多梳抑制复合物作用的结果如图8所示,RNA PiHL可以与EZH2蛋白结合,且PiHL的反义链几乎不能与EZH2蛋白结合。此外,western blot检测PiHL过表达和干扰后EZH2的表达变化,结果显示在DLD1和HCT116细胞中,PiHL表达水平的改变并不直接影响EZH2蛋白的表达水平(图9)。为了进一步鉴定涉及PiHL参与表观遗传调控过程的基因,利用构建的干扰PiHL表达HCT116细胞和对照HCT116细胞进行RNA测序,结果显示,PiHL敲除后存在大量差异表达的基因。在火山图分析中,鉴定出多个与其表达水平相差2倍以上及P<0.001的基因,其中包括多个重要的PRC2靶基因。在奥沙利铂耐药的HCT116、DLD1细胞中干扰PiHL并使用qRT-PCR进一步验证,结果显示在HCT116、DLD1细胞中干扰PiHL表达后抑癌基因CDKN2B、KLF2、KLF6、RUNX3表达显著上调(图10)。

图7 TCGA数据库中PiHL与PRC2组分的相关性

图8 RNA pull-down结合western blot检测PiHL与EZH2蛋白的结合
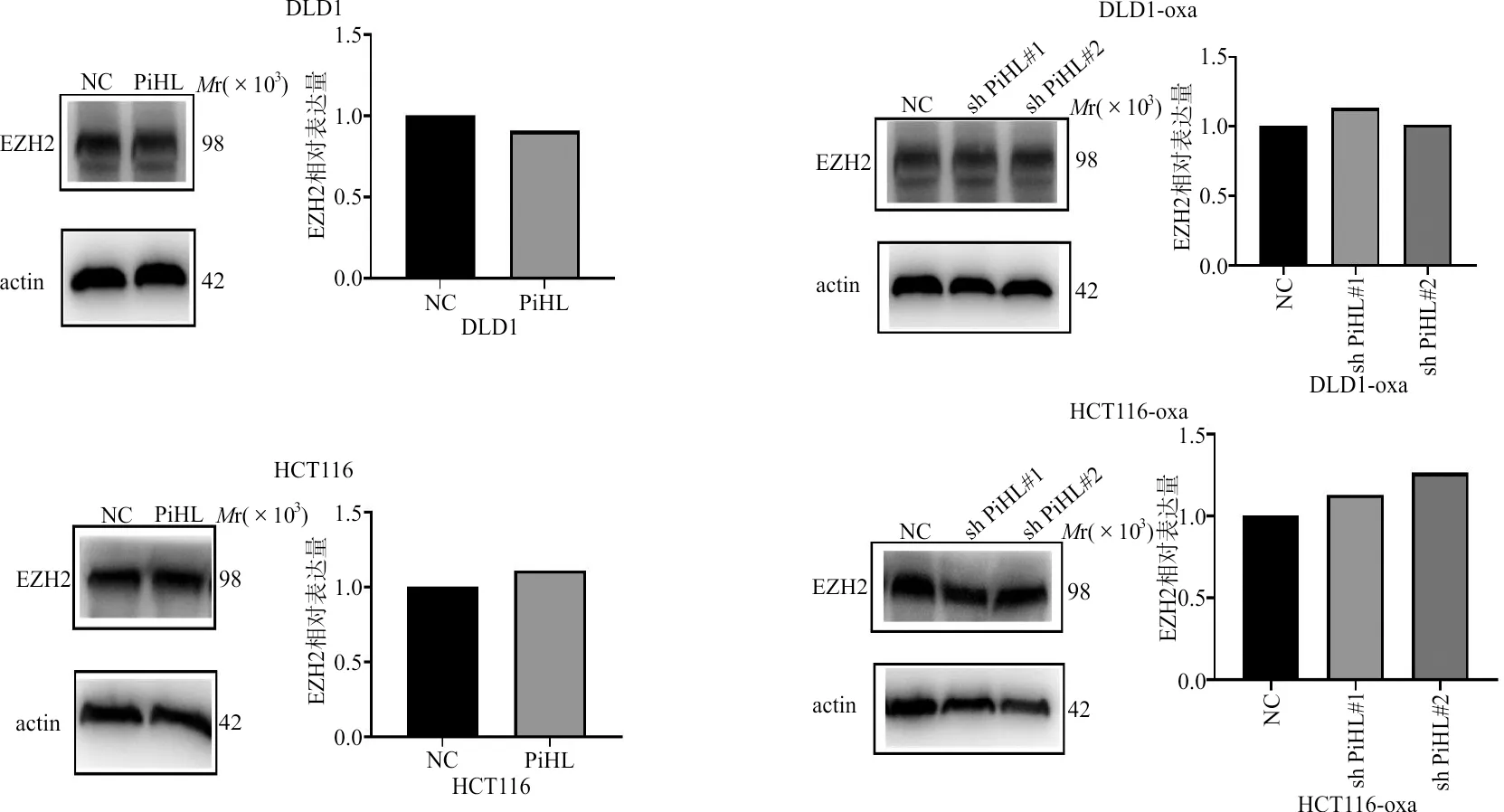
图9 western blot检测PiHL对EZH2蛋白的调控作用
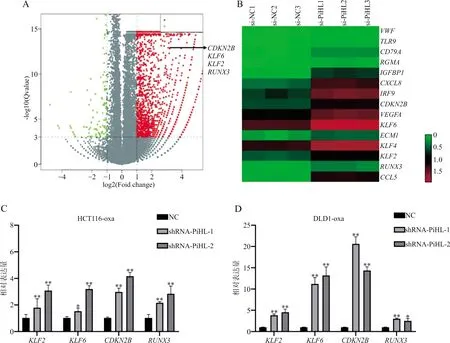
注:A,基因火山图;B,部分基因热图;C、D,qRT-PCR检测干扰PiHL表达后细胞中PRC2靶基因的表达;与对照组相比,*,P<0.05;**,P<0.01。
3 讨论
在本研究中,笔者根据PiHL在结直肠癌细胞中呈高表达且其表达水平与结直肠癌肿瘤体积和患者预后相关,进而提出了PiHL可能参与介导结直肠癌耐药的假设。由于不同细胞系TP53、KRAS等重要基因的突变背景不同,可能对药物敏感性产生一定影响,为了进一步确定PiHL在细胞耐药中的功能,本实验利用4种结直肠癌细胞通过体外持续诱导的方式构建了其对应的稳定的奥沙利铂耐药细胞系,并检测了亲本和耐药细胞系中PiHL的表达水平。结果显示,PiHL在耐药细胞系HCT116-oxa、DLD1-oxa、SW620-oxa、SW480-oxa中的表达水平显著高于正常细胞,提示PiHL可能参与了奥沙利铂的耐药机制并对肿瘤耐药起到促进作用。为明确PiHL在结直肠癌奥沙利铂耐药中的功能,笔者进一步通过试验得出稳定过表达PiHL可以增加细胞在奥沙利铂处理后的存活率,减少奥沙利铂诱导的细胞凋亡;耐药细胞敲除PiHL后细胞存活率明显低于对照组,药物诱导的凋亡比例显著增高,提示PiHL可能保护结直肠癌细胞免受奥沙利铂诱导的凋亡。以上数据均进一步证实PiHL的表达水平影响细胞对奥沙利铂的敏感性,PiHL表达上调可以促进结直肠癌细胞耐药,PiHL表达缺失则对细胞耐药起负向调节作用。
近年来,LncRNA被认为是PRC2功能的重要参与者,细胞核内LncRNA通过与PRC2结合,调控下游基因的表达,在多种生物学过程中发挥重要作用[7]。笔者对TCGA数据库中结直肠癌组织样本进行分析,发现PiHL表达和PRC2的组成成分EZH2、SUZ12、EED的表达存在显著正相关。qRT-PCR分析结直肠癌组织样本中的基因表达情况也证实癌组织中PiHL的表达水平与EZH2呈正相关,提示PiHL可能参与PRC2介导的表观遗传调控机制。为了验证假设,笔者在HCT116细胞中使用EZH2抗体进行RNA pull-down及western blot,结果显示体外转录的LncRNA PiHL可以与细胞中的EZH2蛋白直接结合。同时,western blot结果显示,PiHL并不直接调控EZH2蛋白的表达,表明PiHL通过与EZH2结合参与表观遗传调控机制。为了进一步鉴定涉及PiHL参与表观遗传调控过程的基因,笔者对干扰PiHL表达的HCT116细胞和对照HCT116细胞进行RNA测序分析,结果显示PiHL敲除后存在大量差异表达的基因,这些变化的基因中包括多个重要的PRC2靶基因。研究报道,多个肿瘤抑制基因如KLF2、RUNX3、CDH1、CDKN1C、CDKN2B、P14和P16等参与PRC2介导的癌症进展[8-10]。笔者通过阅读文献和qRT-PCR进一步筛选和验证,结果显示,与对照组细胞相比,PiHL表达下调显著增加了CDKN2B、KLF2、KLF6、RUNX3等基因的表达。结合上述文献结果,证实了结直肠癌细胞中PiHL的表达水平与对奥沙利铂的敏感性有关,PiHL的高表达可以抑制奥沙利铂诱导的细胞凋亡,促进结直肠癌细胞对奥沙利铂耐药。PiHL通过与多梳抑制复合物中EZH2蛋白结合表观遗传沉默重要的抑癌基因CDKN2B、KLF2、KLF6、RUNX3的表达,可能是结直肠癌细胞中奥沙利铂耐药的重要机制。在将来的研究中,笔者将通过回顾性实验进一步证实EZH2对这些抑癌基因的调控关系,并且在临床样本中探讨LncRNA PiHL的应用价值。

