胰岛素对糖尿病大鼠颌下腺超微结构的影响
胡惠贞,贾雪梅,桂 丽
(1.安徽卫生健康职业学院医学系,安徽 池州 247000;2.安徽医科大学基础医学院;3.安徽医科大学临床医学院,安徽 合肥 230032)
颌下腺位于下颌体内面的颌下腺凹内,兼有内外分泌功能,外分泌70%的唾液进入口腔,内分泌生物活性肽经血液循环调节多种组织和细胞的生理活动,目前发现其分泌的活性肽已有30多种。糖尿病是以血葡萄糖水平升高为特征的代谢疾病群,近年来,其发病率逐渐升高,成为全球患病率较高的一种慢性疾病,严重威胁了人们的健康,影响了人们的生活质量[1]。颌下腺具有特殊的生物学功能,其在糖尿病发病时的病理变化越来越受到人们的关注,研究发现糖尿病大鼠颌下腺光镜结构出现了紊乱[2],但随着病程的发展,糖尿病大鼠颌下腺的电镜结构有什么变化?作为治疗糖尿病的经典药物,胰岛素对糖尿病颌下腺电镜结构又有哪些影响?目前尚未可知,本实验通过复制糖尿病大鼠模型并给予胰岛素治疗,观察各组大鼠颌下腺的电镜结构,为探索胰岛素治疗糖尿病并发症的可能机制提供形态学依据。
1 材料和方法
1.1 实验动物雄性SD大鼠,6周龄,体质量150~180 g,安徽医科大学基础医学院动物实验中心提供,普通级。大鼠自由摄食,饲养室室温(22±2)℃,湿度50%,昼夜交替12 h。
1.2 主要试剂及仪器设备链脲佐菌素(美国Sigma公司生产)。LKB-NOVA型超薄切片机(瑞士DAKO公司),JEM-1230型透射电镜(日本JEOL公司)。
1.3 方法48只雄性SD大鼠,随机选择16只为对照组,给予一般饲料喂养,自由摄取食水;32只给予高脂饲料喂养2个月,待其产生胰岛素抵抗(连续2次餐后血糖>11.1 mmol/L)后,腹腔注射2% 链脲佐菌素(25 mg/kg)一次,7 d后抽血检测空腹血糖>7.0 mmol/L,提示Ⅱ型糖尿病大鼠模型造模成功。造模成功的大鼠再随机分为治疗组及糖尿病组,每组各16只。治疗组每天上午9点给予皮下注射胰岛素(4 iu/kg),糖尿病组不给予任何处理。三组大鼠均予一般饲料喂养,不限食水。
1.4 观察指标
1.4.1 FBG水平检测 在造模成功给予相应处置后3个月和6个月,每组各随机抽取8只大鼠,禁食12 h,用20%乌拉坦1 mL/100 g予以腹腔注射,麻醉后剖开腹腔,迅速从腹腔静脉抽血5 mL送检FBG,并取出各组大鼠下颌下腺组织。
1.4.2 颌下腺组织观察 将颌下腺组织用双面刀片修成1 mm3小块并用2.5%戊二醛溶液固定,环氧树脂包埋后进行切片(70 nm),将切片置入饱和醋酸铀水溶液中染色30 min,水洗后经柠檬酸铅染液15 min,JEM-1230透射电镜观察并摄片。
1.5 统计学分析运用SPSS 22.0统计学分析软件,计量数据用“均数±标准差”表示;各组大鼠FBG浓度进行单因素方差分析,组间差异采用q检验,两组间比较采用独立样本t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 各组FBG结果(1)组内比较:对照组大鼠在3个月和6个月FBG保持稳定,两个时间点无统计学差异(P>0.05);糖尿病组大鼠随病程的延长FBG显著升高,在造模后3个月和造模后6个月两个时间点差异具有显著性(P<0.05);治疗组大鼠随着病程的延长升高,在造模后3个月和造模后6个月两个时间点差异也具有显著性(P<0.05)。(2)组间比较:造模后3个月,糖尿病组显著高于对照组,治疗组较糖尿病组显著降低,但较对照组升高,三组间比较均有统计学差异(P<0.05);造模后6个月,糖尿病组显著高于对照组,治疗组较糖尿病组显著降低,但较对照组升高,三组间比较均有差异(P<0.05),见表1。

表1 各组大鼠FBG浓度比较(mmol/L)
2.2 电镜观察
2.2.1 颗粒曲管上皮细胞 造模后3个月:对照组上皮细胞内线粒体结构饱满清晰,嵴完整(图1-A);糖尿病组结构不清,线粒体内有少量空泡,嵴断裂(图1-B);治疗组线粒体结构清楚(图1-C)。造模后6个月:与对照组(图1-D)及造模后3个月糖尿病组比较(图1-B),糖尿病组线粒体膜不完整,结构不清,空泡增多(图1-E),治疗组线粒体结构清晰,嵴稍松散(图1-F)。
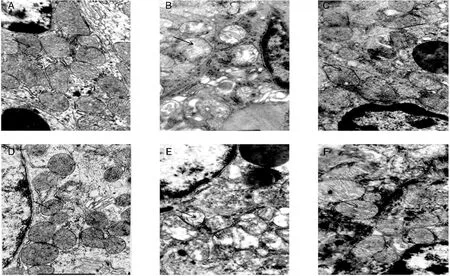
图1 大鼠颌下腺颗粒曲管上皮细胞内线粒体(×10000)
2.2.2 颌下腺腺细胞 造模后3个月:对照组腺细胞内粗面内质网呈扁平囊状,板层状排列,结构紧密,内腔均匀(图2-A);糖尿病组粗面内质网结构稍松散,内腔轻度扩大(图2-B);治疗组粗面内质网结构正常(图2-C)。造模后6个月:糖尿病组粗面内质网扩张呈囊泡状,结构疏松(图2-E),治疗组可见少量粗面内质网呈管状扩张(图2-F)。
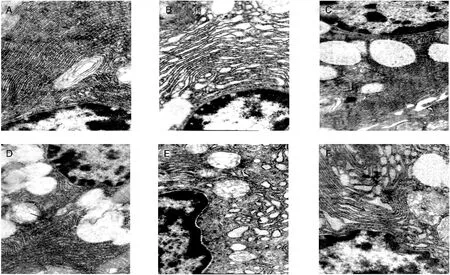
图2 大鼠颌下腺腺细胞内粗面内质网(×10000)
3 讨论
糖尿病主要是因胰岛素抵抗或胰岛素分泌不足导致的一组以高血糖为特征的代谢性疾病,久病可引起多器官的损伤。研究表明,体脂含量升高和体脂分布失常易导致机体对胰岛素不敏感,诱发加重胰岛B细胞功能损害,引起糖代谢紊乱,本实验通过喂养高脂饮食引起大鼠产生胰岛素抵抗后注射链脲佐菌素,成功复制了糖尿病动物模型。本实验发现,糖尿病大鼠颌下腺导管细胞出现线粒体嵴断裂并呈空泡样改变,腺细胞内粗面内质网呈囊泡状扩张,且这些改变随着病程的延长加剧。引起糖尿病大鼠颌下腺出现上述结构变化的因素可能有:(1)高血糖引起大量自由基生成,致使机体发生氧化应激直接引起组织结构损伤;(2)葡萄糖多元醇通路的激活,使其转化为山梨醇,后者亲水性强,会导致细胞水肿变性,结构损伤;(3)糖尿病大鼠颌下腺内nNOS表达升高和NT-3表达降低,致使颌下腺内氧化反应加剧及其支配神经营养缺乏,从而引起结构紊乱[3]。线粒体是细胞进行有氧呼吸的主要结构,线粒体内膜向基质折叠形成线粒体嵴,其上有含线粒体合酶的线粒体基粒,能合成三磷酸腺苷为细胞的新陈代谢提供能量,粗面内质网是由多层扁平膜囊状的核糖体及内质网共同构成的复合结构,是蛋白质大分子的合成场所。糖尿病引起颌下腺内线粒体及粗面内质网的病变,会直接影响颌下腺功能及其内生物大分子的合成,可能是导致糖尿病患者唾液流率下降[4]、并引起其内水通道蛋白1、5和8[5-6]、血管内皮生长因子和转化生长因子β1[7]等表达异常的原因之一。而鉴于颌下腺不仅能外分泌唾液经导管进入消化道参与消化生理过程,还能分泌多种生物活性物质参与调节机体的功能活动,所以其内生物活性物质的改变还有可能引起胃肠及其靶器官功能的改变,但它们之间具体的关联性还有待进一步研究。
研究表明Ⅱ型糖尿病患者的胰岛B细胞水平低于正常健康个体,致使胰岛素分泌不足[8],而胰岛素作为体内唯一降血糖的激素,可通过提高葡萄糖的利用和脂肪的合成,抑制糖原及脂肪的分解氧化等途径来降低血糖,另外其自身还具有免疫调节及神经营养的功能,因此及时给予合理、规范的胰岛素治疗对控制Ⅱ型糖尿病患者的血糖血脂及胰岛B细胞功能的损害极为关键[9-10],李红等研究发现对于初发Ⅱ型糖尿病患者使用胰岛素治疗,能有效控制血糖,减轻胰岛素抵抗,改善胰岛B细胞功能,并通过改变患者的脂质代谢紊乱,减轻炎性反应[11-12]。本实验在糖尿病造模成功即给予大鼠胰岛素治疗,使治疗组大鼠血糖水平较糖尿病组显著降低,并通过降低颌下腺内nNOS表达及增加NT-3表达[3]有效地控制了高血糖对颌下腺结构造成的损伤,仅在造模6个月时出现轻微改变,鉴于颌下腺的内外分泌腺功能,这也可能是胰岛素控制糖尿病并发症的原因之一。同时,我们也必须要注意到给予糖尿病患者外援性的胰岛素治疗,虽可很好的控制血糖,但其不能及时和体内血糖水平同步调节,在运动、饮食等因素的影响下,会造成患者体内即时血糖水平发生波动,甚至会出现低血糖。吴方团[13]等研究也提示老年Ⅱ型糖尿病患者的血糖控制水平既要考虑高血糖对靶器官的损害,也要避免发生低血糖,因此胰岛素治疗期间大鼠是否有血糖波动甚至低血糖的情况发生,以及如何降低低血糖发生风险将是我们下一步研究的方向。

